柱层析循环法联合提取脐橙皮中橙皮苷与多糖的工艺研究
2013-05-15韩寒冰刘杰凤
韩寒冰,周 天,刘杰凤,马 超,王 颖
(广东石油化工学院化学与生命科学学院,广东茂名525000)
脐橙是芸香科柑橘属甜橙类(Citrussinensis L.Osbeck)中的一个栽培品种,营养丰富,含有人体所必需的多种营养成分。由于脐橙果皮中含有果胶、类黄酮、香精油、色素和多糖等多种有效成分[1-2]。随着种植面积和规模的迅速扩大,占脐橙果重20%的果皮也成为具有巨大开发潜力的资源。其中橙皮苷(Hesperidin,C28H34O15)是脐橙果皮中最主要的类黄酮,药理研究表明,橙皮苷具有抗氧化、抗炎镇痛、免疫调节和抗肿瘤等作用[3-4]。多糖具有清除自由基和抗氧化作用,在抗肿瘤、抗肝炎、抗心血管和抗衰老等方面有独特的生物活性,而且对细胞毒性极低[5-7],因此具有极高的药学价值。
近年来,对类黄酮物质和多糖的提取常用索氏提取法、超声波和微波辅助提取法[6-9],但以上方法都普遍存在工艺都比较复杂、提取时间长、溶剂用量大、分离纯化程序复杂等缺陷。另外,这些方法都只孤立地考虑提取其中的一种功能成分,必定造成材料和溶剂的浪费。随着现代科学技术的发展,柱层析循环法已广泛应用于天然植物有效成分的提取和分离,具有溶剂消耗量少、提取效率高、处理时间短、操作简便等优点[10-12]。本研究采用柱层析循环法对脐橙皮的橙皮苷和多糖进行联合提取,确定影响效果的主要因素和分离优化工艺条件,为有效地提取脐橙皮的橙皮苷和多糖开辟了新途径。
1 材料与方法
1.1 材料与仪器
脐橙 从本地商场购买江西产新鲜脐橙,剥下果皮剪成黄豆粒大小,50℃烘箱中烘至恒重,材料经粉碎,过40目筛得到等于或小于40目(或≤380μm)的粉末作提取用;橙皮苷标准品 中国药品生物制品检定所提供(No.110722-200810,纯度≥98%);HPLC用甲醇 色谱级,购自美国的Fisher Scientific公司;其他试剂 分析纯。
LC-20A型高效液相色谱仪、LC-20AT型UV检测器 日本岛津公司;DL-6000型低速冷冻大容量离心机 上海安亭科学仪器厂;UV-2550型紫外-可见光分光光度计 日本岛津公司;KQ5200B型超声波清洗器 江苏省昆仑山市超声仪器有限公司;XYFD-8L型冷冻干燥机 上海欣谕仪器有限公司。
1.2 橙皮苷和多糖含量测定
1.2.1 HPLC法测定橙皮苷含量 色谱柱为YMC ODS柱(250mm×4.6mm,5μm),流动相A为甲醇,B为1%冰醋酸水溶液,A∶B=35∶65(v/v)。流速1.0mL/min,柱温40℃,检测波长283nm,进样量10μL。
标准曲线的制作:准确称取橙皮苷对照品若干,用甲醇溶解配制成1mg/mL的橙皮苷对照品溶液,用40%乙醇稀释成一系列的浓度梯度:25、50、75、100、125、150μg/mL,分别进行液相色谱分析,以浓度为横坐标,峰面积为纵坐标,绘制标准曲线。
1.2.2 苯酚硫酸法测定多糖含量 测定多糖用苯酚硫酸法[13],以葡萄糖为对照品,用纯水配成梯度浓度分别为10、20、30、40、50、60μg/mL的葡萄糖标准工作液。以葡萄糖浓度为横坐标,相应的吸光度为纵坐标绘制标准曲线。
1.3 联合提取橙皮苷和多糖的工艺条件
1.3.1 选择溶剂配比 把乙醇和水配制成体积比分别为10∶0、8∶2、6∶4、4∶6、2∶8,0∶10。称取脐橙皮粉末0.5g 6份,分别加入相应配比的溶剂5mL,室温内摇床振荡(200r/min)1h,6000r/min低温离心10min,分别检测橙皮苷和多糖的含量。
1.3.2 确定吸涨率和浸泡时间 称取0.5g脐橙皮粉末12份,并列2组,分别加入40%乙醇或水5mL,室温内摇床振荡(200r/min),浸泡时间分别为0.5、1、2、3、4、5h,到时取出,6000r/min低温离心10min,分别测定上清液体积,用总体积(5mL)减去上清液体积,计算1g材料吸收溶剂量(mL),即吸涨率;分别测定上清液中橙皮苷或多糖的含量,确定目标物质在相应溶剂中溶解达到平衡的浸泡时间。
1.4 柱层析法提取橙皮苷和多糖
1.4.1 柱层析法分别提取橙皮苷和多糖 选取直径为1.5cm的玻璃层析柱,脐橙皮粉末5g,40%乙醇(体积分数)湿样上柱,保持乙醇溶液没过样品,室温静置2h,以吸涨体积(25mL)为一个收集单位(即一份),以每小时收集一份的流速进行收集,共收集3份,残渣经超声1h,抽滤再得到一份提取液,分别测定各份橙皮苷的含量。同样方法,用纯水上样,收集3份水提取液和1份残渣提取液(各35mL),分别测定各份多糖的含量。
1.4.2 柱层析循环法联合提取橙皮苷和多糖 橙皮苷与多糖的提取连续进行,首先提取橙皮苷,方法与分别提取橙皮苷的相同,不同的是当收集完第1份40%乙醇洗脱液(25mL)后,提取液换为纯水,再收集第2份洗脱液(25mL),相当把柱内的乙醇溶液收集完毕。继续添加水,连续收集2份水洗脱液(各35mL)。只保留各提取液中的第1份,第2份提取液由于浓度较低,均作为下一轮的第1份提取液,如此重复循环,共用4根层析柱进行。分别合并各轮中第1份醇和水提取液,测定橙皮苷和多糖含量,计算各轮第1份的提取率。
1.5 橙皮苷与多糖的分离
实验放大100倍,每份脐橙皮粉500g,选择4根直径为8cm的层析柱,作放大循环实验,方法与1.4.2项下相同。合并4根柱第1份醇提取液10L和水提取液14L,共24L。减压浓缩为2L,加8L无水乙醇,充分摇匀,冰箱4℃静置过夜,6000r/min低温离心10min,倾出上清液,沉淀再用2L水溶解,加8L无水乙醇,重复以上实验,合并上清液。橙皮苷溶在上清液中,沉淀为粗多糖,分别测定橙皮苷和多糖的含量。
1.6 橙皮苷和多糖的纯化
将1.5项下中上清液减压浓缩到1L,回收乙醇,浓缩液中橙皮苷析出,低温高速离心,倾去上清液,沉淀用1L水洗,静置离心,倾去上清液,重复水洗2次,沉淀为橙皮苷的粗产品。测定粗产品中橙皮苷的含量,并计算得率。将粗产品充分溶于热水中,置冰箱4℃静置1周,经布氏漏斗抽滤,去掉水液和杂质,用纯水反复冲洗滤纸上的结晶,抽干后连同滤纸置烘箱中烘干,待产品与滤纸分离后,测定产品的总重量及橙皮苷的含量,计算结晶的纯度和得率。结晶产品重结晶,计算重结晶的纯度和得率。
将粗多糖重溶于水中,80%乙醇沉淀,冰箱4℃静置过夜,6000r/min低温离心10min,得沉淀再重复沉淀一次,沉淀经冷冻干燥(-50℃,20Pa)得多糖粉末,经苯酚硫酸法测定多糖含量,并计算多糖的纯度。
2 结果与分析
2.1 提取物橙皮苷HPLC分析和标准曲线
脐橙皮中的橙皮苷含量较高,橙皮苷在283nm有最大的吸收峰[14],HPLC色谱图见图1,图1中样品主峰与对照品橙皮苷的相对保留时间均为14.979min,峰形一致,因而可用橙皮苷的标准曲线来测定样品中的橙皮苷含量。

图1 橙皮苷HPLC色谱图Fig.1 Analysis of hesperidin by HPLC
图2是橙皮苷和多糖的标准曲线,橙皮苷含量的回归方程为:y=1706x-1801(R2=0.9998),说明线性关系良好,线性范围在25~150μg/mL之间。多糖含量的回归方程为y=0.0101x-0.0086(R2=0.9991),线性范围在10~60μg/mL之间。
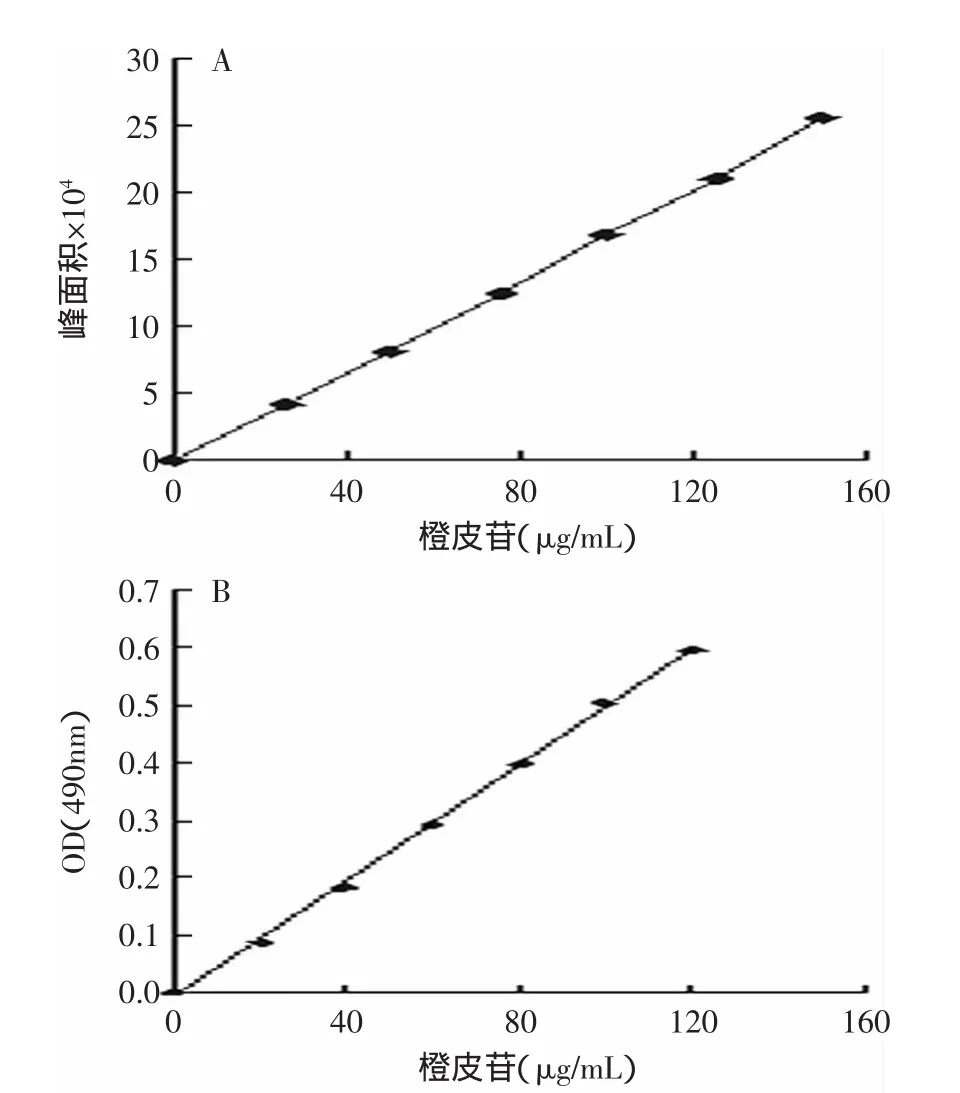
图2 橙皮苷标准曲线和多糖标准曲线Fig.2 Standard solution curves of hesperidin and polysaccharides
2.2 提取工艺条件
橙皮苷易溶于乙醇,难溶于水,从图3(A)可以看出,醇水比为4∶6时的提取率最高,多糖在醇的溶解性很低,易溶于水,从图3(B)可以看出,纯水的多糖提取率最高,随着醇水比值的增大,多糖提取率下降。醇水溶液有效地提取橙皮苷的同时,也把部分多糖提取出来,以水的提取率为100%来计算,醇水比为4∶6溶液的多糖提取率为16.6%。另一方面,在水有效提取多糖的同时,也把部分橙皮苷提取出来,大约相当醇水最大提取率的1/3。因此,在柱层析法联合提取过程中,首先采用醇水比为4∶6的乙醇溶液为橙皮苷的洗脱液,再以纯水作为多糖的洗脱液,对层析柱中的材料进行连续洗脱,能够高效地把橙皮苷和多糖提取出来。

图3 醇水比例对橙皮苷和多糖提取效率的影响Fig.3 Affect of proportion of ethanol and water on the extraction rate of hesperidin and polysaccharides
材料对不同的溶剂的吸收性能有所不同,从图4可以看出,材料浸泡1h后吸收量均达到最大。乙醇溶液和水的吸涨率分别接近5倍和7倍(mL/g),因此,乙醇溶液和水提取液分别以5倍体积和7倍体积为1份作一个收集单位。

图4 40%乙醇和水的吸涨率Fig.4 Imbibed rate of 40%ethanol and water
经过不同时间的浸泡,溶液中橙皮苷或多糖的含量变化见图5,在2h橙皮苷和多糖的含量均达到最大,增加浸泡时间,含量也不再增大,说明浸泡2h后,目标成分在相应的溶剂中已充分溶解达到平衡。因此,可以确定材料在层析柱中浸泡时间为2h。

图5 浸泡时间的测定Fig.5 Determination of soaking time
2.3 分别和联合循环提取橙皮苷和多糖的效率

图6 分别提取橙皮苷和多糖的提取率Fig.6 Extraction rate of hesperidin and polysaccharides by Independent
分别提取橙皮苷和多糖的提取率见图6,以3份提取液和残渣的含量总和看作是目标成分的总含量,无论是橙皮苷或多糖,第1份和第2份相加的提取率均超过99%,因此在收集洗脱液时,只需要收集第1、2份。
从图7中可看出,联合循环提取时,第一轮第一份橙皮苷和多糖的提取率分别为92.7%和90.2%,从第二轮开始,第一份的提取率均达99%以上。因此,每轮两成分的提取液均只需保留第一份作为分离纯化用,第二份作为下轮的提取液,如此循环,可减少溶剂量,而且得到的是浓度较大的提取液,大大地提高了提取效率。

图7 循环联合提取橙皮苷和多糖的提取率Fig.7 Extraction rate of hesperidin and polysaccharides by combined cycle
2.4 橙皮苷和多糖的分离纯化结果
通过循环提取,合并乙醇溶液和水提取液的第1份,浓缩后,用醇沉淀,一次性把两种成分分离开来,再作后续的纯化,结果见表1。
脐橙皮中橙皮苷和多糖的含量分别是4.85%和1.93%,循环提取率达到99%以上,醇沉分离得到的橙皮苷粗产品中橙皮苷含量为60.27%,多糖粗产品中多糖的含量为15.42%,得率分别是95.45%和97.58%。橙皮苷粗产品为暗灰色粉末,水中放冷结晶为淡黄色悬浮状,用纯水冲洗抽滤,烘干得白色带黄粉末,纯度92.56%,得率94.78%,第2次结晶得淡黄色结晶,纯度97.84%。粗多糖经过两次的水溶和醇沉,最终多糖纯度达到85.32%。

表1 橙皮苷和多糖的含量、纯度、提取率和回收率Table 1 Content,purity,extraction rate and recovery rate of hesperidin or polysaccharid
3 结论与讨论
橙皮苷的常用提取方法有乙醇提取法[15]、“碱提酸析”法[16]和水浸超声辅助法[8]等,醇提法和碱提法都可用超声强化提取过程。有关橙皮苷的结晶工艺的报道较少,各文献报道的最佳提取工艺条件也差别很大。荆瑞勇等[6]提取脐橙皮多糖时,料液比1∶40,提取时间3h,提取温度95℃,显然,提取温度高,时间长,多糖有效成分容易失活,提取液用量大,不利于多糖的分离和纯化。柱层析法原理是利用混合物中各组分物理化学性质上的差异(如分子形状、大小、极性、亲和力和分配系数等),使各组分以不同浓度分布在两相(固定相和流动相)中,并以不同速度移动,最终分离纯化各组分[17]。柱层析循环法的工艺简单,溶剂用量少,并可通过用不同极性的溶剂连续把橙皮苷和多糖提取出来。
本实验的结果表明,通过柱层析联合循环提取时,用5倍体积的40%乙醇和7倍体积的水就能把脐橙皮中99%以上的橙皮苷和多糖提取出来。如果分别用乙醇溶液和水提取橙皮苷和多糖时,两种洗脱液中均包含橙皮苷和多糖,需各自将两种成分分离开来,工艺繁杂,效率低,成本增加。柱层析循环法可避免分别分离纯化两种组分,而是在常温条件下,使用乙醇溶液和水连续对脐橙皮粉末洗脱,每轮两成分的提取液只需保留第1份作为分离纯化用,第2份作为下轮的洗脱液,如此循环,洗脱液合并,醇沉淀多糖,一次性把它们分离开来。因此,循环联合提取既节省大量溶剂,同时也减少后续的浓缩工序,成本低,功能成分损失少,效率高,是一个适合联合提取并分离橙皮苷和多糖的方法。
[1]蔡定建,谢志鹏,罗六保,等.脐橙皮中黄酮类化合物与果胶的分离和提取研究[J].分析测试技术与仪器,2006,12(4):239-242.
[2]刘小华,李舒梅,董明华,等.脐橙功效成分提取与质量检测研究进展[J].食品研究与开发,2011,32(1):138-140.
[3]陆蓓,寿文虹,赵建英.柑橘黄酮中总黄酮及橙皮苷的含量测定[J].中华中医药学刊,2008,26(1):44-45.
[4]Mokbel MS,Hashinaga F.Evaluation of the antioxidant activity of extracts from buntan(Citrus grandis Osbeck) fruit tissues[J].Food Chemistry,2006,94(4):529-534.
[5]侯秀娟,沈勇根,徐明生,等.化橘红多糖的提取纯化及抗氧化活性研究[J].中国酿造,2012,31(9):135-138.
[6]荆瑞勇,王丽艳,张跃文.从脐橙皮中提取可溶性多糖工艺条件研究[J].食品科学,2009,30(8):90-92.
[7]董宏坡,江明树,朱伟杰.化橘红多糖对小鼠的免疫调节作用[J].中成药,2010,32(3):49-493.
[8]朱思明,于淑娟,杨连生,等.陈皮中橙皮苷的超声法提取与结晶[J].食品工业科技,2005,26(6):131-134.
[9]宋茹,韦荣编.微波法萃取柑桔皮多糖的研究[J].粮油食品科技,2008,16(2):24-26.
[10]Ni H,Zhou XH,Li HH,et al.Column chromatographic extraction and preparation of cordycepin from Cordyceps militaris waster medium[J].Journal of Chromatography B,2009,877(22):2135-2141.
[11]Wang L,Gong LH,Chen CJ,et al.Column chromatographic extraction and separation of polyphenols,caffeine and theanine from green tea[J].Food Chemistry,2012,131:1539-1545.
[12]Zhan PY,Zeng XH,Zhang HM,et al.High-efficient column chromatographic extraction of curcumin from Curcuma longa[J].Food Chemistry,2011,129(2):700-703.
[13]DuBois M,Gilles KA,Hamilton JK,et al.Colorimetric method for determination of sugars and related substances[J].Anal Chem,1956,28(3):350-356.
[14]朱玉昌,周大寨,王成.甜橙皮中橙皮苷提取工艺[J].食品科学,2010,31(22):264-267.
[15]谈安群,吴厚玖,王华,等.索氏法与超声波辅助提取甜橙橙皮苷比较研究[J].中成药,2012,12(6):80-87.
[16]朱思明,于淑娟,扶雄.橙皮苷提取方法的研究[J].食品研究与开发,2009,30(7):17-20.
[17]文赤夫,李国章,董爱文,等.橙皮苷的提取及其稳定性分析[J].生物质化学工程,2006,40(3):37-40.
