超声波辅助提取三明产野生苦菜总氨基酸的研究
2013-04-27张晶晶周文富
张晶晶,周文富
(三明学院 化学与生物工程学院,福建 三明 365004)
苦菜是一种药用食用兼具的无毒野生植物,属菊科.别名天香菜、荼苦荚、甘马菜、老鹳菜、无香菜等,药名叫“败酱草”,异名女郎花、鹿肠马草,民间俗称苦菜.作为食物,其味道独特,营养成分高,含有人体需要的多种维生素、矿物质、糖类等[1].《内蒙古中草药》记载,苦菜味苦、辛,具清热解毒、排毒、止痛之功效[2],可用于治疗无名肿痛、乳痈疖肿、阑尾炎、肝炎等各种炎症以及肺热咳嗽、肺结核等[3].苦菜中含有大量的药用化学成分,主要为三萜、甾醇、倍半萜、黄酮、氨基酸等多种类型.近年来,国内外医药界对苦菜进行了广泛而深入的研究[4-7],其药理功能有防治贫血、消暑保健清热解毒,杀菌消炎,提高免疫力,抗肿瘤等作用.据报道[8],苦菜含17种氨基酸,所含的必需、半必需氨基酸总量及每一种必需氨基酸含量均比普通蔬菜高.氨基酸是蛋白质的基本组成单位,是构成动物营养所需蛋白质的基本物质,是治病的主要成分或辅助成分,它能调节生理机能、供给热能、促进生长发育、补充能量代谢消耗[9].因此,食用苦菜有助于促进人体内抗体的合成,增强机体免疫力,促进大脑机能.苦菜在我国的分布广泛,野生资源丰富.对于苦菜药用成分的研究大部分集中在东北、西北、华北[10-12].不同地区、不同生产期的药用植物,其药用成分的含量会有明显的差异[13].本文就福建省三明产的野生苦菜中总氨基酸的含量进行研究,以为这一资源的充分利用提供技术参数.
氨基酸的提取分析方法有如下几种:化学分析法、电化学方法(包括电导检测、安培检测)、分光光度法(包括可见光分光光度法、紫外分光光度法和荧光分光光度法)[14].此外还有茚三酮比色法,该法简便、快捷,茚三酮衍生显色反应的灵敏度可达2×10-10~5×10-10mol/L,且衍生物稳定性好,因此在实验室中被广泛应用于氨基酸的分析检测.本文采用的氨基酸含量测定方法便是茚三酮比色法.氨基酸自动分析仪分析法准确度、自动化程度和灵敏度高,可对氨基酸进行直接分析,其缺点是仪器价格昂贵、分析时间长、使用范围局限,只能用于分析氨基酸[15].高效液相色谱法简便、准确、可靠、灵敏度高、检测限低、检测速度快[16],因此该法的应用最广泛.本实验中提取所得的氨基酸便是通过此法来测定其所含的主要成分.毛细管电泳法利用离子在电场力作用下迁移速度的不同对组分进行分离和分析,具有分离效率高、分析速度快、样品用量少、应用范围广、仪器简单、污染小和成本低等优点[17].该法是近20年来发展较快的分析分离技术之一,由于重现性差,且在实验室中的推广应用的程度不及高效液相色谱法,所以目前还未被广泛应用.
1 实 验
1.1 仪器与试剂
(1)试剂.苦菜(七月中旬)采自福建三明市三元区;L-酪氨酸标准品,中国药品生物制品检定所;无水乙醇、95%乙醇、石油醚、茚三酮、磷酸二氢钾等均为分析纯;蒸馏水;甲醇、乙腈为色谱纯;异硫氰酸苯酯,化学纯;样品稀释液(取355 mg磷酸氢二钠加超纯水至500mL,用10%磷酸乙腈(V(磷酸)∶V(乙腈)=95∶5)调其pH值为7.4);超纯水.
(2)仪器.DHG-9070A型电热恒温鼓风干燥箱,上海基玮实验仪器设备有限公司;FA1604N型电子天平,上海精密科学仪器有限公司;SHB23型循环水式多用真空泵,郑州杜甫仪器厂;120目标准筛,浙江上虞市道墟张兴纱筛厂;FA2204B型电子天平,上海精密科学仪器有限公司;SF-130C万能粉碎机,吉首市中诚制药机械厂;722S型可见分光光度计,上海精密科学仪器有限公司;KQ-300DB超声波清洗器,昆山市超声仪器有限公司;UV-1100型紫外可见分光光度计,北京瑞利仪器有限公司;1200型高效液相色谱仪,美国安捷伦公司.
1.2 实验方法
1.2.1 苦菜氨基酸的提取
准确地称取1.0g苦菜粉末(过120目筛)于100mL锥形瓶中,加入一定质量分数的乙醇溶液,摇匀,用保鲜膜将瓶口密封,在一定的超声波功率下超声提取一定时间后冷却抽滤,超声提取2次,合并两次滤液.将滤液转至梨形分液漏斗中加入石油醚(V(石油醚)∶V(提取液)=1∶20)纯化脱除脂溶性杂质,再转移到100mL容量瓶中定容,摇匀,作为供试品溶液备用.
1.2.2 苦菜氨基酸的测定
标准液的配制:将L-酪氨酸标准品于100℃下干燥至恒重,准确称取酪氨酸0.010 0g,加0.02mol·L-1的 NaOH 溶液10mL,溶解完全后转移到100mL容量瓶中,用蒸馏水定容后摇匀,得0.100mg·mL-1的L-酪氨酸标准溶液,备用.
标准曲线的绘制:用吸量管准确吸取0,1.00,2.00,3.00,4.00,5.00,6.00mL标准液于25 mL容量瓶中制成一系列标准溶液.分别加2%茚三酮溶液1.00mL和pH=6.8的磷酸盐缓冲溶液2.00mL,摇匀,瓶口用保鲜膜封住于水浴锅中加热15min,取出,冷却至室温,定容.利用722S可见分光光度计在最大波长(λmax=566nm)处测定吸光度,以L-酪氨酸质量浓度为横坐标(x)、吸光度为纵坐标(y)绘制标准曲线,见图1.拟合的线性回归方程为:y=0.021 4x-0.000 5,R2=0.999 8.

图1 L-酪氨酸标准曲线Fig.1 The standard curve of L-Tyrosine
1.2.3 样品中氨基酸提取率的测定
从供试品溶液中准确量取5.00mL的苦菜提取液于25mL容量瓶中,按1.2.2中方法显色后,取出,冷却,用乙醇定容.用722S可见分光光度计在λmax=566nm处测定其吸光度,代入回归方程计算总氨基酸含量,根据下式计算出超声波提取液中氨基酸的提取率w.

式中,w为样品中总氨基酸的含量(以L-酪氨酸计),%;ρ为样品中总氨基酸的质量浓度,μg·mL-1;m 为样品的质量,g.
2 结果与分析
2.1 苦菜提取物的组成表征
标准品与样品的预处理:按文献方法对苦菜提取样进行样品的处理,备用.
异硫氰酸苯酯柱前衍生化反应:精确量取苦菜样品溶液1mL,分别置于5mL的离心管中,真空干燥;加入1mL的再干燥液(V(乙醇)∶V(水)∶V(三乙胺)=2∶2∶1),再加入衍生剂溶液2mL(V(异硫氰酸苯酯)∶V(甲醇)∶V(三乙胺)∶V(水)=1∶7∶1∶1),超声处理20min后放置20min,再真空干燥.干燥后的样品加10mL样品稀释液,超声溶解,用0.45μm滤膜过滤,备用(密闭4℃).
色谱条件:色谱柱Eclipse XDB-C18(4.6mm×150mm,5μm);流动相 A 为0.1mol·L-1乙酸钠溶液(冰醋酸调节pH=6.50)-乙腈(V(乙酸钠溶液)∶V(乙腈)=93∶7);流速1.0mL·min-1;检测波长254nm,柱温36℃,进样量10μL.
梯度洗脱:按照表1中流动相A、流动相B体积分数进行对照品和样品溶液的洗脱,总时间为21min.

表1 流动相洗脱梯度Table 1 Mobile phase gradient
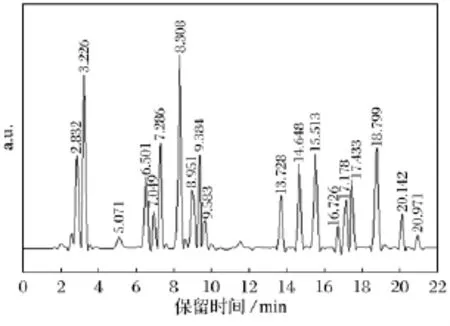
图2 苦菜样品液的高效液相色谱图Fig.2 The HPLC from Sonchus oleraceus
通过高效液相对苦菜中所含氨基酸的组分进行定性分析,图2中的出峰保留时间与文献[18]中氨基酸标准品的出峰时间基本保持一致,根据不同氨基酸的极性各不相同判定所得苦菜提取物中的17种氨基酸,结果如表2所示.
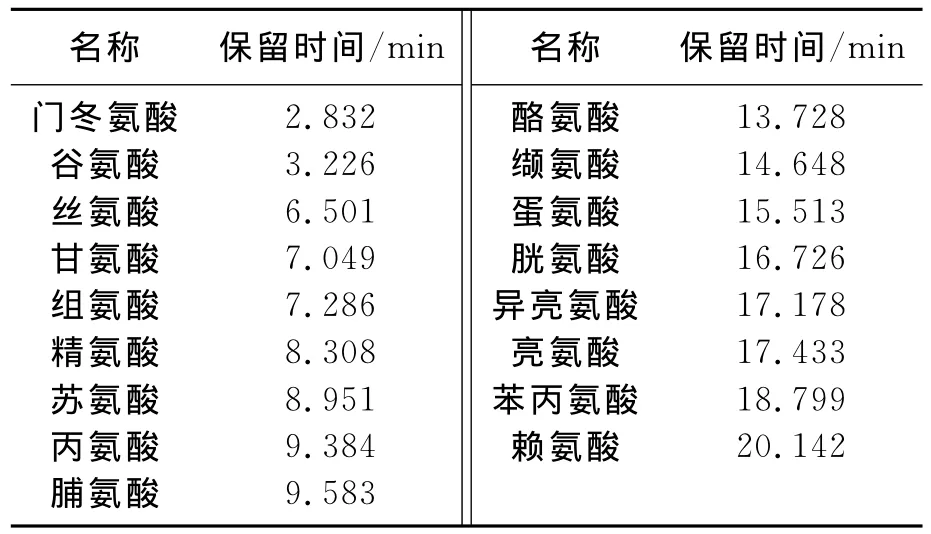
表2 苦菜中氨基酸的组成Table 2 The composition of the amino acids in the Sonchus oleraceus
2.2 单因素实验
2.2.1 超声功率对苦菜氨基酸提取率的影响
固定料液比为1g料40mL乙醇(下同),乙醇质量分数为60%,超声提取2次,每次30min,超声提取温度60℃,考察超声功率对苦菜氨基酸提取率的影响,结果见图3.

图3 超声功率对苦菜氨基酸提取率的影响Fig.3 The effect of ultrasonic power fraction on extraction rate of total amino acids
在实验过程中所使用的超声仪器,其功率可调范围(40~100W)较小.由图3可知,超声功率对苦菜氨基酸的提取率有一定的影响,但并不是功率越大提取率越高,在70W之后提取率呈或高或低波动;超声功率较低时,机械振动不剧烈、对细胞破坏程度小,空化作用不够,不足以令溶质迅速扩散,提取率低;功率过高时,机械振动产生的超声强烈效应可能导致提取液中氨基酸的结构被破坏.另外,苦菜的细胞壁也可能变形、破裂,而使内含物释放,使氨基酸提取率假性提高.综上只要在一定的功率下保证有较高的提取率即可,实验表明,最佳超声功率为60W.
2.2.2 乙醇质量浓度对苦菜氨基酸提取率的影响
固定料液比为1g料40mL乙醇、超声提取2次,每次30min,超声提取温度60℃,超声功率为60W,考察乙醇质量分数对苦菜氨基酸提取率的影响,结果见图4.

图4 乙醇质量分数对苦菜氨基酸提取率的影响Fig.4 The effect of ethanol mass fraction on extraction rate of total amino acids
由图4可见乙醇质量分数在60%时,苦菜中氨基酸的提取率最高.由于苦菜中的氨基酸成分有17种之多[19],根据相似相溶原理,当质量分数小于和大于60%时提取率低,可能是因为质量分数偏低时样品中非极性氨基酸溶出量少,反之,质量分数较高则降低极性氨基酸的溶出.此外,当质量分数过高时,会使脂溶性色素随之溶解,造成假性的吸光度增加,即提取率假性提高.
2.2.3 料液比对苦菜氨基酸及提取率的影响
固定乙醇质量分数为60%,超声提取2次,每次30min,超声功率60W,超声提取温度60℃考察料液比对苦菜氨基酸提取率的影响,结果见图5.

图5 料液比对苦菜氨基酸提取率的影响Fig.5 The effect of solid-liquid ratio fraction on extraction rate of total amino acids
由图5可知,随着乙醇的增加,苦菜氨基酸的提取率明显增加,增至30mL后提取率呈缓和趋势,所以保持一定的料液比是很有必要的.刚开始提取率较低可能是因为溶剂量小时,氨基酸没能完全溶解在溶剂中,随着乙醇体积的增加,提取得越彻底,但综合考虑提取率、经济成本因素以及降低浓缩负担等原因,在实验过程中选择1g料加40mL乙醇为最佳的料液比.
2.2.4 超声提取时间对苦菜氨基酸提取率的影响
固定乙醇质量分数为60%,超声提取2次,料液比为1g料40mL乙醇,超声功率60W,超声提取温度60℃,考察超声提取时间对苦菜氨基酸提取率的影响,结果见图6.
由图6可知,随着提取时间的增长苦菜氨基酸的提取率先增大后减小,当提取时间为30min时达到最大,而后氨基酸的提取量减少;可能的原因是,在加热的条件下,时间越长,乙醇的挥发量越多,乙醇质量浓度下降,同时氨基酸被氧化分解的量也增加,从而造成提取率降低,因此确定30 min为最佳超声提取时间.
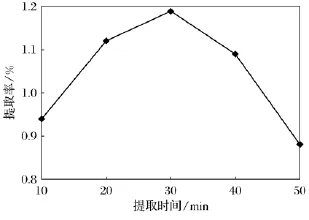
图6 超声提取时间对苦菜氨基酸提取率的影响Fig.6 The effect of extraction time fraction on extraction rate of total amino acids
2.2.5 超声提取温度对苦菜氨基酸提取率的影响
固定乙醇质量分数为60%,超声提取2次,每次30min,1g料40mL乙醇,超声功率60W,考察超声提取温度对苦菜氨基酸提取率的影响,结果见图7.
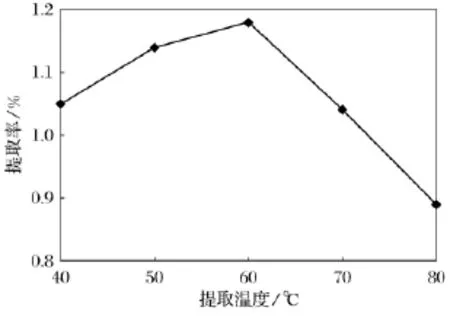
图7 超声提取温度对苦菜氨基酸提取率的影响Fig.7 The effect of extraction temperature fraction on extraction rate of total amino acids
由图7可知,苦菜氨基酸的提取率随提取温度的升高先增大后减少,当提取温度为60℃时达到最大值;温度升高,扩散系数增大,提取剂的渗透能力也相应地增加,使有效成分浸出速率增大;但当温度继续升高时,提取率反而降低,可能是由于氨基酸化合物在较高温度下会发生氧化分解等反应而遭到破坏;此外,过高的温度会加速乙醇的挥发速度,使溶剂乙醇的浓度迅速降低而影响了氨基酸的溶出.
2.3 正交实验[20]
在单因素试验的基础上,对苦菜中氨基酸的提取工艺条件进行优化,选用L9(34)正交试验表安排试验,选择提取时间(A)、乙醇质量浓度(B)、料液比(C)、提取温度(D)4个因素,每个因素选择3个水平,确立因素水平表3,提取结果见表3.

表3 正交实验因素及水平Table 3 Factors and levels of orthogonal experiment
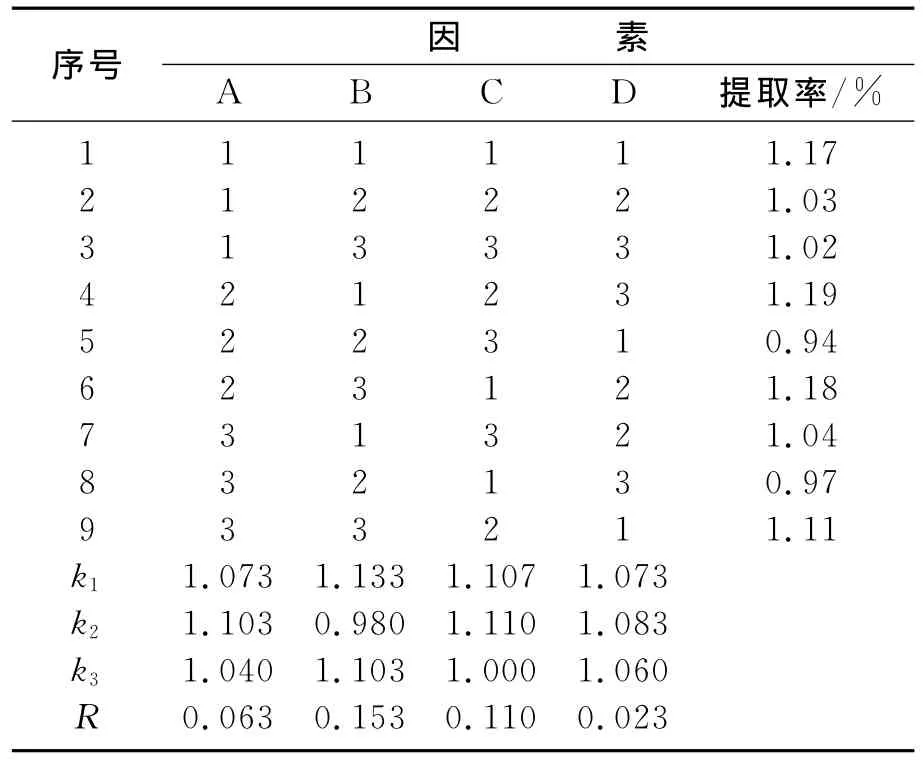
表4 正交实验结果与分析Table 4 Results and analysis of orthogonal experiment
由表4可知,各因素对超声波提取苦菜氨基酸提取率的影响大小依次为:B>C>A>D,即乙醇质量分数>料液比(1g料加的乙醇量)>提取时间>提取温度.确定最佳提取工艺条件为:A2B1C2D2,即超声提取时间为30min,乙醇质量分数为60%,料液比为1g料40mL乙醇,超声提取温度为60℃.
2.4 最佳工艺验证实验
在A2B1C2D2工艺条件下进行验证试验,结果见表5.
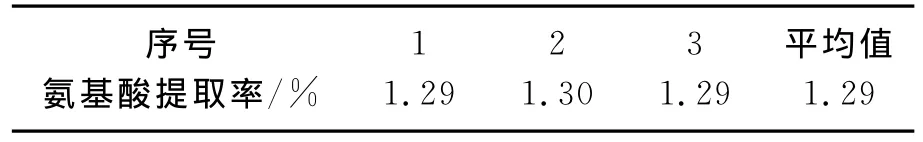
表5 验证试验Table 5 Verification testing
在A2B1C2D2工艺条件下,三明野生苦菜氨基酸得率的平均值为1.29%,相比于正交实验中所设计的4号瓶提高了0.10%,进一步确定了A2B1C2D2为三明野生苦菜中氨基酸超声波提取的最佳工艺条件.
3 结 论
(1)超声波法提取苦菜中氨基酸的最佳提取工艺条件为:乙醇质量分数60%,超声功率60 W,料液比为1g料40mL乙醇,提取时间30 min,提取温度60℃,此时氨基酸的提取率1.29%.
(2)本文对苦菜提取液进行PITC柱前衍生反应,使总氨基酸发生解离,利用高效液相色谱法对苦菜中所含的氨基酸进行定性分析,每一种氨基酸都可正常出峰,17种氨基酸被检出,其中有7种人体必需氨基酸.
(3)异硫氰酸苯酯柱前衍生-高效液相色谱法与相关文献的测定方法相比,该法不需要对胱氨酸另外处理,分析速度快、时间短,灵敏度、精密度、分离度高,检出限低,选择性好,通用性强,经济简便.
(4)正交实验超声波提取苦菜中氨基酸影响因素的重要性依次为:乙醇质量浓度>料液比>提取时间>提取温度.
[1] 田芳.苦菜的功能成分及产品开发[J].中国食物与营养,2009(3):30-31.
(Tian Fang.Functional Components of Sonchus Oleraceus and its Development[J].Food and Nutrition in China,2009(3):30-31.)
[2] 南京中医学院.中药大辞典:上册[M].上海:上海科学技术出版社,2006:1842.
(Nanjing College of Traditional Chinese Medicine.Dictionary of Chinese Medicine:Vol.1[M].Shanghai:Shanghai Science and Technology Press,2006:1842.)
[3] 《全国中草药汇编》编写组.全国中草药汇编[M].2版.北京:人民卫生出版社,1996:532.
(Compiling Group of National Chinese Herbal Compendium.National Chinese Herbal Compendium[M].2nd Edition,Beijing:People's Health Publishing House,1996:532.)
[4] Ye G,Fang J J,Fan M S,et al.Structure Elucidation and Complete NMR Spectral Assignments of a Novel Sesquiterpene Glycoside from Lxerissonchifolia [J].Magnetic Resonance in Chemistry,2007,45(4):362-365.
[5] Zhang Y C,Zhou L,Ng K Y.Sesquiterpene Lactones from Lxerissonch-ifolia Hance and Their Cytotoxicities on A549Human Non-small Cell-lung Cancer Cells[J].Journal of Asian Natural Products Research,2009,11(4):294-296.
[6] 戴锦娜,尹然,陈晓辉,等.苦碟子化学成分和药理作用研究进展[J].西北药学杂志,2006,21(2):94-97.
(Dai Jinna,Yin Ran,Chen Xiaohui.Research Advances in the Effective Component and Pharmacological Activities of Lxeris Sonchifolia(Bge.) Hance[J]. Northwest Pharmaceutical Journal,2006,21(2):94-97.)
[7] Akagi T,Ikegami A,Suzuki Y,et al.Expression Balances of Structural Genes in Shikimate and Flavonoid Biosynthesis Cause a Difference in Proanthocyanidin Accumulation in Persimmon (Diospyros Kaki Thunb.)Fruit[J].Springer-Verlag,2009,230(5):899-915.
[8] 赵赣,赵利,熊瑜.苦菜的食用价值及其利用[J].农牧产品开发,2000,6(02):22-23.
(Zhao Gan,Zhao Li,Xiong Yu.The Food Value and Application of Sonchus Oleraceus Linn[J].Agriculture Products Development,2000,6(2):22-23.)
[9] 郭玲,林连波,刘明生.海南山苦茶中游离氨基酸的分析[J].中国野生植物资源,2001,20(6):66-67.
(Guo Ling,Lin Lianbo,Liu Mingsheng.Analysis of the Nutritional Components of Sonchus Brachyotus DC.and Allium Macrostemon Bunge[J].Chinese Wild Plant Resources,2001,20(6):66-67.)
[10] 朱加进.苦菜中可溶性多糖提取工艺研究[J].农业工程学报,2002,18(1):138-140.
(Zhu Jiajin. Extraction Technology of Soluble Polysaccharides from Wild Patrinia Villosa [J].Transactions of the Chinese Society of Agricultural Engineering,2002,18(1):138-140.)
[11] 刘胜民,谢卫东,孟凡君.苦荬菜属植物化学成分及药理活性研究进展[J].时珍国医国药,2010,21(4):975-976.
(Liu Shengmin,Xie Weidong,Meng Fanun.Research Progress in Chemical Compositions and Pharmacological Activities of Lxeris Cass[J].Lishizhen Medicine and Materia Medica Research,2010,21(4):975-976.)
[12] 江正祥.苦苣菜α-葡萄糖苷酶的抑制活性[J].科技资讯,2010,12(29):220-221.
(Wang Zhengxiang.α-Glucosidase Inhibitory Activity of Sonchus Oleraceus Linn[J].Science and Technology Information,2010,12(29):220-221.)
[13] 杨红霞,魏立新,杜玉枝,等.不同海拔川西獐牙菜中药用成分的 HPLC分析[J].中药材,2010,33(6):867-869.
(Yang Hongxia,Wei Lixin,Du Yuzhi,et al.Research on Chinese Medicine Ingredients of Swertia Mussotii Franch in Different Altitudes by HPLC[J].Journal of Chinese Medicinal Materials,2010,33(6):867-869.)
[14] 王静涛,冯德福,贾云鹏.紫外分光光度法测定麦迪霉素的含量[J].沈阳教育学院学报,2000,2(1):108-109.
(Wang Jingtao,Meng Defu,Jia Yunpeng.Determination of Midecamycin in Tablets by UV [J].Journal of Shenyang College of Education,2000,2(1):108-109.)
[15] 贾薇,陈涛,李进.中药中氨基酸含量测定的研究概况[J].天津药学,2009,21(5):50-52.
(Jia Wei,Chen Tao,Li Jin.Research Survey of Chinese Medicine Determination of Amino Acids[J].Tianjin Pharmacy,2009,21(5):50-52.)
[16] 刘丽敏,王海敏,虞海霞,等.柱前衍生反相高效液相色谱法测定西洋参中游离氨基酸[J].中成药,2009,31(2):275.
(Liu Limin, Wang Haimin, Yu Haixia,et al.Determination of Free Amino Acids in the American Ginseng by Precolumn Derivatization Coupled with RPHPLC[J].Chinese Traditional Patent Medicine,2009,31(2):275-278.)
[17] 刘青青,贾丽.毛细管电泳技术在氨基酸分析中的研究进展[J].分析测试学报,2009,28(1):123-125.
(Liu Qingqing,Jia Li.Recent Advances in the Analysis of Amino Acids by Capillary Electrophoresis[J].Journal of Instrumental Analysis,2009,28(1):123-128.)
[18] 赵志强.高效液相色谱AccQ.Tag法测定野苦苣菜氨基酸成分[J].化学分析计量,2009,18(6):73-74.
(Zhao Zhiqiang.The HPLC AccQ.Tag Analysis of Amino Acids in Sonchus Oleraceus L.[J].Chemical Analysis And Meteraqe,2009,18(6):73-74.)
[19] 王薇,周正礼,李健.高效液相色谱柱前衍生法测定金银花中氨基酸的含量[J].辽宁中医杂志,2010,37(11):2212-2213.
(Wang Wei,Zhou Zhengli,Li Jian.Determination of Amino Acids in Flos Lonicerae by HPLC Coupled with Pre-column Derivatization [J]. Liaoning Journal of Traditional Chinese Medicine,2010,37(11):2212-2213.)
[20] Li Y,Zhang D M, Yu S S,et al. A Novel Phenylpropanoid-substituted Catechin Glycoside and a New Dihydrochalcone from Sarcandra Glabra[J].Chin.Chem.Let.,2006,17(2):207-210.
