CD46在小鼠脑缺血再灌注损伤中的表达和意义
2013-04-24张传福张廷芬晏沐阳宋宏彬
赵 军, 张传福, 张廷芬, 晏沐阳*, 宋宏彬*
CD46在小鼠脑缺血再灌注损伤中的表达和意义
赵 军1, 张传福2, 张廷芬2, 晏沐阳1*, 宋宏彬2*
(1解放军总医院老年心血管病研究所, 北京 100853;2军事医学科学院疾病预防控制所, 北京 100071)
观察补体调节蛋白CD46在小鼠脑缺血-再灌注损伤过程中的表达变化情况,探讨其在脑缺血-再灌注损伤中的可能意义。采用线栓法制备小鼠大脑中动脉闭塞(MCAO)模型,缺血1h后再灌注。记录脑组织病理的动态变化,应用免疫荧光组织化学法及荧光定量PCR法检测脑内补体调节蛋白CD46的表达变化。脑组织病理损伤在再灌注后24h达最重,脑内补体调节蛋白CD46的表达水平逐渐减少,至再灌注后24h达最低,再灌注96h基本恢复正常。补体调节蛋白CD46表达水平与脑组织病理损伤呈负相关。脑缺血-再灌注后补体调节蛋白CD46的表达水平发生显著变化,推测其可能参与脑缺血-再灌注后的免疫损伤过程,通过调节补体调节蛋白CD46的激活可为治疗脑缺血-再灌注损伤提供参考。
脑缺血; 再灌注损伤; 免疫损伤; 补体调节蛋白CD46
缺血性脑血管病有着高发病率、高致残率和高病死率,严重危害人类健康。脑缺血再灌注损伤,即为大脑短时间缺血后,突然恢复血供时会引起一个强烈的炎症反应,导致脑组织继缺血损伤后再次损伤。研究认为,补体系统过度激活的炎症效应是脑内炎症反应的主要始动因素之一[1]。CD46是补体系统中重要的补体调节蛋白,正常情况下,CD46在补体级联反应中抑制补体活化,保护自身组织免受补体攻击。但其在脑缺血-再灌注损伤中的表达和意义并不清楚。我们通过建立小鼠脑缺血再灌注动物模型,应用免疫荧光组织化学法和荧光定量PCR技术,检测脑组织中不同时间点补体调节蛋白CD46的表达变化情况,初步探讨其在脑缺血再灌注免疫损伤中的可能意义。
1 材料与方法
1.1 动物及分组
健康雄性昆明小鼠,体质量(23±3)g,由军事医学科学院实验动物中心提供。48只小鼠随机分为正常组、缺血再灌注6,24,48,72,96h,每组均为8只。
1.2 脑缺血再灌注动物模型建立
参考Longa等[2]的方法并做适当改变,制备小鼠脑缺血再灌注动物模型,用1%的戊巴比妥钠,按照50mg/kg腹腔注射麻醉,麻醉成功后,在小鼠颈部做正中切口,长度约为1cm,逐步分离小鼠右侧颈总动脉、颈外动脉,并结扎,在颈总动脉结扎部位远心端剪口,将直径约为0.125cm的鱼线插入,进线长度约为1~1.5cm,通过右侧颈内动脉到达右侧大脑中动脉起始处。1h后拔出,实现再灌注。
1.3 脑组织损伤病理检查
取出脑组织多聚甲醛固定,蔗糖脱水后行厚6μm冰冻切片。切片丙酮4℃固定30s,后稍水洗,苏木素染液染色3min,1%盐酸酒精分化10s,水洗2s,促蓝液返蓝10s,自来水流水冲洗1min,0.5%伊红染液染色2min,自来水冲洗,80%酒精,95%酒精,无水乙醇梯度脱水,各1min,二甲苯Ⅰ1min,二甲苯Ⅱ1min,中性树胶封片,显微镜观察拍照。
1.4 荧光定量RT-PCR检测CD46mRNA水平
NReasy Mini Kit提取脑组织mRNA,逆转录成cDNA后,用下列引物扩增,CD46:上游5¢-CCCTTCTgTTTCTgCTgTC-3¢,下游5¢-AATATT- TCgCCAgCTCCTgA-3¢;使用GAPDH作为内参基因:上游5¢-TgCCCCCATgTTTgTgATg-3¢,下游5¢-TgTggTCATgAgCCCTTCC -3¢。
1.5 免疫荧光检测脑组织中补体调节蛋白CD46表达
按实验分组的时间点处死小鼠取脑组织,多聚甲醛固定,蔗糖脱水后行冰冻切片,厚6μm。切片置丙酮中4℃固定10min;用0.01mol/L PBS洗3次,每次5min。封闭:10%正常羊血清溶液,37℃封闭1h,甩去封闭液后加一抗CD46(Santa Cruz Bio- technology),1∶100 (PBS稀释),37℃孵育1h,PBS洗3次,每次5min;Cy3标记的二抗,1∶50(PBS稀释,避光),37℃孵育1h,PBS洗3次,每次5min;DAPI染核,抗荧光淬灭封片剂封片,荧光显微镜观察拍照,并用Image-pro plus6.1图像分析软件进行分析。
1.6 统计学处理
计量资料的比较采用单因素方差分析,使用SPSS10.0软件进行统计学分析。<0.05为差异有统计学意义。
2 结 果
2.1 脑组织损伤区各时间点组织形态学观察
HE染色后,光镜下观察神经细胞组织形态学变化,发现正常组脑神经细胞结构完整,细胞核较大,细胞及间质无水肿,伴随再灌注时间推进,损伤区脑神经细胞多数神经细胞核固缩,神经细胞坏死,伴有水肿,至24 h达最重,72h以后损伤区组织形态有所恢复(图1)。
2.2 脑缺血再灌注损伤后脑组织中CD46mRNA的表达变化
与正常组相比,随着缺血再灌注时间的延长CD46mRNA的表达量逐渐减少,24h达最低(<0.01),再灌注48h后CD46mRNA表达量逐渐升高(<0.01;图2)。
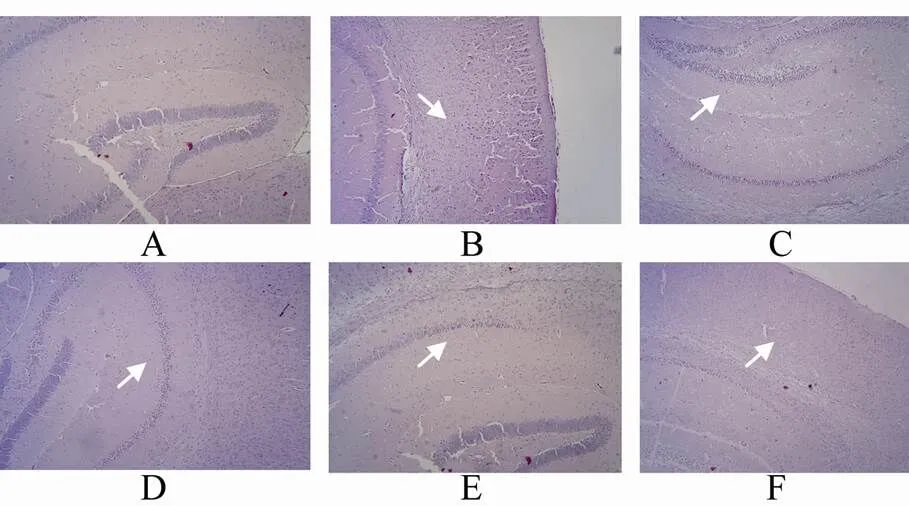
图1 各组脑缺血再灌注损伤区病理观察
Figure 1 Pathological injury of control groups and ischemia-reperfusion groups(HE×40)
A: 正常组; B: 缺血-再灌注6h组; C: 缺血-再灌注24h组; D: 缺血-再灌注48h组; E: 缺血-再灌注72h组; F: 缺血-再灌注96h组
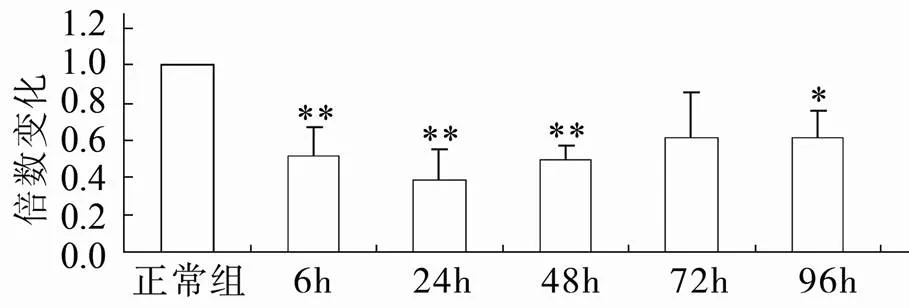
图2 脑缺血再灌注后各组CD46 mRNA的表达变化
Figure 2 CD46 mRNA expression in control groups and ischemia-reperfusion groups
与正常组比较,*<0.05,<0.01
2.3 脑缺血再灌注损伤后损伤区CD46蛋白的表达变化
正常组损伤区及周围可见大量CD46蛋白表达,从缺血再灌注6h开始,在损伤区及周围表达量逐渐减少,24h达最低,再灌注48h后逐渐升高,接近正常(图3)。

图3 各组脑缺血再灌注损伤区CD46免疫荧光表达变化
Figure 3 Expression of CD46 by immunofluorescent staining in control groups and ischemia-reperfusion (CY3 staining×40)
A: 正常组; B: 缺血-再灌注6h组; C: 缺血-再灌注24h组; D: 缺血-再灌注48h组; E: 缺血-再灌注72h组; F: 缺血-再灌注96h组
3 讨 论
尽快恢复病变血管的血流对缺血性脑血管病虽然有一定帮助,但脑缺血再灌注后会引起脑组织急性炎症反应,从而进一步加重脑损伤程度。近年来研究[3-5]证明,在脑缺血性再灌注炎症损伤中补体激活扮演着重要角色,而补体调节蛋白可以使自身细胞免遭补体攻击,其中比较重要的有CD46,又称膜辅助蛋白,其染色体定位于人类1q32,分子量48256kDa,含有4个scr同源短序列,为一跨膜蛋白,分布于除红细胞外的几乎所有细胞。主要功能是作为一种辅助因子,促进I因子介导的C3b、C4b降解,从而抑制C3分子激活的联级反应,被认为是补体旁路激活途径的最有效的抑制因子[6]。有研究证实[7,8],在猫ALI和ARDS模型中CD46表达下调,可能是炎性损伤加重的原因之一,CD46作为补体调节蛋白在调节B细胞激活中也起到重要作用。但是在脑缺血再灌注损伤中CD46的作用尚不是很清楚,我们通过小鼠脑组织缺血区病理观察,来评价小鼠脑组织损伤程度,用免疫荧光组织化学法、荧光定量PCR初步观察了CD46在脑缺血再灌注不同时间点的表达情况,比较补体调节蛋白CD46的表达变化与缺血区脑组织病理变化的相关性,结果发现CD46的表达与脑缺血再灌注损伤严重程度呈负向平行关系。
随着炎症反应的持续发展,补体调节蛋白CD46表达下调,机体自身保护作用减弱或丧失,以致组织细胞遭受激活的补体系统攻击,导致组织损伤,但这种调节机制目前并不是很清楚。此时,CD46等补体调节蛋白表达下调可能是组织损伤的原因之一,这表明MCAO后补体调节蛋白CD46在脑缺血再灌注损伤中有抑制损伤的作用,是脑组织缺血再灌注损伤的保护性因素之一。
下一步可以将CD46作为靶向补体抑制剂进行研究。作为另一个重要的补体调节蛋白CD59,Song等[9]已经在对中国仓鼠卵巢细胞进行的体外补体裂解试验中证明CR2-CD59比没有靶向性的单独CD59分子对保护细胞免受补体激活后的细胞裂解更有效。所以,以后我们也可以尝试构建CR2和CD46的融合分子,证明其在脑缺血再灌注损伤中的作用,为发展新型脑缺血再灌注治疗药物提供帮助。
[1] Morrison H, Frye J, Davis-Gorman G,. The contribution of mannose binding lectin to reperfusion injury after ischemic stroke[J]. Curr Neurovasc Res, 2011, 8(1): 52-63.
[2] Longa EZ, Weinstein PR, Carlson S,. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989, 20(1): 84-91.
[3] Pan J, Konstas AA, Bateman B,. Reperfusion injury following cerebral ischemia: pathophysiology, MR imaging,and potential therapies[J]. Neuroradiology, 2007, 49(2): 93-102.
[4] Komotar RJ, Kim GH, Otten ML,. The role of complement in stroke therapy[J]. Adv Exp Med Biol, 2008, 632: 23-33.
[5] Arumugam TV, Woodruff TM, Lathia JD,. Neuroprotection in stroke by complement inhibition and immunoglobulin therapy[J]. Neuroscience, 2009, 158(3): 1074-1089.
[6] Gorter A, Meri S. Immune evasion of tumor cells using membrane-bound complement regulatory proteins[J]. Immunol Today, 1999, 20(12): 576-582.
[7] 杨 康, 刘维永. 猫创伤性ALI和ARDS中CD59和CD46的表达和意义[J]. 第四军医大学学报, 2000, 21(5): 624-626.
[8] Jabara, HH, Angelini F, Brodeur SR,. Ligation of CD46 to CD40 inhibits CD40 signaling in B cells[J]. Int Immunol, 23(3): 215-221.
[9] Song HB, He C, Knaak C,Complement receptor 2- mediated targeting of complement inhibitors to sites of complement activation[J]. J Clin Invest, 2003, 111(12): 1875-1885.
(编辑: 周宇红)
Expression of CD46 in mouse cerebral ischemia-reperfusion injury and its significance
ZHAO Jun1, ZHANG Chuanfu2, ZHANG Tingfen2, YAN Muyang1*, SONG Hongbin2*
(1Institute of Geriatric Cardiology, Chinese PLA General Hospital, Beijing 100853, China;2Institute of Disease Control and Prevention, Academy of Military Medical Sciences, Beijing 100071, China)
To investigate the dynamic changes of complement regulatory protein CD46 expression and discuss its possible mechanisms cerebral ischemia-reperfusion injury.The middle cerebral artery occlusion (MACO) model was induced through filament method. Brain pathological injury was recorded. Immunofluorescence and real time RT-PCR method were used to detect complement regulatory protein CD46 expression.Brain pathological injury was the most serious at 24h after reperfusion. The complement regulatory protein CD46 expression decreased gradually after local cerebral ischemia-reperfusion injury, to the lowest at 24h after reperfusion, and returned to normal at 96h after reperfusion. complement regulatory protein CD46 expression was negatively correlated with brain pathological injury.The complement regulatory protein CD46 has a significant change after cerebral ischemia-reperfusion. It is speculated that it participates in the injury after ischemia-reperfusion. So regulation of complement regulatory protein CD46 is likely to be a new important method of treatment for ischemia-reperfusion injury.
cerebral ischemia; reperfusion injury; immune injury; complement regulatory protein CD46
( No. 81070969)
R743
A
10.3724/SP.J.1264.2013.00036
2012-09-26;
2012-11-13
国家自然科学基金(No. 81070969)
晏沐阳, Tel: 010-55499138, E-mail: yanmy301@sina.com; 宋宏彬, Tel: 010-66948475, E-mail: hongbinsong@263.net
