血栓弹力图评价抗血小板药物疗效对颅内外动脉支架术后再狭窄的影响
2013-04-24蓝文雅侯华娟刘亚红
李 敏, 刘 玲, 葛 良, 蓝文雅, 侯华娟, 林 颖, 杨 昉, 刘亚红
血栓弹力图评价抗血小板药物疗效对颅内外动脉支架术后再狭窄的影响
李 敏, 刘 玲, 葛 良, 蓝文雅, 侯华娟, 林 颖, 杨 昉, 刘亚红*
(南京军区南京总医院(金陵医院)神经内科, 南京 210002)
分析血栓弹力图仪(TEG)检测颅内外动脉支架置入术(PTAS)后患者服用阿司匹林和氯吡格雷后血小板聚集的抑制率,了解其疗效对PTAS术后支架内再狭窄(ISR)的影响。收集颅内外动脉PTAS术后因缺血性中风复发或者术后6~12个月常规行脑动脉数字减影血管造影(DSA)随访且行TEG检测的49例患者(64处病变血管)的临床资料。根据DSA结果分为ISR组和对照组(无ISR),比较两组间的各种血管病危险因素、血清超敏C反应蛋白(hs-CRP)水平、花生四烯酸(AA)途径和腺苷二磷酸(ADP)受体途径诱导血小板抑制率间的差异,探讨影响ISR形成的因素。(1)卒中复发组与无复发组比较:复发组(男∶女=1∶5)与无复发组(男∶女=39∶4)组间性别组成的差异有统计学意义(<0.01);复发组血清hs-CRP水平显著高于无复发组[(8.9±11.0)(2.9±4.1)mg/L,<0.05];而其余各变量间差异均无统计学意义(>0.05)。(2)ISR组与对照组比较:ISR组患病年龄显著小于对照组[(58.0±12.8)(64.6±9.8)岁;<0.05];两组间糖尿病患者的比例差异具有统计学意义(<0.05);ISR组颅内外支架再狭窄比例(6/148/14)与对照组(7/5043/50)间的差异有统计学意义(<0.05);ISR组血清hs-CRP浓度显著高于对照组[(6.1±7.6)(2.1±2.1)mg/L,=0.028];ISR组AA和ADP平均抑制率分别为(58.0±43.8)%和(28.1±26.1)%,显著低于对照组的(83.4±23.1)%和(52.8±29.5)%(均<0.01)。(3)Logistic回归分析显示,在校正了其他因素的影响后,仅ADP抑制率(氯吡格雷疗效)与ISR的形成呈负相关(HR=0.959;95% CI 0.921~0.998;=0.039)。氯吡格雷抗血小板聚集的疗效与ISR的形成呈负相关,即氯吡咯雷抵抗在ISR的形成中起非常重要的作用。
支架内再狭窄; 血管成形术; 血栓弹力图; 血小板聚集抑制; 氯吡格雷抵抗
颅内外动脉粥样硬化性狭窄是缺血性脑血管疾病的重要原因之一[1],经皮穿刺脑血管内成形及支架置入(percutaneous transluminal angioplasty and stenting,PTAS)是治疗中重度颅外内动脉狭窄的主要方法之一。而PTAS术后支架内再狭窄(in-stent restenosis,ISR)则是困扰介入医师和患者的难题。许多因素可影响ISR的发生,患者对抗血小板药物不敏感或者存在抗血小板药物抵抗则是ISR形成的重要危险因素之一。血栓弹力图仪(Thrombelastogram,TEG)能够动态监测凝血、血小板聚集、纤溶等过程,从而快速、准确评估血小板活性和抗血小板药物效果[2,3]。我们曾采用TEG监测缺血性卒中和PTAS术后患者花生四烯酸(arachidonic acid,AA)途径和腺苷二磷酸(adenosine diphosphate,ADP)受体途径诱导血小板聚集的抑制率,评价常规剂量阿司匹林和氯吡格雷的疗效[4,5]。本研究采用TEG检测颅内外PTAS术后因缺血性卒中复发/术后6~12个月常规行动脉造影随访的患者体内AA途径和ADP受体途径血小板聚集的抑制率,探讨抗血小板药物的疗效对PTAS术后ISR形成的影响。
1 对象与方法
1.1 对象
收集2010年11月至2012年5月在南京军区南京总医院(金陵医院)神经内科行颅内外动脉PTAS术后6~12个月因脑动脉数字减影血管造影(digital subtraction angiography,DSA)复查或者因缺血性卒中复发(脑梗死/短暂性脑缺血发作)住院并行TEG检测的49例患者(共64处病变血管行PTAS)的资料。其中男性40例,女性9例。包括13处颅内动脉(其中9处大脑中动脉,1处颈内动脉颅内段,3处基底动脉)支架和51处颅外动脉(20处椎动脉颅外段,29处颈内动脉颅外段,2处颈总动脉颅外段)病变。
入组标准:(1)根据2010年中国卒中指南的诊断标准,明确诊断为缺血性卒中的住院患者,经DSA证实为颅内外动脉狭窄(症状性狭窄>50%或者无症状性狭窄>70%),PTAS术前4d开始服用氯吡格雷75mg/d,阿司匹林100mg/d,如无并发症至少服用6个月;(2)PTAS术前开始服用瑞舒伐他汀钙10mg/d或者阿托伐他汀钙20mg/d,定期监测肝功能和肌酶,如无副作用持续性服用;(3)PTAS术后6~12个月再次入院DSA复查或者因卒中复发入院后行DSA复查;(4)再次住院期间行TEG检测;(5)其他治疗包括:根据中国缺血性卒中治疗指南,干预各种血管病危险因素和改变生活方式等。
排除标准:(1)非动脉粥样硬化性疾病所致的缺血性卒中;(2)PTAS术后患者不接受DSA复查和(或)TEG检测者;(3)因副作用或者各种原因停抗栓或者他汀药物治疗者;(4)各种原因所致血小板计数少于10×109/L或者大于300×109/L,凝血功能障碍或者具有出血倾向者;(4)严重心肝肾功能不良者。
1.2 研究方法
1.2.1 仪器、试剂、药品 DSA仪(美国GE公司);TEG(GE5000)和TEG检测试剂盒(高岭土,激活剂,AA和ADP)均为Haemoscope公司产品;阿司匹林(拜耳医药保健公司);氯吡格雷(杭州赛诺菲公司);阿托伐他汀钙片(辉瑞制药有限公司);瑞舒伐他汀钙片(阿斯利康制药有限公司)。
1.2.2 全脑血管造影及支架置入术 所有病例均按照标准方法执行全脑血管造影及颅内外支架置入术。血管狭窄评估参考WASID标准[1]。支架置入术前根据狭窄程度和性质决定是否需要预扩张,颅外颈动脉常规使用保护伞,支架置入后造影确定支架位置和残余狭窄,残余狭窄控制在30%以内。
1.2.3 血小板抑制率检测方法 详细操作方法请参照文献[4]。
1.3 评定标准
根据Haemoscope公司产品说明书,阿司匹林和氯吡格雷治疗后血小板AA途径抑制率和ADP受体抑制率≥75%为效果良好,50%~75%为起效。≥50%定义为药物敏感,<50%则定义为药物不敏感[5]。支架内再狭窄标准[6]:经DSA证实的支架内及支架周边管腔直径狭窄≥50%;对支架成形术后残余狭窄为30%~50%的血管病灶,DSA复查时以管腔直径减少>20%视为支架内再狭窄。
1.4 统计学处理
2 结 果
2.1 患者一般特征
入组患者的一般资料见表1。其中卒中复发组6例,无复发组43例。两组间比较,除了性别比例构成(<0.01)和血浆超敏C反应蛋白(high sensitivity C-reactive protein,hs-CRP)水平(<0.05)之间的差异有统计学意义外,其他基线资料差异均无统计学意义。复发组女性多于男性,而无复发组男性多于女性,复发组hs-CRP水平高于无复发组。
2.2 ISR组与无ISR组间各因素的差异
根据对64处行PTAS术治疗血管的DSA复查结果,分为ISR组(14枚支架)和无ISR组(50枚支架,对照组)。两组间各参数比较结果见表2。ISR组平均年龄显著小于对照组(<0.05);颅内外病变血管比例(<0.05)和患糖尿病的比例(<0.05)在两组间的差异均有统计学意义。ISR组AA和ADP抑制率均显著低于对照组(<0.01);此外,ISR组血hs-CRP水平显著高于对照组(<0.05)。
2.3 影响ISR形成的危险因素
采用Stepwise方法(进入和排除的概率分别为0.05和0.1)纳入表2中各因素进行logistic回归分析,结果见表3。仅ADP抑制率(即氯吡格雷疗效)对ISR形成有显著影响(HR=0.959;95%CI 0.921~0.998;=0.039),且呈负相关。糖尿病(=0.068)和血hs-CRP水平(=0.096)虽然能够增加发生ISR风险,但无统计学意义。另外,性别、年龄、高血压、高胆固醇血症、吸烟、饮酒、病变血管分布及AA抑制率对ISR的形成均无影响(>0.05)。

表1 入组患者一般资料及血小板抑制率
注: hs-CRP: 超敏C反应蛋白; AA: 花生四烯酸; ADP: 腺苷二磷酸。与卒中复发组比较,P<0.05,**<0.01
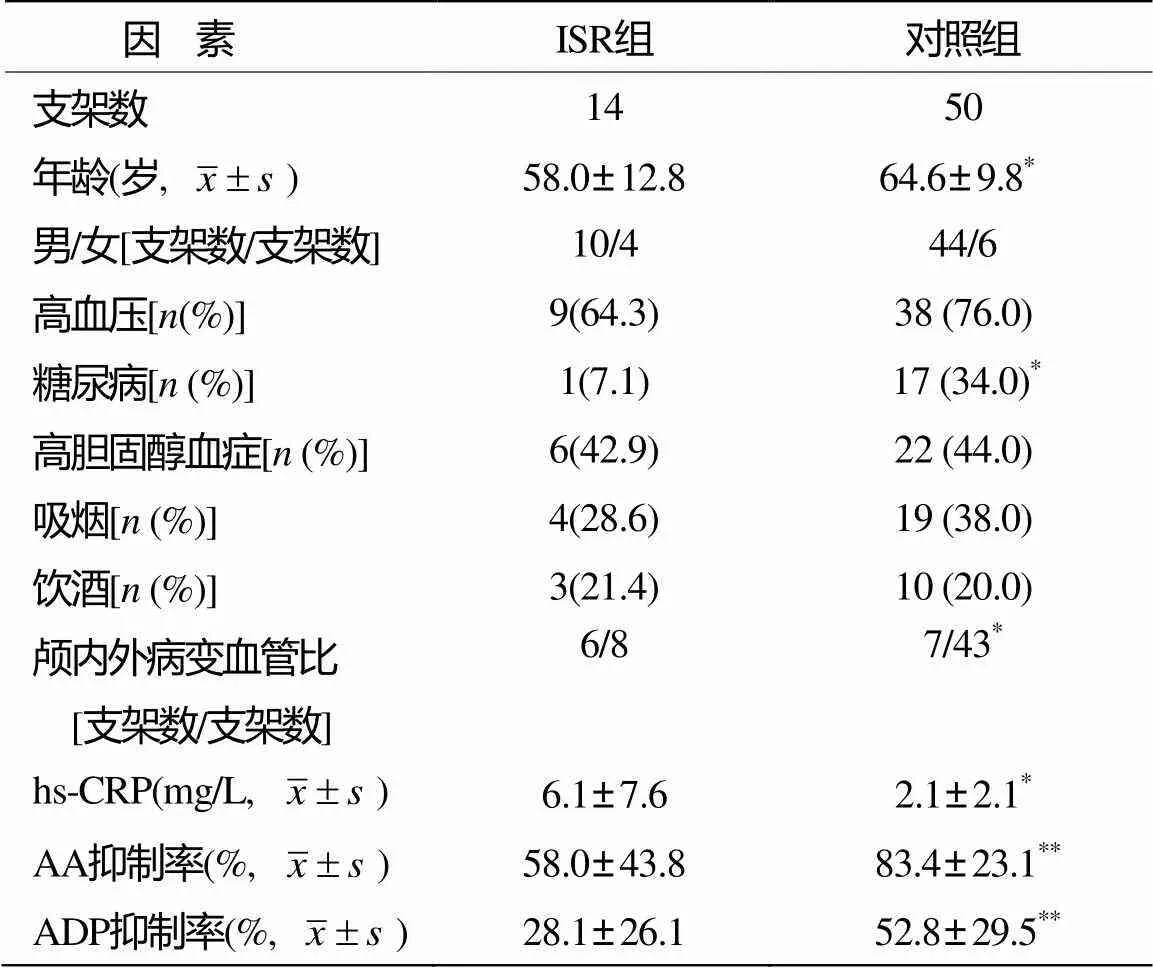
表2 ISR组与对照组间各因素的比较
注: ISR: 支架内再狭窄; hs-CRP: 超敏C反应蛋白; AA: 花生四烯酸; ADP: 腺苷二磷酸。与ISR组比较,*<0.05,P<0.01
3 讨 论
研究报道,颅内外大血管狭窄裸支架置入后6个月内ISR发生率高达35%[7]。为预防支架内急性血栓形成和支架内再狭窄,PTAS术前后通常采用标准治疗方案,包括:术前分别给予300mg负荷剂量的阿司匹林和氯吡格雷,或者从术前4d开始“双抗”抗血小板聚集(100mg/d阿司匹林和75mg/d氯吡格雷)治疗并持续半年以上;同时服用他汀类药物,控制各种危险因素以及调节生活方式等综合治疗,其中强化抗血小板聚集治疗是基石。不同患者对抗血小板药物的反应差别很大,部分患者对常规剂量氯吡格雷或者阿司匹林存在反应低下甚至无反应,或者疗效减退,伴临床急性血栓事件发生,即抗血小板药物抵抗[8]。我们[5]曾报道PTAS术后患者服用常规“双抗”治疗7d时,约14%患者对阿司匹林和氯吡格雷均无反应(抑制率≤20%),约66%患者对阿司匹林和氯吡格雷呈现不同反应。文献报道约11%~44%[9]患者存在氯吡格雷抵抗,8%~45%患者对阿司匹林抵抗[10]。这可能是部分PTSA治疗的患者尽管规律服用标准剂量的“双联”抗血小板药物却依然发生ISR的原因之一。
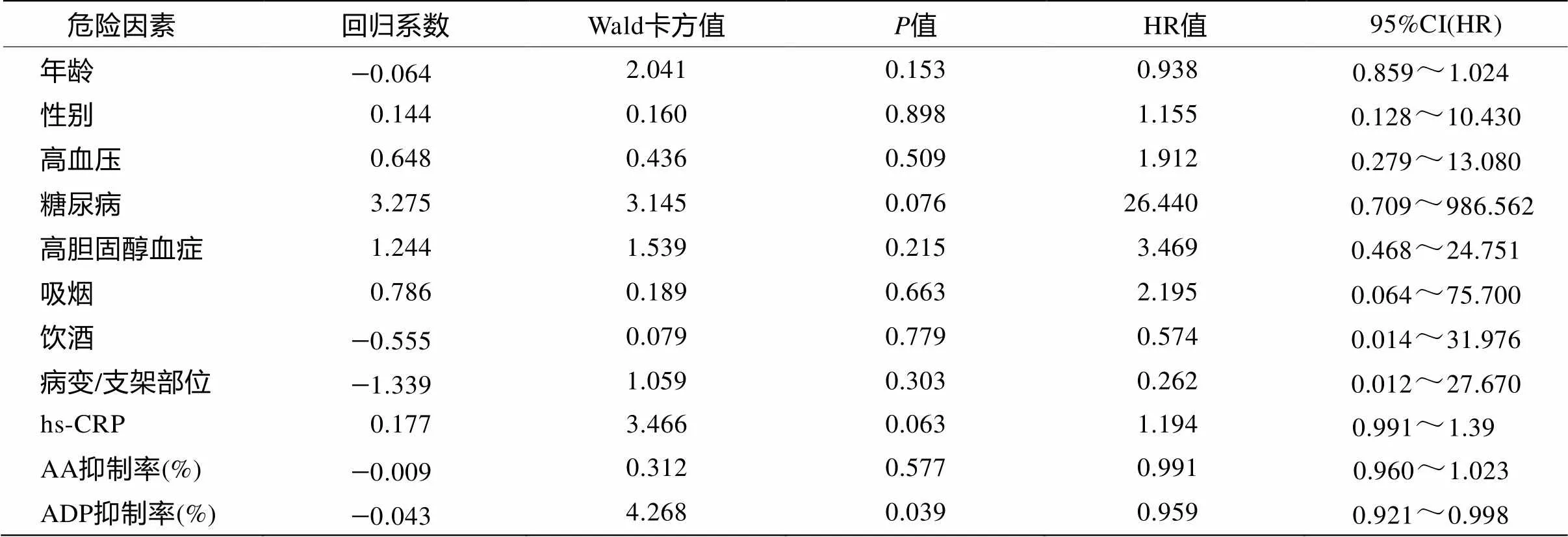
表3 影响PTAS术后ISR的相关因素
注: hs-CRP: 超敏C反应蛋白; AA: 花生四烯酸; ADP: 腺苷二磷酸
3.1 影响PTAS术后缺血性卒中复发的因素
本研究显示,PTAS术后缺血性卒中复发组患者血清hs-CRP水平显著高于对照组(<0.05),与Kuriyama等[11]报道的脑梗死复发患者血清hs-CRP浓度高于无复发者的结论一致。本研究观察到虽然复发组AA抑制率和ADP抑制率均低于对照组,但差异尚无统计学意义,与既往报道并不一致[10]。这可能与本研究样本量偏小,尤其是复发组病例数较少有关。本研究还显示高脂血症、高血压、吸烟、糖尿病等在两组患者之间的分布差异也无统计学意义,可能与接受PTAS治疗的患者这些危险因素得到良好控制有关。
3.2 ISR组与对照组间各因素的差异
术后6~12个月期间由DSA证实14处病变有ISR(总体ISR发生率21.88%),另外50处病变无ISR或者仅轻度内膜增生(狭窄率≤20%),颅内外PTAS后ISR发生率分别为46.2%和15.7%,这与其他报道有差异[7],可能与评估ISR的方法和标准不同有关。本研究显示颅内动脉PTAS后ISR发生率高于颅外,ISR组患者年龄小于对照组,而血清hs-CRP水平高于对照组,这些均与文献报道一致[12]。此外,本研究发现ISR组和对照组AA和ADP抑制率的差异均有显著意义(<0.01),提示ISR组患者对常规剂量的阿司匹林和氯吡格雷治疗反应较差。
3.3 影响ISR的因素
Logistic回归分析发现,校正了其他因素后,仅有ADP抑制率与ISR的发生呈负相关,即患者对氯吡格雷反应差或者氯吡格雷抵抗者发生ISR风险高。有研究报道,冠脉PTAS术前hs-CRP水平升高与冠脉支架术后ISR有关,而PTAS术后3个月时血浆CRP>3mg/L是强烈预示ISR的指标[12,13]。而本研究发现颅内外动脉PTAS术后6~12个月时血清hs-CRP水平升高虽然能够增加发生ISR风险,但尚无显著统计学意义,并且本研究显示糖尿病与ISR形成也无相关,这些均与既往类似报道不一致。可能与不同研究观察的对象不同有关,也可能与本研究样本量相对较少有关。另外,虽然ISR组AA抑制率即阿司匹林疗效显著低于对照组,但logistic回归分析显示AA抑制率或者阿司匹林疗效与ISR形成无相关性(>0.05)。这可能与阿司匹林对ISR组患者体内AA途径血小板聚集的抑制率为58.0%,已经达到有效抑制范围(≥50%)有关。
此外,本研究结果显示,虽然ISR组AA抑制率低于无ISR组,但仍高于无ISR组的ADP抑制率,说明患者普遍对阿司匹林治疗反应高于氯吡格雷,与我们曾观察到多数PTAS术后患者对阿司匹林治疗反应优于氯吡格雷[5],以及Prabhakaran等[14]报道的脑血管支架术后患者阿司匹林抵抗者较氯吡格雷抵抗者少的结果一致。Yamagami等[15]观察并比较颈动脉PTAS前后采用“西洛他唑200mg/d+阿司匹林100mg/d”的方案和常规(阿司匹林100mg/d+氯吡格雷75mg/d)“双抗”血小板聚集方案的远期疗效,发现采用前者ISR发生率低于后者。Lee等[16]发现,与常规“双抗”血小板聚集方案比较,冠脉PTAS术后给予“三联”抗血小板聚集方案(氯吡格雷+西洛他唑+阿司匹林)或者采用普拉格雷+阿司匹林治疗方案,其ISR发生率明显降低。这些研究均表明氯吡格雷抵抗与ISR有相关,调整抗血小板治疗方案或者增加氯吡格雷剂量[9]能够降低ISR风险。
本研究显示,虽然糖尿病、性别、年龄、颅内外血管病变分布、血清hs-CRP水平以及阿司匹林和氯吡格雷疗效在颅内外动脉支架术后ISR组与对照组间的差异显著,但是在校正了其他因素的影响后,仅氯吡格雷疗效与PTAS术后ISR发生呈负相关。本研究结果提示,在积极干预常规危险因素的基础上,加强对PTAS术后患者抗血小板疗效的监测,尽早发现抗血小板药物抵抗尤其是氯吡格雷抵抗者并及时调整抗血小板治疗方案,可能有助于降低颅内外动脉PTAS术后ISR形成风险。由于本研究为小样本回顾性研究,仍需大样本研究来进一步证实。
[1] Chimowitz MI, Lynn MJ, Howlett-Smith H,. Comparison of warfarin and aspirin for symptomatic intracranial arterial stenosis [J]. N Engl J Med, 2005, 352(13): 1305-1316.
[2] Hobson AR, Petley GW, Dawkins KD,. A novel fifteen-minute test for assessment of individual time-dependent clotting responses to aspirin and clopidogrel using modified thrombelastography[J]. Platelets, 2007, 18(7): 497-505.
[3] Hobson AR, Qureshi Z, Banks P,. Gender and responses to aspirin and clopidogrel: insights using short thrombelastography[J]. Cardiovasc Ther, 2009, 27 (4): 246-252.
[4] 刘 玲, 侯华娟, 刘亚红, 等. 用血栓弹力图评价阿司匹林及氯吡格雷在缺血性卒中患者中血小板抑制效应的研究[J]. 中风与神经疾病杂志, 2012, 29(5): 446-449.
[5] 刘 玲, 杨 昉, 侯华娟, 等. 血栓弹力图评价颅内外动脉狭窄支架置入术后患者抗血小板聚集药物疗效的研究[J]. 中国脑血管疾病杂志, 2012, 9(2): 67-71.
[6] Levy EI, Turk AS, Albuquerque FC,. Wingspan in-stent restenosis and thrombosis: Incidence, clinical presentation, and management[J]. Neurosurgery, 2007, 61(3): 644-650.
[7] SSYLVIA Study Investigators. Stenting of Symptomatic Atherosclerotic Lesions in the vertebral or Intracranial Arteries(SSYLVIA): study results[J]. Stoke, 2004, 35(6): 1388-1392.
[8] Topçuoglu MA, Arsava EM, Ay H. Antiplatelet resistance in stroke[J]. Expert Rev Neurother, 2011, 11(2): 251-263.
[9] Lemesle G, Delhaye C, Sudre A,. Impact of highloading and maintenance dose of clopidogrel within the first 15 days after percutaneous coronary intervention on patient outcome[J]. Am Heart J, 2009, 157(2): 375-382.
[10] Feher G, Feher A, Pusch G,. Clinical importance of aspirin and clopidogrel resistance[J]. World J Cardiol, 2010, 2(7): 171-186.
[11] Kuriyama N, Mizuno T, Kita M,. Predictive markers of blood cytokine and chemokine in recurrent brain infarction[J]. J Interferon Cytokine Res, 2009, 29(11): 729-734.
[12] Whiteley W, Jackson C, Lewis S,. Association of circulating inflammatory markers with recurrent vascular events after stroke: a prospective cohort study[J]. Stroke, 2011, 42(1): 10-16.
[13] Li JJ, Ren Y, Chen KJ,. Impact of C-reactive protein on in-stent restenosis: a meta-analysis[J].Tex Heart Inst J, 2010, 37(1): 49-57.
[14] Prabhakaran S, Wells KR, Lee VH,. Prevalence and risk factors for aspirin and clopidogrel resistance in cerebrovascular stenting[J]. AJNR Am J Neuroradiol, 2008, 29 (2): 281-285.
[15] Yamagami H, Sakai N, Matsumaru Y,. Periprocedural cilostazol treatment and restenosis after carotid artery stenting: the Retrospective Study of In-Stent Restenosis after Carotid Artery Stenting (ReSISteR-CAS)[J]. J Stroke Cerebrovasc Dis, 2012, 21(3): 193-199.
[16] Lee SW, Park SW, Kim YH,. Comparison of tripledual antiplatelet therapy after drug-eluting stent implantation (from the DECLARE-Long trial)[J]. Am J Cardiol, 2007, 100(7): 1103-1108.
(编辑: 王雪萍)
Efficacy of antiplatelet aggregation drugs in in-stent restenosis after intra-or extra-cerebral stent placement: evaluation by thrombelastogramy
LI Min, LIU Ling, GE Liang, LAN Wenya, HOU Huajuan, LIN Ying, YANG Fang, LIU Yahong*
(Department of Neurology, Nanjing General (Jinling) Hospital, Nanjing Military Command, Nanjing 210002, China)
To evaluate the efficacy of antiplatelet aggregation drugs (aspirin and clopridogrel) in in-stent restenosis (ISR) after percutaneous transluminal angioplasty and stenting (PTAS) by using thromboelastography (TEG) to assess the inhibitory rates of platelet aggregation.Clinical data of 49 patients who were rehospitalizated in 6 to 12 months after PTAS for conventional re-evaluation by digital subtraction angiography (DSA) and TEG, and 6 patients with recurrent ischemic stroke (infarction or transient) after intra-or extra-cerebral stent placement in Jinling Hospital in November 2010 to May 2012 were collected. All patients were assessed the inhibitory rates of arachidonic acid (AA) pathway and adenosine diphosphate (ADP) receptor pathway in platelets by TEG. DSA confirmed 14 ISR among 64 lesion vessels treated with stents (ISR group). Potential variables for restenosis and the inhibitory rates of AA pathway and ADP receptor pathway in platelets were analyzed for any predictive power for the ISR with SPSS version 15.0.(1) There was significant difference in male-to-female ratio between recurrent stroke group (male/female∶1/5) and non-recurrence group (male/female: 39/4;<0.01). The serum concentrations of high-sensitivity C reactive protein (hs-CRP) in patients with recurrent stroke were higher than those without recurrence [(8.9±11.0)(2.9±4.1) mg/L,<0.05)]. The differences of other variables between recurrent and non-recurrent groups were not significant (>0.05). (2) Compared with non-ISR (control) group, variables in ISR group including age [(58.0±12.8)(64.6±9.8) years], the ratio of diabetes, and the ratio of lesion distributions in intra-and extra-cranial vessels (6/147/14, 7/5043/50) were all significantly different (<0.05). Moreover, the serum concentration of hs-CRP was remarkably higher in ISR group than in non-ISR group [(6.1±7.6)(2.1±2.1) mg/L,=0.028]. Additionally, inhibitory rates of AA pathway and ADP receptor in patients with ISR were (58.0±43.8)% and (28.1±26.1)% whereas those in patients without ISR were (83.4±23.1)% and (52.8±29.5)% respectively, with significant difference (<0.01). (3) Logistic regression analysis showed that the inhibitory rate of ADP receptor or efficacy of clopidogrel (HR=0.959; 95% CI 0.921~0.998;=0.039) was the only independent negative predictor for ISR after adjustment of the influence of other variables.Despite the differences of several variables are significant including age, diabetes, distribution of lesion location, serum concentration of hs-CRP, and efficacy of aspirin and clopidogrel between ISR and non-ISR groups, only the inhibitory rate of ADP receptor in platelets or efficacy of clopidogrel is associated with decreased risk of ISR.
in-stent restenosis; angioplasty and stenting; thromboelastograph; platelets inhibiton; clopidogrel resistance
(No.81070923; No.81100870)(BK2011663).
R743
A
10.3724/SP.J.1264.2013.00032
2012-09-05;
2013-01-05
国家自然科学基金(No.81070923; No.81100870);江苏省自然科学基金(BK2011663)
刘亚红, Tel: 025-80863024, E-mail: lyh860024@yahoo.com.cn
