甲状腺结节与甲状腺癌的鉴别和最新诊疗方案——中国甲状腺结节和分化型甲状腺癌诊治指南解读
2013-04-24龚燕平
龚燕平, 田 慧
甲状腺结节与甲状腺癌的鉴别和最新诊疗方案——中国甲状腺结节和分化型甲状腺癌诊治指南解读
龚燕平*, 田 慧
(解放军总医院南楼临床部内分泌科, 北京 100853)
甲状腺结节是一种临床常见病,近年来我国检出率明显增高,甲状腺癌的发病率也呈现增高的趋势。经B超检查发现的甲状腺结节患病率为20%~76%,其中甲状腺癌的患病率约为5%~15%。鉴别甲状腺结节的良恶性和评估对周围组织的损害是诊断的重点。收集完整病史有助于甲状腺结节发生甲状腺癌的危险评估。高分辨率超声检查是评估甲状腺结节的首选方法。穿刺活检是评估甲状腺结节良恶性准确性(83%)、特异性(92%)最高的检查。手术治疗、术后131I治疗和促甲状腺激素(TSH)抑制治疗是甲状腺癌的治疗方法。甲状腺结节和甲状腺癌应视具体情况安排不同时间间隔的随访。与中青年人群相比老年人群甲状腺结节的患病率增高,甲状腺癌的发生率低,治疗原则相同。
甲状腺结节; 甲状腺肿瘤; 诊断; 治疗; 随访
甲状腺结节是一种临床常见病,近30年来甲状腺结节的检出率明显增高。流行病学研究显示,生活在非缺碘地区的人群中,有5%的女性和1%的男性有可触及的甲状腺结节,高分辨率B超检查获得的甲状腺结节的患病率为20%~76%。甲状腺结节中的甲状腺癌的患病率为5%~15%,我国甲状腺癌的发病率也呈现增高的趋势,同时非必要的甲状腺结节手术率也显著升高[1]。本文参考美国甲状腺协会(American Thyroid Association,ATA;2009)和中国甲状腺结节和分化型甲状腺癌诊治指南(2012),并结合我们的临床工作经验,将甲状腺结节和甲状腺癌的诊疗要点总结如下。
1 甲状腺结节
甲状腺结节是指甲状腺细胞在局部异常生长所引起的散在病变。虽能触及、但在超声检查中未能证实的“结节”,不能诊断为甲状腺结节。体检未能触及、而在影像学检查偶然发现的结节称作“甲状腺意外结节”[2]。良恶性甲状腺结节的临床处理不同,对患者生存质量的影响和涉及的医疗花费也有显著差异。因此,甲状腺结节评估的要点是良恶性鉴别,及可能对周边组织、器官的危害。甲状腺结节的评估方法包括实验室检查、超声检查、其他影像学检查及穿刺活检等。
1.1 评估甲状腺结节的危险因素
发现患者有甲状腺结节后,应收集其完整病史并对甲状腺及邻近的颈部淋巴结做详细检查。下述病史和体格检查结果是甲状腺癌的危险因素[3]:(1)童年期头颈部放射线照射史或放射性尘埃接触史;(2)全身放射治疗史;(3)有分化型甲状腺癌(differentiated thyroid cancer,DTC)、甲状腺髓样癌(medullary thyroid cancer,MTC)或多发性内分泌腺瘤病(multiple endocrine neoplasia,MEN)2型、家族性多发性息肉病、某些甲状腺癌综合征(如Cowden 综合征、Carney综合征、Werner综合征和Gardner综合征等)的既往史或家族史;(4)男性;(5)结节生长迅速;(6)伴持续性声音嘶哑、发音困难,并可排除声带病变(炎症、息肉等);(7)伴吞咽困难或呼吸困难;(8)结节形状不规则、与周围组织粘连固定;(9)伴颈部淋巴结病理性肿大。
1.2 甲状腺结节的实验室检查
所有甲状腺结节患者均应检测血清促甲状腺激素(thyroid stimulating hormone,TSH)水平。研究显示,甲状腺结节患者如伴有TSH水平低于正常,其结节为恶性的比例低于伴有TSH水平正常或升高者[4]。甲状腺球蛋白(thyroglobulin,Tg)由甲状腺滤泡上皮细胞分泌,多种甲状腺疾病均可引起血清Tg水平升高,因此血清Tg不能鉴别甲状腺结节的良恶性。降钙素(Calcitonin,Ct)由甲状腺滤泡旁细胞(C细胞)分泌, 但是血清Ct升高不足100μg/L时,诊断MTC的特异性较低[5],因此应用血清Ct指标筛查MTC的临床意义有限。
1.3 甲状腺结节的超声检查
高分辨率超声检查是评估甲状腺结节的首选方法。所有甲状腺结节患者均应行颈部超声检查。某些超声征象有助于甲状腺结节的良恶性鉴别。下述两种超声改变的甲状腺结节几乎全部为良性[6]:(1)纯囊性结节;(2)由多个小囊泡占据50%以上结节体积、呈海绵状改变的结节,99.7%为良性。而以下超声征象提示甲状腺癌的可能性大[1,7]:(1)实性低回声结节;(2)结节内血供丰富(TSH正常情况下);(3)结节形态和边缘不规则、晕圈缺如;(4)微小钙化、针尖样弥散分布或簇状分布的钙化;(5)同时伴有颈部淋巴结超声影像异常,如淋巴结呈圆形、边界不规则或模糊、内部回声不均、内部出现钙化、皮髓质分界不清、淋巴门消失或囊性变等。通过超声检查鉴别甲状腺结节良恶性的能力与超声医师的临床经验相关(图1)。
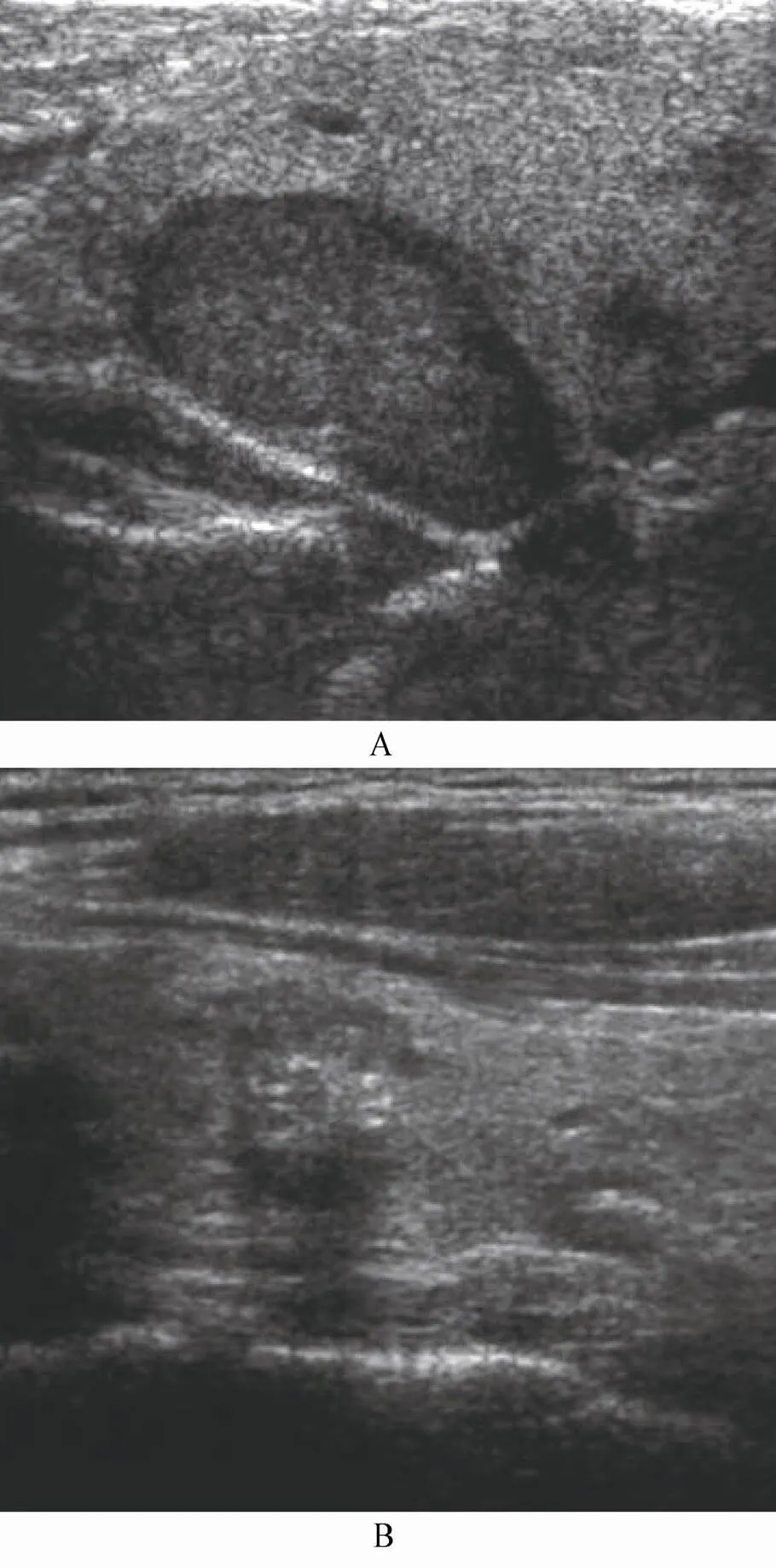
图1 良恶性甲状腺结节的超声图像
Figure 1 Ultrasound image of benign and malignant thyroid nodules
A: 良性甲状腺结节; B: 甲状腺多个结节, 左侧结节内见微小钙化, 纵横比>1, 晕轮不完整, 病理诊断为甲状腺乳头状癌
1.4 其他影像学检查
直径>1cm且伴有血清TSH降低的甲状腺结节,应行甲状腺131I或99Tc核素显像,判断结节是否有自主摄取功能。“热结节”绝大部分为良性,一般不需细针穿刺抽吸活检[8]。不建议将CT、MRI和18F-FDG PET作为评估甲状腺结节的常规检查。拟行手术治疗的甲状腺结节,术前可行颈部CT或MRI检查,显示结节与周围解剖结构的关系,寻找可疑淋巴结,协助制定手术方案。为了不影响术后可能进行的131I显像检查和131I治疗,CT检查中应尽量避免使用含碘造影剂。
1.5 细针穿刺活检(fine needle aspiration biopsy,FNAB)
术前评估甲状腺结节良恶性时,FNAB是敏感度和特异度最高的方法:敏感度为83%(65%~98%),特异度为92%(72%~100%)[1]。术前FNAB检查有助于减少不必要的甲状腺结节手术,并帮助确定恰当的手术方案。凡直径>1cm的甲状腺结节,均可考虑FNAB检查。但在下述情况下,FNAB不作为常规[9]:(1)经甲状腺核素显像证实为有自主摄取功能的“热结节”;(2)超声提示为纯囊性的结节;(3)根据超声影像已高度怀疑为恶性的结节。直径<1cm的甲状腺结节,不推荐常规行FNAB。FNAB活检结果可分为: 恶性、可疑恶性、不确定、良性和取材不满意。经FNAB仍不能确定良恶性的甲状腺结节,可对穿刺标本进行甲状腺癌分子标记物(如BRAF突变、Ras突变、RET/PTC重排等)检测[10]。
1.6 甲状腺结节的随访和治疗
对多数甲状腺良性结节,可每隔6~12个月进行随访。对暂未接受治疗的可疑恶性或恶性结节,随访间隔可缩短。如随访中发现结节明显生长:结节体积增大50%以上,或至少有2条径线增加超过20%(并且超过2mm),是FNAB的适应证[11]。对囊实性结节来说,根据实性部分的生长情况决定是否进行FNAB。要特别注意是否伴有提示结节恶变的症状、体征和超声征象。
多数良性甲状腺结节仅需定期随访,无需特殊治疗。若存在下述情况,可考虑手术治疗甲状腺结节[2]:(1)结节直径>3cm、出现局部压迫症状或明显影响美容者;(2)合并甲状腺功能亢进,内科治疗无效者;(3)肿物位于胸骨后或纵隔内;(4)结节进行性生长,临床考虑有恶变倾向或合并甲状腺癌高危因素;(5)因外观或思想顾虑过重影响正常生活而强烈要求手术者。不建议用TSH抑制治疗来预防结节再发。
不建议常规使用非手术方法治疗良性甲状腺结节,包括TSH抑制治疗、131I治疗、超声引导下经皮无水酒精注射(percutaneous ethanol injection,PEI)、经皮激光消融术(percutaneous laser ablation,PLA)和射频消融(radiofrequency ablation,RFA)。131I主要用于治疗具有自主摄取功能并伴有甲亢的良性甲状腺结节。
2 甲状腺癌
超过90%的甲状腺癌为DTC。DTC起源于甲状腺滤泡上皮细胞,主要包括乳头状甲状腺癌(papillary thyroid carcinoma,PTC)和甲状腺滤泡状癌(follicular thyroid carcinoma,FTC),少数为Hǔrthle细胞或嗜酸性细胞肿瘤。低分化型甲状腺癌也属于DTC范畴。DTC的治疗方法主要包括:手术治疗、术后131I治疗和TSH抑制治疗。其中,手术治疗最为重要,直接影响本病的后续治疗和随访,并与预后密切相关[13]。
2.1 甲状腺癌的手术治疗
2.1.1 手术术式的选择 DTC的甲状腺切除术式主要包括全/次全甲状腺切除术和甲状腺腺叶+峡部切除术。建议DTC的全/次全甲状腺切除术适应证包括[1,2,14]:(1)童年期有头颈部放射线照射史或放射性尘埃接触史;(2)原发灶最大直径>4cm;(3)多癌灶,尤其是双侧癌灶;(4)不良的病理亚型、FTC的广泛浸润型、低分化型甲状腺癌;(5)已有远处转移,需行术后131I治疗;(6)伴有双侧颈部淋巴结转移;(7)伴有腺外侵犯。相对适应证是:肿瘤最大直径介于1~4cm之间,伴有甲状腺癌高危因素或合并对侧甲状腺结节。
建议甲状腺腺叶+峡部切除术的适应证为[1,2]:局限于一侧腺叶内的单发DTC,并且肿瘤原发灶≤1cm、对侧腺叶内无结节、复发危险度低、无高危因素(T1a)。相对适应证为:局限于一侧腺叶内的单发DTC≤4cm、微小浸润型FTC。
2.1.2 淋巴结的清扫 20%~90%的DTC患者在确诊时即存在颈部淋巴结转移,多发生于颈部中央区。而28%~33%的颈部淋巴结转移在术前影像学和术中检查时未被发现。因此DTC术中在有效保留甲状旁腺和喉返神经情况下,应行病灶同侧中央区淋巴结清扫术(N1a,择区性颈部淋巴结清扫术)。对N1b的DTC患者,行侧颈区淋巴结清扫术[1,13,14]。
2.2 甲状腺癌的TNM分期和危险度分层
目前最常使用的肿瘤术后分期系统是美国癌症联合委员会(American Joint Committee on Cancer,AJCC)的TNM分期,这是基于病理学参数和年龄的分期系统,适用于包括DTC在内的所有类型。TNM分期虽可预测患者的死亡危险,但不能预测肿瘤的复发危险。要评估患者预后并确定治疗方案,就要按复发危险度分层:(1)低危患者:在初次手术治疗并清除残留病灶后没有局部或远处转移灶,所有肉眼可见的肿瘤均已被切除,肿瘤未侵入局部组织,没有高侵犯性的病理表现或侵袭血管,甲状腺外无131I摄取。(2)中危患者:在初次手术时,肉眼可见肿瘤侵入甲状腺旁软组织,或肿瘤有侵犯性的病理表现或侵入血管,甲状腺外淋巴结有异常131I摄取。(3)高危患者:在初次手术时,肉眼可见肿瘤侵入周边组织,肿瘤切除不完整、有远处转移,全切后Tg水平仍高,有甲状腺癌家族史。危险性分层是2010年美国指南最新提出的概念,并被我国指南采用[1,2]。DTC的术后分期和复发危险度分层有助于预测患者的预后、指导个体化的术后治疗方案和随访方案。
2.3 术后131I治疗
131I是DTC术后治疗的重要手段之一。131I治疗包含两个层次:一是采用131I清除DTC术后残留的甲状腺组织,简称131I清甲;二是采用131I清除手术不能切除的DTC转移灶,简称131I清灶。
目前对术后131I清甲治疗的适应证尚存争议,主要问题集中于低危患者是否从中获益。总体来说,除所有癌灶均<1cm且无腺外浸润、无淋巴结和远处转移的DTC外(T1a),均可考虑131I清甲治疗。此外,131I清甲治疗前评估发现有再次手术指证者,应先行手术治疗。清甲治疗前需要停用左甲状腺素(L-T4)至少2~3周或使用重组人TSH(rhTSH),使血清TSH>30mU/L。同时,131I清甲治疗前应低碘饮食(<50μg/d)至少1~2周,避免应用含碘造影剂和药物。清甲治疗的剂量为低危患者1.11~3.7GBq(30~100mCi);中、高危DTC患者3.7~7.4GBq(100~200mCi)。如TSH刺激后的Dx-WBS图像中无甲状腺组织显影,甲状腺131I摄取率<1%,动态监测血清Tg持续<1μg/L,并且颈部超声无明显异常,提示清甲完全[14,15]。
对无法手术切除的摄碘性DTC转移灶,可选择性应用131I清灶治疗。首次131I清灶治疗应在131I清甲后至少3个月后进行。单次131I清灶治疗的经验剂量为3.7~7.4GBq(100~200mCi)。重复清灶治疗宜间隔4~8个月。
2.4 L-T4抑制治疗
TSH抑制水平与DTC的复发、转移和癌症相关死亡的关系密切,特别对高危DTC者,这种关联性更加明确,TSH>2mU/L时癌症相关死亡和复发增加。抑制治疗还应考虑患者的可耐受度、心血管和骨骼系统等情况。2012中国指南根据TSH抑制治疗的副作用风险进行了分层:中青年、无血管疾病、无骨质疏松风险的为低危人群;老年人、绝经后女性、心血管病患者、有其他严重疾病的患者为高危人群。对术后DTC患者应进行复发危险度和TSH抑制治疗副作用风险的双风险评估[1,2],根据评估结果确定抑制治疗目标值(表1)。老年患者达到TSH抑制的L-T4剂量较年轻人低20%~30%。
2.5 甲状腺癌的随访
尽管大多数DTC患者预后良好,但是约30%的DTC患者会出现复发或转移,其中2/3发生于手术后的10年内,所以对DTC患者应当进行长期随访。对血清Tg的长期随访宜从131I清甲治疗后6个月起始。对已清除全部甲状腺的DTC患者,提示其无病生存的Tg切点值:基础Tg(TSH抑制状态下)1μg/L;TSH刺激后Tg 2μg/L。未完全切除甲状腺的DTC患者,若Tg有持续升高趋势者,应考虑甲状腺组织或肿瘤生长,需结合颈部超声等其他检查进一步评估[16]。
3 展 望
目前对于少数肿瘤快速生长、广泛转移患者进行了一系列试验性治疗研究。随着对甲状腺癌分子及细胞学发病机制的认识不断深入,多种靶向治疗方法已进入临床评估阶段,这些疗法包括:抑制癌基因、生长或凋亡调控、抑制血管新生、免疫调节和基因治疗等。希望通过本文能对甲状腺结节和甲状腺癌的规范诊疗及其进一步发展做出一定的贡献。

表1 基于双风险评估的DTC患者术后TSH抑制治疗目标
[1] 中华医学会内分泌学分会, 中华医学会外科分会内分泌学组, 中国抗癌协会头颈肿瘤专业委员会, 中华医学会核医学分会. 甲状腺结节和分化型甲状腺癌诊治指南[J]. 中华内分泌代谢杂志, 2012, 28(10): 779-797.
[2] American Thyroid Association (ATA) Guidelines Task force on Thyroid Nodules and Differentiated Thyroid Cancer, Cooper DS, Doherty GM,. Revised management guidelines for patients with thyroid nodules and differentiated thyroid cancer[J]. Thyroid, 2009, 19(11): 1167-1214.
[3] Hegedüs L. Clinical practice. The thyroid nodule[J]. N Engl J Med, 2004, 351(17): 1764-1771.
[4] McLeod DS, Watters KF, Carpenter AD,. Thyrotropin and thyroid cancer diagnosis: a systematic review and dose-response meta-analysis[J]. J Clin Endocrinol Metab, 2012, 97(8): 2682-2692.
[5] Costante G, Meringolo D, Durante C,. Predictive value of serum calcitonin levels for preoperative diagnosis of medullary thyroid carcinoma in a cohort of 5817 consecutive patients with thyroid nodules[J]. J Clin Endocrinol Metab, 2007, 92(2): 450-455.
[6] Moon WJ, Kwag HJ, Na DG. Are there any specific ultrasound findings of nodular hyperplasia (‘leave me alone’lesion) to differentiate it from follicular adenoma [J]. Acta Radiologica, 2009, 50(4): 383-388.
[7] Moon WJ, Jung SL, Lee JH,. Benign and malignant thyroid nodules: US differentiation-multicenter retrospective study[J]. Radiology, 2008, 247(3): 762-770.
[8] Pacini F, Castagna MG, Brilli L,. Thyroid cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up[J]. Ann Oncol, 2010, 21(Suppl 5): v214-219.
[9] Boelaert K, Horacek J, Holder RL,. Serum thyrotropin concentration as a novel predictor of malignancy in thyroid nodules investigated by fine-needle aspiration[J]. J Clin Endo Metab, 2006, 91(11): 4295-4301.
[10] Rossi M, Buratto M, Bruni S,. Role of ultrasonographic/clinical profile, cytology, and BRAF V600E mutation evaluation in thyroid nodule screening for malignancy: a prospective study[J]. J Clin Endocrinol Metab, 2012, 97(7): 2354-2361.
[11] Oertel YC, Miyahara-Felipe L, Mendoza MG,. Value of repeated fine needle aspirations of the thyroid: ananalysis of over ten thousand FNAs[J]. Thyroid, 2007, 17(11): 1061-1066.
[12] Ross DS. Radioiodine therapy for hyperthyroidism[J]. N Engl J Med, 2011, 364(6): 542-550.
[13] Bilimoria KY, Bentrem DJ, Ko CY,. Extent of surgery affects survival for papillary thyroid cancer[J]. Ann Surg, 2007, 246(3): 375-381.
[14] 连小兰. 美国《甲状腺结节和分化型甲状腺癌诊治指南(2006)》解读[J]. 中国实用外科杂志, 2007, 27(12): 933-936.
[15] 施秉银. 甲状腺结节和肿瘤的诊断、治疗与展望[J].中华内分泌代谢杂志, 2003, 19(2): 83-85.
[16] Tuttle RM, Leboeuf R. Follow up approaches in thyroid cancer: a risk adapted paradigm[J]. Endocrinol Metab Clin North Am, 2008, 37(2): 419-435.
(编辑: 胡晓晖)
New protocol for the diagnosis and management of thyroid nodule and carcinoma——the Chinese management guidelines for patients with thyroid nodules and differentiated thyroid cancer
GONG Yanping*, TIAN Hui
(Department of Geriatric Endocrinology, Chinese PLA General Hospital, Beijing 100853, China)
Thyroid nodule is a common clinical disease. In recent years, the detection rate of thyroid nodule, as well as the incidence of thyroid cancer, presents higher and higher in China. Thyroid nodule is confirmed with a prevalence of ultrasonic inspection of 20% to 76%, while, the incidence of thyroid cancer detected from thyroid nodule reaches 5% to15%. Therefore, identifying benign or malignancy of the nodule, and the damage of surrounding tissue is of particularly importance. Risk factors of thyroid cancer developing from thyroid nodules could be evaluated by collecting complete medical history. This might do great help to arrange reasonable diagnosis and treatment. High resolution ultrasound evaluation is the preferred approach for thyroid nodule. Biopsy has the highest accuracy (83%) and specificity (92%) in assessing benign or malignancy of thyroid nodule. Other laboratory and imaging examination can play a supplementary role. Surgery, postoperative131I therapy and thyroid stimulating hormone suppression therapy are most common treatments for thyroid cancer. Follow-up schedule of thyroid nodules and thyroid carcinoma should be arranged according to each specific situation. Though the prevalence of thyroid nodule is higher in the elderly than in young subjects, the incidence of thyroid carcinoma in the elderly is relatively lower. The therapeutic management for the elderly is the same as that for the young.
thyroid nodule; thyroid carcinoma; diagnosis; therapy; follow-up
R581
A
10.3724/SP.J.1264.2013.00028
2013-01-05;
2013-01-19
龚燕平, Tel: 010-66876325, E-mail: gypmrp@yahoo.com.cn
