氧化还原沉淀法制备氧化锰分子筛的热力学分析
2013-04-21杜治平杨小俊吴元欣
杜治平,邓 尉, 杨小俊, 吴元欣
(武汉工程大学化工与制药学院,绿色化工过程省部共建教育部重点实验室,湖北省新型反应器与绿色化学工艺重点实验室,湖北 武汉430074)
0 引 言
近50年来,分子筛材料因其在催化领域和分离提纯中的出色表现受到人们的广泛关注.尤其是氧化锰分子筛,它是继20世纪大规模开发利用沸石型四面体分子筛后发现的又一具有良好应用前景的新材料[1].氧化锰分子筛一般通过氧化还原反应合成,通过高锰酸钾与硫酸锰[2]、葡萄糖[3]、醇[4]和反丁烯二酸或顺丁烯二酸[5-6]在适宜的条件下制备出氧化锰分子筛.上述制备方法普遍用于实验室小批量制备氧化锰分子筛材料.在此基础上,如何与实际工业生产相结合,大批量、连续性制备氧化锰分子筛材料成为新的研究热点之一.King’ondu[7]和Opembe[8]利用紫外光和微波工艺连续化制备出氧化锰分子筛,其制备原理为利用外部能量强化反应过程.在上述两种方法中,如工艺控制不当,容易产生杂质Mn2O3,而Mn2O3为氧化锰分子筛在高温下热解产生.课题组尝试利用超重力反应强化技术,快速批量制备氧化锰分子筛,为了获得单一晶相的氧化锰分子筛产品,有必要对外部能量存在时的反应热效应进行分析,为合成过程中的工艺优化提供指导.超重力反应器提供的是一种特殊形式的超重力场,而最直接的外部能量是来源于外部供给的热量,因此,从温度的角度阐述外部能量更直接.本研究将以温度相关的外部供热作为外部能量进行讨论.而且,关于氧化锰分子筛的热力学研究尚未见相关报道.热力学分析除了分析反应是否可行外,还从反应热的角度分析反应过程的热效应和外部供给能量(外部供热)的关系,这种关系是通过热力学计算的方式获得理论结果,理论结果分析说明温度控制对反应过程的影响,尤其是杂质形成的影响,避免高温下形成Mn2O3杂相,这是制备出单一晶相的氧化锰分子筛的关键.考虑到温度控制是防止生成Mn2O3杂相的主要手段,同时温度也影响反应速率的快慢,因此,本研究通过热力学计算得出在不同温度下高锰酸钾与不同还原剂反应的摩尔反应焓、摩尔吉布斯自由能和平衡常数,为超重力过程强化技术快速批量制备出单一晶相的氧化锰分子筛的工艺控制提供基础热力学数据.
1 高锰酸钾与不同还原剂反应的化学方程式
高锰酸钾作为氧化剂与还原剂——硫酸锰、葡萄糖、蔗糖、顺丁烯二酸或者反丁烯二酸的反应方程式如下:
Ⅰ.高锰酸钾与硫酸锰的反应
2KMnO4+3MnSO4+2H2O=5MnO2+2H2SO4+K2SO4
Ⅱ.高锰酸钾和葡萄糖的反应

Ⅲ.高锰酸钾和蔗糖的反应

Ⅳ.高锰酸钾和顺丁烯二酸(C4H4O4-M)或者反丁烯二酸(C4H4O4-F)的反应

2 热力学参数计算
2.1 热力学参数及计算公式
查阅相关热力学手册[9-10]获得上述反应中各物质的热力学数据,列于表1.
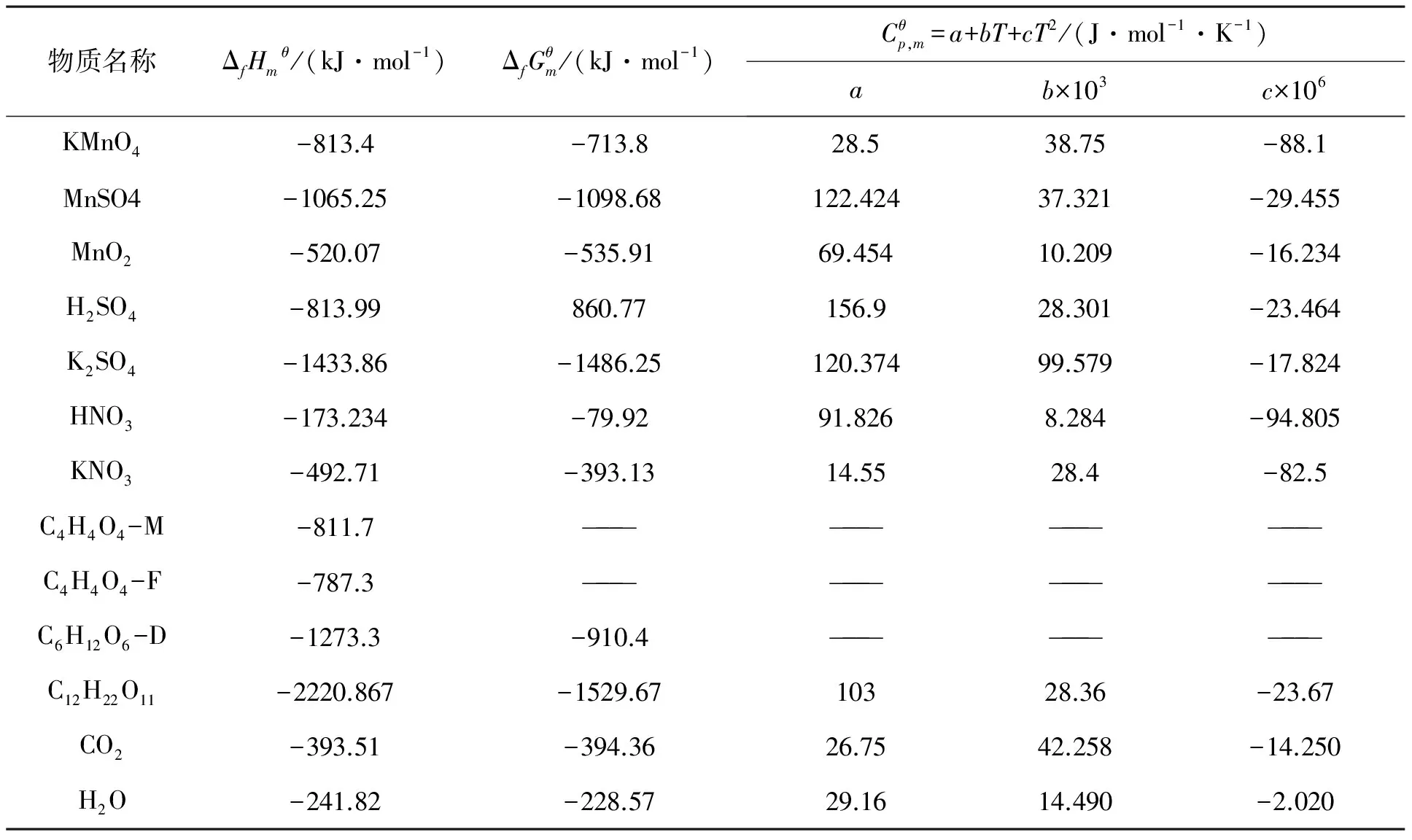
表1 各物质的热力学数据Table 1 Thermodynamic data of substances (T=298 K)
注:C4H4O4-M表示顺丁烯二酸,C4H4O4-F表示反丁烯二酸,两者的标准摩尔吉布斯自由能以及热容常数数据未见相关手册报道.C6H12O6-D表示D-葡萄糖,其常温下的热容为1 256 J·mol-1·K-1.由于葡萄糖在高温下易分解,因此它的摩尔恒压热容的经验常数不存在,其中, ΔfHmθ—标准摩尔生成焓,单位kJ·mol-1;ΔfGmθ—标准摩尔生成吉布斯自由能,单位kJ·mol-1;Cp,mθ—标准摩尔恒压热容,单位J·mol-1· K-1;T—温度,单位K;a、b、c—某物质的摩尔恒压热容的经验常数,单位分别为J·mol-1·K-1、J·mol-1·K-2、J·mol-1·K-3.
由于顺丁烯二酸、反丁烯二酸的部分热力学数据未见文献报道,因此先选择Benson基团贡献法和ABWY法两种方法来进行相关性质的估算,将这两种方法的估算值与文献测量值进行比较,选择精度较高的作为顺丁烯二酸和反丁烯二酸的热力学数据的估算方法.
Benson基团贡献法因其考虑了临近基团的相互作用,具有较高的精度而被广泛采用[11];ABWY法基本设想是由一个母体分子经过逐步取代而成,对320种有机化合物在300 K考察时误差为1.5%[12].采用基团贡献法时各基团的贡献值如表2所示;采用ABWY法时各基团的贡献值如表3所示;由基团贡献法和ABWY法估算出的顺丁烯二酸和反丁烯二酸的热力学数据,结果见表4.
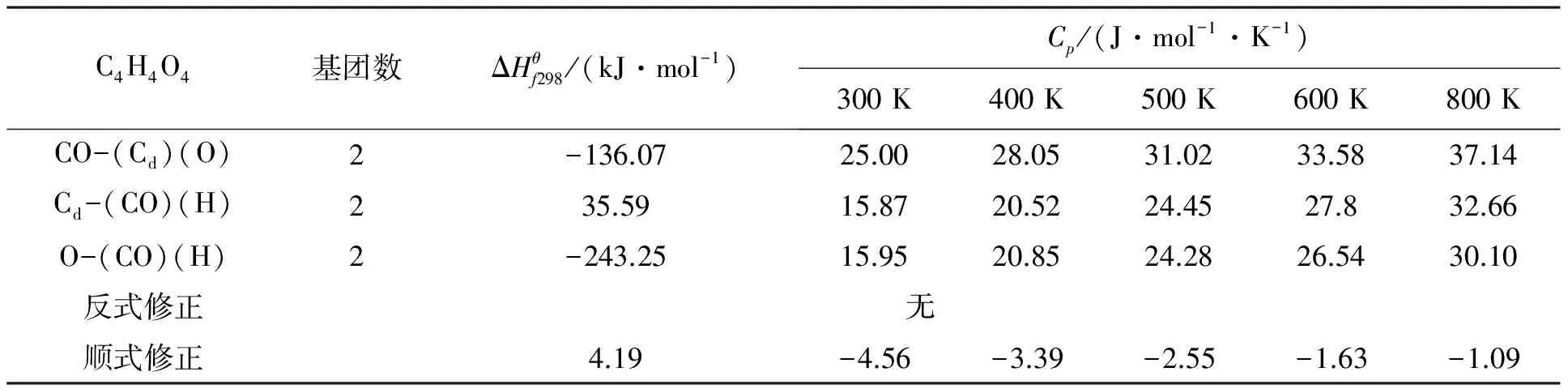
表2 298 K时Benson法基团贡献值
Benson法计算公式如下:
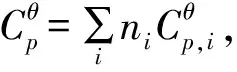
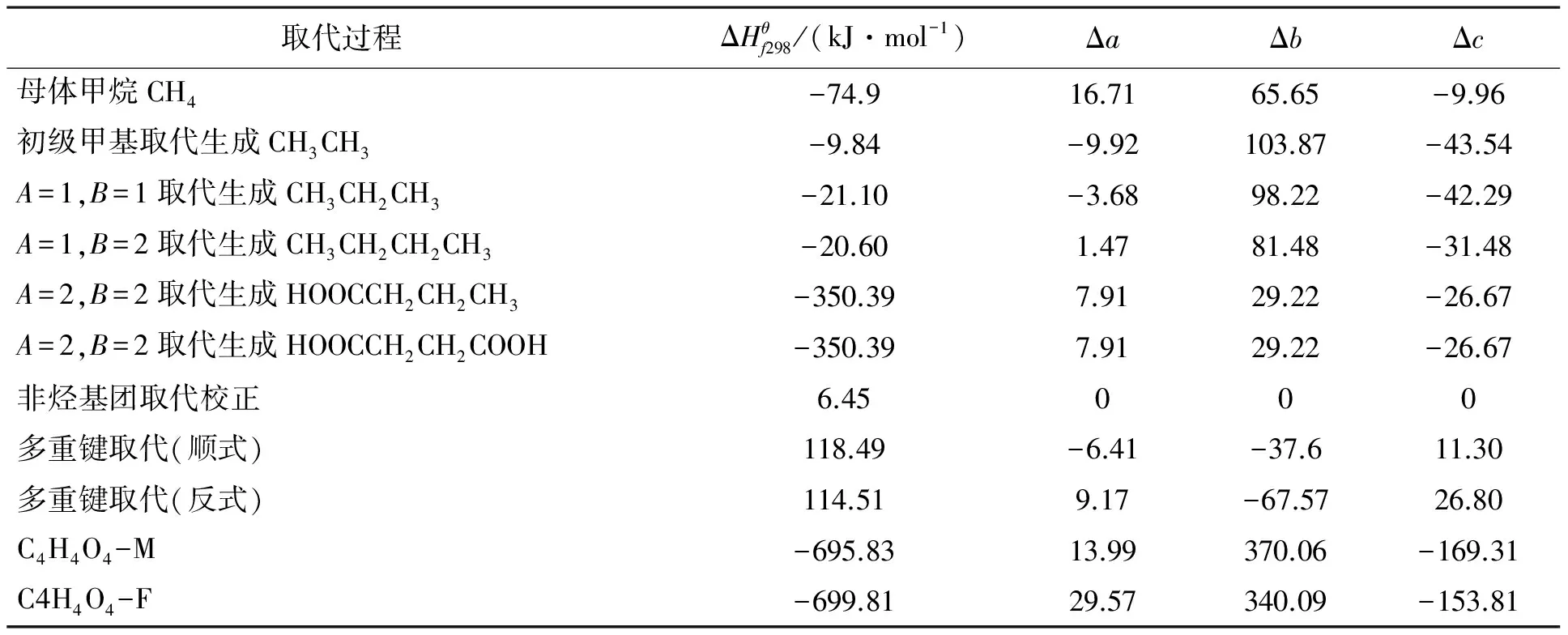
表3 298 K时ABWY基团参数
ABWY法计算公式如下:
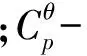
表4 顺丁烯二酸和反丁烯二酸的热力学数据
注:由于基团CO-(Cd)(O)、Cd-(CO)(H)的ΔS298未见相关报道,因此本文未做两种方法关于ΔS298的比较.
由基团贡献法和ABWY法估算出的反丁烯二酸的热力学函数是理想气体状态的函数值,而在反应体系中,KMnO4与反丁烯二酸的反应为液相反应,要计算其摩尔反应焓,需要知道反丁烯二酸为液相的摩尔反应焓,以及由液相变为气相的相变焓ΔHvap,其值为123.6 kJ·mol-1[13].通过Benson法估算出的反丁烯二酸(液相)的反应焓为-811.06 kJ·mol-1,通过ABWY法估算出的反丁烯二酸(液相)的反应焓为-823.41 kJ·mol-1.通过比较发现,采用基团贡献法估算出的数值与文献测量值-811.7 kJ·mol-1更为接近,因此采用基团贡献法做相关热力学函数的估算.
最终,选用Benson法估算出顺丁烯二酸和反丁烯二酸的Cp,m值,进行拟合后得到其摩尔恒压热容的经验常数,结果列于表5.

表5 顺丁烯二酸和反丁烯二酸摩尔恒压热容的经验常数
摩尔恒压热容与温度之间的函数关系式通常可以表示成如下经验式:
Cp,m=a+bT+cT2
因此合成反应前后标准摩尔恒压热容的计算可以用下式表示:
ΔCp,m=Δa+ΔbT+ΔcT2
Δa=∑vBaB,Δb=∑vBbB,Δc=∑vBcB
式中,vB为表1中化学反应I-Ⅳ中任意物质B的计量系数,aB、bB、cB为某物质B的摩尔恒压热容的经验常数,单位分别为J·mol-1·K-1、J·mol-1·K-2、J·mol-1·K-3.
通过以下公式[14]计算出各个反应在不同温度下的摩尔反应焓、摩尔反应吉布斯自由能以及平衡常数等热力学数值.
ΔrHm(T)=ΔH0+ΔaT+1/2ΔbT2+1/3ΔcT3
ΔrGm(T)=ΔH0-IRT-ΔaTlnT-1/2Δb/T2-1/6ΔcT3
ΔrGm(T)=-RTlnK
其中,ΔrHm(T)—对应温度T时摩尔生成焓,单位kJ·mol-1;ΔrGm(T)—对应温度T时摩尔生成吉布斯自由能,单位kJ·mol-1;K—平衡常数,单位J·mol-1·K-1;Cp,m—摩尔恒压热容;单位J·mol·K-1;T—温度,单位K; ΔH0—积分常数,单位J·mol-1;I—积分常数,无单位.
2.2 热力学函数值随温度变化的结果
图1为通过热力学计算得到反应Ⅰ~Ⅴ的摩尔反应焓ΔrHm与温度的关系;图2和图3分别为通过热力学计算得到反应Ⅰ、Ⅱ、III的摩尔反应吉布斯自由能ΔrGm、平衡常数lnK与温度的关系,由于基团CO-(Cd)(O)、Cd-(CO)(H)的ΔS298未见相关报道,因此本文未做高锰酸钾与顺丁烯二酸和反丁烯二酸摩尔反应熵ΔrS的估算,所以图2和图3中只有反应Ⅰ、Ⅱ、III的ΔrGm和InK随温度的变化曲线.
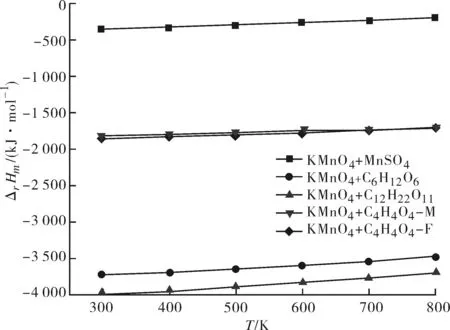
图1 摩尔反应焓ΔrHm随温度的变化Fig.1 Effect of temperature on ΔrHm
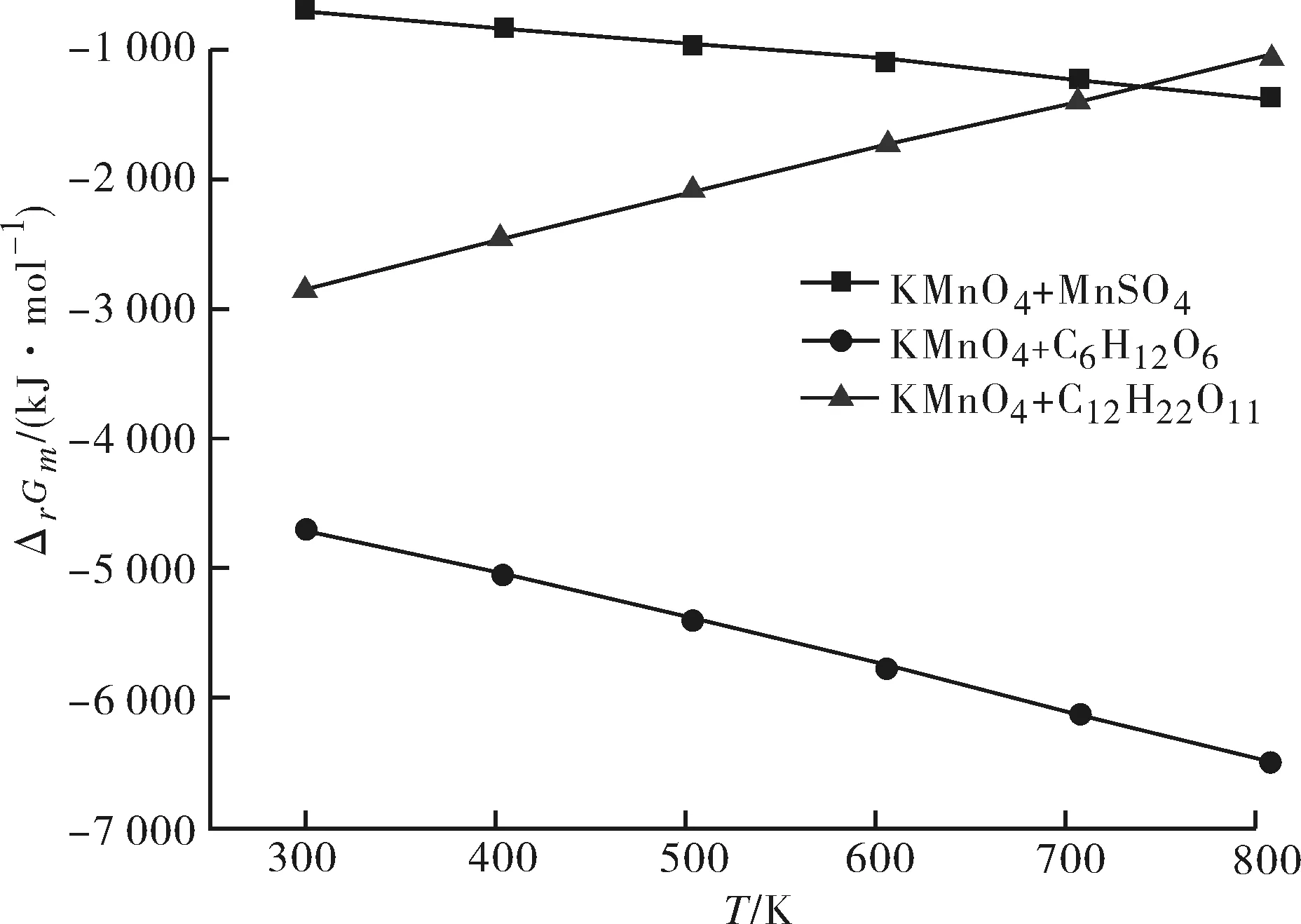
图2 摩尔反应吉布斯自由能ΔrGm随温度的变化Fig.2 Effect of temperature on ΔrGm
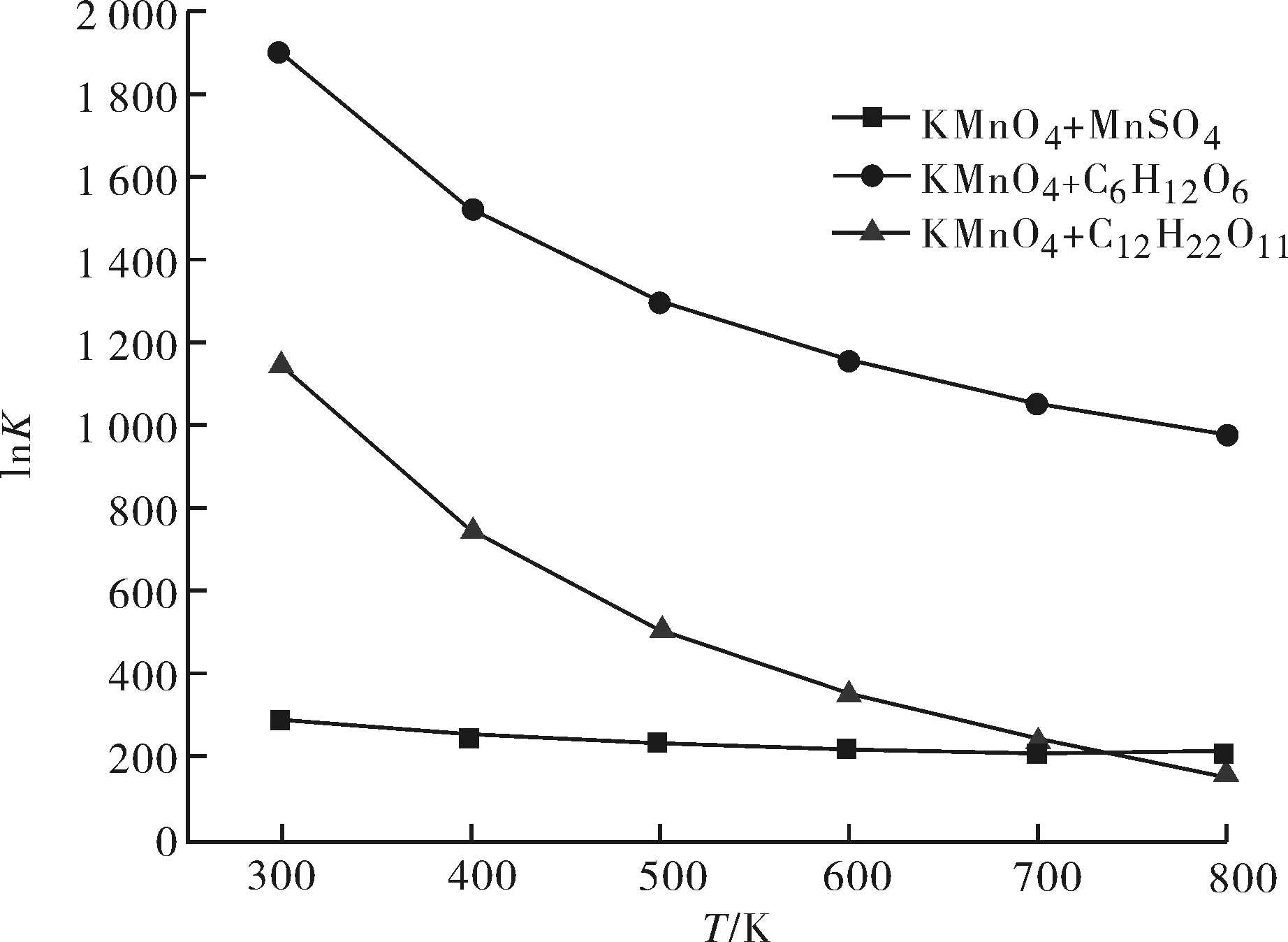
图3 平衡常数的自然对数值lnK随温度的变化Fig.3 Effect of temperature on lnK
从图1可以得出,温度在298~800 K时高锰酸钾与硫酸锰、葡萄糖、蔗糖、顺丁烯二酸、反丁烯二酸反应的摩尔反应焓均小于0,表明五个反应均为放热反应.而且,随着温度的升高放热量逐渐减少,说明温度在298~800 K范围内,温度越低,放热量越大,但反应放热量随温度的变化趋势较平缓.五个反应中,反应III(高锰酸钾与蔗糖)放热最大,与硫酸锰反应放热量最小,与蔗糖反应的放热量约为硫酸锰反应放热量的10倍.根据蔗糖的哈武斯结构式图,蔗糖是由吡喃葡萄糖环和呋喃果糖环构成,一分子的蔗糖水解生成一分子的葡萄糖和一分子的果糖,由基团贡献法的假设可知,纯物质或混合物的物性等于构成此化合物或混合物的各种基团对此物性的贡献值的总和,因此高锰酸钾与蔗糖在反应时放出的热量比与葡萄糖反应放出的热量大,这可能是蔗糖多出的呋喃果糖环中的基团贡献较多的热量.蔗糖和葡萄糖中包含的基团比顺丁烯二酸、反丁烯二酸和硫酸锰包含的基团多得多,因此它们与高锰酸钾反应放出的热量也大的多,与图1中通过热力学计算得出的反应Ⅱ和III比反应Ⅰ、Ⅳ、Ⅴ放出的热量大相符合.
通过图1的比较可知,采用不同还原剂时,对于反应放热较大的反应(如蔗糖为还原剂时), 反应温度宜控制在低温区域,这样既可以充分利用反应放出的高热量,低温环境中也可以及时移走反应热量,避免局部高温生成Mn2O3杂质;对于反应放热较小的反应(如硫酸锰为还原剂时),反应温度宜控制在高温区域, 这样可以有效加快反应速率,利用外部能量实现快速批量制备.
从图2中曲线可以得出,当温度在298~800 K范围内,Ⅰ、Ⅱ、III三个反应的吉布斯自由能均小于0,即三个反应在温度为298~800 K范围内时反应均能自发进行,随着温度的升高,反应Ⅰ和Ⅱ的吉布斯自由能均在逐渐减小;而反应III的吉布斯自由能随着温度的升高在逐渐上升,在温度接近1 000 K时,其吉布斯自由能等于0.因此,当温度超过1 000 K时反应III将不能自发进行.
从图3对应的反应平衡常数K随温度的变化表明,高锰酸钾与硫酸锰、葡萄糖和蔗糖反应时,温度降低,平衡将向正反应方向移动,即低温下更有利于反应进行.结合反应热效应可知,高锰酸钾与蔗糖反应时,反应温度宜控制在低温区,因此,蔗糖相比于其他还原剂更适合作为批量制备单一晶相的氧化锰分子筛的原料.
3 结果与讨论
a.通过对不同温度下热力学数据的分析可得:高锰酸钾与硫酸锰、葡萄糖、蔗糖、顺丁烯二酸和反丁烯二酸的反应均为放热反应.放热大小顺序为蔗糖﹥葡萄糖﹥反丁烯二酸≈顺丁烯二酸﹥硫酸锰,即在相同的温度下,高锰酸钾与蔗糖反应放热量最大,与硫酸锰反应放热最小.
b.对于反应放热较大的反应(如蔗糖为还原剂时), 反应温度宜控制在低温区域,这样既可以充分利用反应放出的高热量,低温环境中也可以及时移走反应热量,避免局部高温生成Mn2O3杂质;对于反应放热较小的反应(如硫酸锰为还原剂时),反应温度宜控制在高温区域, 这样可以有效加快反应速率,利用外部能量实现快速批量制备.
c.低温有利于高锰酸钾与硫酸锰、葡萄糖和蔗糖反应完全进行,因此,结合反应热效应分析,蔗糖相比于其他还原剂更适合在超重力反应器中批量制备单一晶相的氧化锰分子筛.
致 谢
感谢国家自然科学基金委、湖北省教育厅、武汉工程大学相关部门的资助!
参考文献:
[1] Suib S L. Structure, porosity, and redox in porous manganese oxide octahedral layer and molecular sieve materials[J]. J Mater Chem, 2008, 18(14): 1623-1631.
[2] DeGuzman R N,Shen Y F,Suib S L.Synthesis and characterization of Octahedral molecular sieves(OMS-2) having the hollandite structure[J]. Chem Mater, 1994(6):815-821.
[3] Ching S, Petrovay D J, Jorgensen M L, et al. Sol-gel synthesis of layered birnessite-type manganese oxides[J]. Inorg Chem, 1997, 36(5): 883-890.
[4] Tian H, He J, Zhang X, et al. Facile synthesis of porous manganese oxide K-OMS-2 materials and their catalytic activity for formaldehyde oxidation[J]. Microporous Mesoporous Mater, 2011, 138(1): 118-122.
[5] Ching S, Roark J L.Sol-gel route to the tunneled manganese oxide cryptomelane[J]. Chem Mater, 1997,9:750-754.
[6] Hong X, Zhang G, Zhu Y, et al. Sol-gel synthesis and characterization of mesoporous manganese oxide[J]. Mater Res Bull, 2003, 38(13): 1695-1703.
[7] King’ondu C K,Opembe N.N, Genuino H C, Garces HF, Njagi EC, Iyer A, Huang H, Dharmarathna S, and Suib S L. Nonthermal synthesis of three-dimensional metal oxide structures under continuous-flow conditions and their catalytic applications[J]. J. Phys. Chem. C, 2011, 115:23273-23282.
[8] Wang G, Zhao R H, Guo F,et al.Synthesis of organized mesoporous alumina by high gravity technology[J]. Journal of Chemical Industry and Engineering (China),2008(5):1310-1314.
[9] CRC handbook of chemistry and physics[M]. New York: C R C Press. 83rd Edition,2002-2003:5-3.
[10] 叶大伦.实用无机物热力学数据手册[M].2nd ed.北京:冶金工业出版社,1981:416-421,496-497,594-595.
YE Da-lun.Handbook of Thermodynamical Data of Practical Inorganic Compounds[M].2nd ed.Beijing: Metallurgical Industry Press, 1981: 416-421,496-497,594-595.(in Chinese)
[11] 马沛生.化工数据[M].北京:中国石化出版社,2003:26.
MA Pei-sheng.Chemical data[M].Beijing: China Petrochemical Press,2003:26.(in Chinese)
[12] 董新法,方利国,陈砺.物性估算原理及计算机计算[M].北京:化学工业出版社, 2006:187.
DONG Xin-fa,FANG Li-guo,CHEN Li. Property estimation principle and computer calculation[M]. Chemical Industry Press, 2006:187.(in Chinese)
[13] Felthouse T R,Burnett J C,Hortell B,et al.Maleic Anhydride,Maleic Acid and Fumaric Acid[M/OL].Austin:Kirk Online,1999-2013. [2012-07-24]http://onlinelibrary.wiley.com.
[14] 王承学,檀建群,苏春彦. 二氧化碳加氢合成乙烯反应机理与热力学研究[J]. 天然气化工,2012,37(2):37.
WANG Cheng-xue,TAN Jian-qun,SUN Chun-yan. Study on Synthesis of ethylene reaction mechanism and thermodynamics for carbon dioxide hydrogenation[J].Natural Gas Chemical Industry,2012,37(2):37.(in Chinese)
