蜜蜂与桃蚜烟碱乙酰胆碱受体同源模建与对接
2013-10-20巨修练王黎丽
巨修练,李 科,王黎丽
(武汉工程大学化工与制药学院,绿色化工过程省部教育部重点实验室,湖北 武汉 430074)
0 引 言
农药在现代农业生产中具有举足轻重的作用,是农业稳产增产不可或缺的保障,在防治病害虫方面发挥着重要作用[1].新烟碱类杀虫剂自问世以来,已成为农药市场占有率最高的杀虫剂类型之一;其中的大部分品种具有对多种抗性害虫显示出了较好的杀伤性,同时对哺乳动物较为安全的特性.吡虫啉是市场占有率最高的新烟碱类化合物,我国自1992年起便一直着手于对吡虫啉的使用进行深入研究[2].如今,我国市场上共有60多种以吡虫啉为主要成分的农药商品销售.虽然20多年来,吡虫啉在我国农业发展上做出了突出的贡献,但其危害性也是不容忽视的,尤其是近十多年来,吡虫啉对蜜蜂造成伤害的报告屡见不鲜[3].几百年来,由于具有对环境友好,产蜜量高,传花授粉等特性,蜜蜂被广泛饲养于世界各地.从这个角度看,该物种的基因差异性要远远低于其它昆虫,其对毒性化合物的反应结果也应相对稳定.但近些年来,全球各地陆续报道了吡虫啉对蜜蜂产生杀伤的报道,其中最早的报告来自于法国.本世纪初,法国蜂农报告称吡虫啉的使用导致蜜蜂群体性死亡现象的出现.随后,2003年由法国农业部指派的相关专家经过数月现场勘查发现,吡虫啉的使用会导致蜜蜂出现行为异常现象,损害了它们的记忆能力,相互交流的能力,觅食能力,以及返回蜂群的能力等[4-5].随后,美国养蜂人也于2006年冬注意到了类似的奇怪现象,它们所饲养的蜜蜂成批成批死亡,大约有35%的蜜蜂陆续消失,而原因却始终不明[6].
本研究使用同源模建的方法,构建蜜蜂与桃蚜相应的烟碱乙酰胆碱受体,随后与吡虫啉进行分子对接,找到对接结果的异同点,探究吡虫啉对蜜蜂造成伤害的作用成因,为进一步深入研究并设计出对桃蚜具有高毒性同时对蜜蜂安全的新型新烟碱类杀虫剂提供实验数据.
1 实验部分
烟碱乙酰胆碱受体(nicotinic acetylcholine receptor,nAChR)属于配体门控离子通道蛋白,同甘氨酸(Gly)受体、谷氨酸(Glu)受体、γ-氨基丁酸(GABAA,GABAC)受体以及5-羟色胺(5-HT3)受体等同属于半胱氨酸环受体超家族[7-8].当与相应的配体发生特异性结合时会被激活,它也是新烟碱类杀虫剂分子的重要靶标[9-10].nAChR是由五个亚基以不同的组合模式构成的五聚体蛋白,其广泛分布于中枢神经系统和周围神经系统中[11].研究表明,其在认知、学习、注意能力等活动中发挥着不可替代的作用.而其中每个亚基又各有不同,当它们以不同形式组合在一起时,会形成具有不同配体亲和力、离子选择性、电导率、脱敏性、调控机制以及药理学特性的nAChR.人们对哺乳动物nAChR的研究较为深入,取得的研究成果也较为突出.而对昆虫类nAChR的研究虽然不如脊椎动物彻底,但随着近些年来对新烟碱类化合物的不断探索,在分子生物学、药理学、毒理学等不同领域中都不同程度地揭示了昆虫nAChR 的相关性质[12-13].昆虫的烟碱乙酰胆碱受体亚基种类较多,因此其结构差异性较大.
蜜蜂是负责给多种农作物传授花粉的主要生物,它的死亡每年仅在美国就会造成数百亿美元的损失,因此亟需探明是什么原因导致了大批量工蜂集体死亡.科学家们把这种离奇的现象称作“蜂群衰竭失调”,并设法分析其原因,他们提出了形形色色的理论,比如可能与以色列急性麻痹病毒(Israeli acute paralysis virus)有关,也有说可能是由于郊区城市化、杀虫剂、农药、害虫、蜜蜂营养不良、蜂群饲养管理不当、真菌感染、免疫力不足、转基因农作物、气候变暖、电磁波辐射等,但广为接受的一种观点认为,“蜂群衰竭失调”现象的发生是多种原因共同作用的结果.但有研究表明,新烟碱类化合物在排除外部因素的干扰下,对蜂群内工蜂的数量有明显的削弱迹象.因此,新烟碱类杀虫剂近年来的大规模使用,是导致“蜂群衰竭失调”现象的重要原因之一.如今,法国、德国和斯洛文尼亚等欧洲国家由于担心对蜜蜂群体的严重影响,已经开始限制新烟碱类化合物的使用.本研究以“静水椎实螺”乙酰胆碱结合蛋白与吡虫啉分子结合的共晶化合物(acetylcholine-binding protein,AChBP)(蛋白质数据库序列号:2ZJU)作为模板,使用同源模建方法得到了蜜蜂(α1)2(β1)3和桃蚜(α2)2(β1)3nAChR的模型,根据它们与吡虫啉分子的对接结果,分析吡虫啉与益虫蜜蜂和害虫桃蚜结合模式的异同点,找出吡虫啉致死蜜蜂的真正原因.
本研究所有同源模建与分子对接工作是在微软视窗-7(Win7)平台上使用Tripos公司的分子模拟软件SYBYL X-1.2版本完成的.具体参数以标注为准,未说明的参数选择皆为系统默认值.蜜蜂(α1)2(β1)3型和桃蚜(α2)2(β1)3型nAChR三维结构的同源模建部分具体步骤如下:
a.序列的选取与下载.为了分别构建蜜蜂的α1和β1亚基以及桃蚜的α2和β1亚基,从Swiss-Prot/TrEMBL数据库下载得到了蜜蜂、桃蚜各亚基的原序列,包括:蜜蜂α1亚基(蛋白质一级序列号:AOEIZ1),β1 亚基(蛋白质一级序列号:AOEIZ8),桃蚜α2亚基(蛋白质一级序列号:P91764),β1亚基(蛋白质一级序列号:Q9NFX8).并对蜜蜂、桃蚜各亚基进行适当的结构修饰,仅保留了需要构建的4段膜外区域.
b.模板的选取.笔者选取了蜗牛“静水椎实螺”(Lymnaea stagnalis)乙酰胆碱结合蛋白与吡虫啉分子的共晶化合物作为模板,来构建蜜蜂α1、β1亚基和桃蚜α2、β1亚基.
c.亚基的构建.将选定的模板结构导入SYBYL X-1.2软件中,再进行去除 H2O、添加 H以及侧链优化等步骤.将通过手动剪切的目标序列与处理过的模板序列进行比对,系统会自动生成一个多序列比对文件.然后使用SYBYL软件的模建模块——Advanced protein modeling下属的ORCHESTRAR模块导入该文件,使得模板序列与三维结构一一对应,自动将两序列进行结构比对后自动构建氨基酸的肽链结构.
d.模型的组成.再将经过模建后的蜜蜂α1、β1亚基和桃蚜α2、β1亚基分别叠合到对应的模板亚基上,以 A-α,B-β,C-α,D-β,E-β的顺序分别构建蜜蜂(a1)2(β1)3型和桃蚜(α2)2(β1)3型烟碱乙酰胆碱受体.
e.模型的分子动力学模拟.随后使用分子动力学手段对构建得到的蜜蜂(α1)2(β1)3型和桃蚜(α2)2(β1)3型nAChR模型进行了结构优化.首先选择Amber7ff99立场对构建的模型进行共轭梯度法优化,AMBER力场是在生物大分子的模拟计算领域有着广泛应用的分子立场之一,主要适用于生物大分子和高分子模拟计算的力场体系,对小分子体系的计算结果通常不能令人满意.采用分子模拟软件SYBYL软件中的Dynamics模块对模建受体进行分子动力学模拟.选择在NPT(等离子等温定压)系综下进行模拟过程.模拟时长设定为500ps,而步长为1fs,采样时间间隔为2.5ps.此外,模拟系统内温度设定为300K,模拟压为0.101MPa.
2 结果与讨论
2.1 模型的验证结果
实验中,将蜜蜂的α1和β1亚基以及桃蚜的α2和β1亚基与蜗牛“静水椎实螺”AChBP与吡虫啉共晶复合物的模板序列进行比对(见图1).结果显示,蜜蜂α1和β1亚基与模板序列的序列一致性分别为26.09%和29.95%;而与模板序列的序列一致性分别为27.94%和24.16%.环区(Loop)是构成配体与受体进行分子对接的“结合口袋”的主要所在区域.表1为将蜜蜂的α1和β1亚基以及桃蚜的α2和β1亚基与模板进行序列比对,由表可以看到,在六个环区内的氨基酸残基是高度保守的.

图1 蜗牛“静水椎实螺”的模板序列与蜜蜂的α1和β1亚基以及桃蚜的α2和β1亚基的序列比对图Fig.1 Result of sequence alignment for honeybee,peach-potato aphid subunit and model chain
对构建模型的分子动力学模拟结果显示,蜜蜂(α1)2(β1)3型nAChR模型在开始的150ps里,能量降低较为明显,观察到从0kcal/mol下降到-2 000kcal/mol.在接下来的350ps时间,能量值稳定在-2 500~-2 000kcal/mol内浮动.由此可以判断,所构建的蜜蜂(α1)2(β1)3型nAChR模型是比较稳定的.而在桃蚜(α2)2(β1)3型nAChR模型的动力学模拟图中可知,其能量更加稳定.模拟结果进入100ps后,便基本稳定在-2 500~-2 000kcal/mol的范围内,随后400ps内在该区间内小幅波动较为稳定.由此可以判断,桃蚜(α2)2(β1)3型 nAChR 模 型比蜜蜂(α1)2(β1)3nAChR模型更为稳定.
此外,使用SYBYL软件包下的ProTable模块进行立体化学验证,图2为蜜蜂(α1)2(β1)3型和桃 蚜 (α2)2(β1)3型 nAChR 的拉氏图(Ramachandran Map).所构建的蜜蜂、桃 蚜nAChR模型具有大量的β折叠,而拉氏图结果显示,两个模型的拉氏图中有较多的氨基酸残基聚集在-135°到135°处,而该区域正是β折叠在拉氏图上的对应区域.在蜜蜂和桃蚜nAChR模型中,分别有97.81%和98.23%的氨基酸残基位于一般可接受区域(Additionally accepted region)或最大可接受区域(Most accepted region)中.通过动力学模拟结果和拉氏图验证,接下来进行构建模型与分子对接研究.
2.2 分子对接结果
使用Surflex-docking模块进行分子对接实验.将吡虫啉(Imidacloprid)分子分别与同源模建得到的蜜蜂(α1)2(β1)3型和桃蚜(α2)2(β1)3 型nAChR进行分子对接.最高打分结果下的氢键键长、键角、给体和受体情况如表1所示.
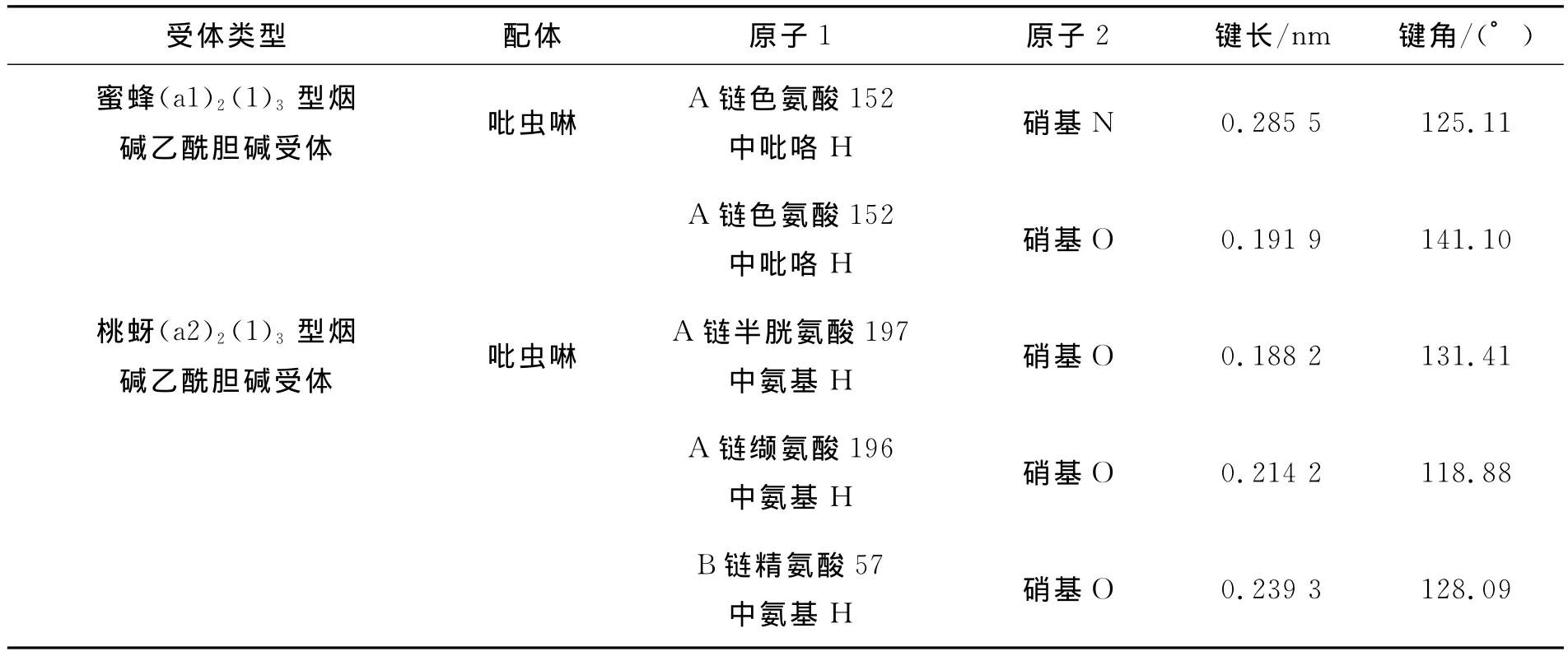
表1 吡虫啉与蜜蜂和桃蚜nAChR对接时形成氢键的键长、键角、氢键给体和氢键受体数据表Table 1 distance and angle of H-bonds from honeybee and peach-potato aphid nAChRs and IMI
蜜蜂(α1)2(β1)3型和桃蚜(α2)2(β1)3型nAChR与吡虫啉分子对接的结合自由能最高值分别为-9.592 4kcal/mol和-7.124 1kcal/mol.而该数据与吡虫啉和蜜蜂、桃蚜结合的IC50值结果相吻合(分别为2.8nm和3.1nm).说明吡虫啉分子对所构建的两个模型均具有较高的亲和力.同时也可知,其对益虫蜜蜂有着与害虫桃蚜同等效应的毒性作用.
图2为吡虫啉分子与蜜蜂(α1)2(β1)3型烟碱乙酰胆碱受体结合图.吡虫啉分子深入到了由α(+)/β(-)亚基组成的结合口袋中.对接图显示,在蜜蜂(α1)2(β1)3型nAChR中,吡虫啉分子主要与来自β1亚基的环区B片段发生相互作用.Tomizawa和Casida在相关论文中阐述了与昆虫烟碱乙酰胆碱受体发生相互作用的主要是吡虫啉的硝基部分,而在本次研究得到的对接结果中可以看出,蜜蜂模型的α亚基环区B中的Tyr152与吡虫啉分子硝基的N原子和O原子均发生了氢键作用,其与模板结构中的Trp143相对应[14].还可以观察到,吡虫啉的氯吡啶基团渗入到一个由α亚基的Trp152,Tyr96,Tyr201和Tyr208以及β亚基的Trp59构成的疏水口袋中,形成了相应的阳离子-π作用.这一作用在Bisson等人所构建的人类α4/β2和α7神经型烟碱乙酰胆碱受体中均有报道,但相类似的疏水口袋在吡虫啉与桃蚜模型对接图中并未出现[15].此外,在与蜜蜂模型对接结果中,吡虫啉的吡啶环与α亚基的Tyr201发生了明显的π-π对接作用,而这一作用也并未在吡虫啉与桃蚜模型的对接结果中发现.
而在吡虫啉与桃蚜模型的对接图中(见图3),吡虫啉的硝基部分主要与α亚基环区C以及β亚基的环区D发生相互作用.同吡虫啉与蜜蜂模型的对接图比较我们不难发现,与桃蚜模型的对接结果中,吡虫啉的硝基胍部分发生了完全翻转,朝向了α亚基的半胱氨酸环区域,而环区C(氨基酸序列为YXCC)中的Val196和Cys197与吡虫啉分子硝基的两个O原子发生了氢键作用.Shimomura等人曾经报道过发生在果蝇α2β2烟碱乙酰胆碱受体的α2亚基环区C上的Pro突变为Glu会导致吡虫啉对其亲和力降低[16].此外,对应模型中的Gln55的分别为蜜蜂β1亚基的Arg61和桃蚜β1亚基的Arg57,Shimomura等人也曾经报道过鸡α7同源nAChR中的Gln突变为Arg会导 致 吡 虫 啉 效 应 的 提 升[17-18].而 脊 椎 动 物 的nAChR,例如人类β4亚基在该位点为赖氨酸,与吡虫啉分子均没有发生明显的相互作用.由此可以推断,该位点的氨基酸残基Arg是导致吡虫啉与两模型对接结果无选择性的主要原因之一.且吡虫啉硝基上的O原子与桃蚜模型β1亚基的Arg57的侧链直接发生了氢键作用,而类似的氢键作用在蜗牛乙酰胆碱蛋白和吡虫啉对接中也有发现.验证了环区D区域会与吡虫啉分子的硝基或氰基直接形成相互作用.
3 结 语
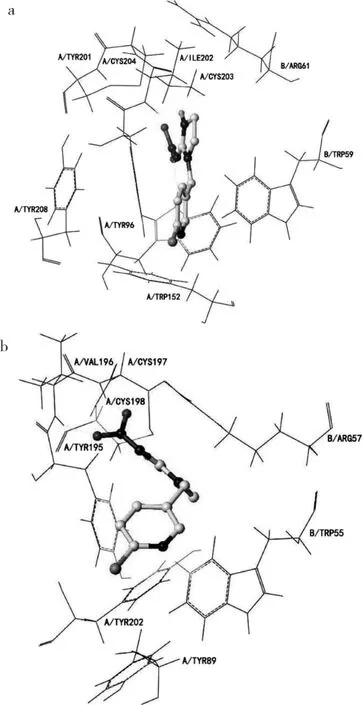
图3 吡虫啉与蜜蜂及桃蚜nAChR对接图Fig.3 Images of IMI docking with honeybee and peach-potato aphid nAChRs
本实验采用SYBYL软件中的同源模建手法,以“静水椎实螺”(Lymnaea stagnalis)乙酰胆碱结合蛋白与吡虫啉分子的共晶化合物为模板,构建了蜜蜂(α1)2(β1)3型nAChR 和桃蚜(α2)2(β1)3型nAChR.经过拉氏图和分子动力学模拟过程验证了所建模型的合理性和可靠性.将新烟碱类化合物的代表吡虫啉分别于所构建模型进行分子对接,所得到的结合自由能结果实验数据与IC50相吻合.此外,对接结果显示,吡虫啉的硝基部分在对接中起到了关键作用,是吡虫啉对两受体无选择性作用的主要原因,同时也证明了吡虫啉的使用确实危害到了蜜蜂群体的生存.
[1]李阳,黄翔,陈达,等.5-芳基-3-羟基异恶唑的合成[J].武汉工程大学学报,2011(5):18-21.LI Yang, HUANG Xiang,CHEN Da,et al.Synthesis of 5-aryl-substituted-3-hydroxy-isoxazoles[J].Journal of Wuhan Institute of Technology,2011(5):18-21.(in Chinese)
[2]SUCHAIL S,GUEZ D,BELZUNCES L P.Discrepancy between acute and chronic toxicity induced by imidacloprid and its metabolites in Apis mellifera[J].Environmental Toxicology and Chemistry,2001,20(11):2482-2486.
[3]OLDROYD B P.What's killing American honey bees?[J].PLOS Biol,2007(5):1195-1199.
[4]FAUCON J P,AURI?RES C,DRAJNUDEL P,et al.Experimental study on the toxicity of imidacloprid given in syrup to honey bee(Apis mellifera)colonies[J].Pest Management Science,2005,61(2):111-125.
[5]NAUEN R,EBBINGHAUS-KINTSCHER U,SCHMUCK R.Toxicity and nicotinic acetylcholine receptor interaction of imidacloprid and its metabolites in Apis mellifera(Hymenoptera:Apidae)[J].Pest Managment Science,2001,57(7):577-586.
[6]VANENGELSDORP D,EVANS J D,SAEGERMAN C,et al.Colony collapse disorder:a descriptive study[J].Plos One,2009,4(8):1-17.
[7]UNWIN N.Refined structure of the nicotinic acetylcholine receptor at 4Åresolution[J].Journal of Molecular Biology,2005,346(4):967-989.
[8]UNWIN N,MIYAZAWA A,LI J,et al.Activation of the nicotinic acetylcholine receptor involves a Switch in conformation of the alpha subunits[J].Journal of Molecular Biology,2002,319(5):1165-1176.
[9]TOMIZAWA M,LEE D L,CASIDA J E.Neonicotinoid insecticides:molecular features conferring selectivity for insect versus mammalian nicotinic receptors[J].Journal of Agricultural and Food Chemistry,2000,48(12):6016-6024.
[10]SATTELLE D B.Invertebrate nicotinic acetylcholine receptors-targets for chemicals and drugs important in agriculture,veterinary medicine and human health[J].Journal of Pesticide Science,2009,34(4):233-240.
[11]CORRINGER P J,LE NOVÈRE N,CHANGEUX J P.Nicotinic receptors at the amino acid level[J].Annual Review of Pharmacology and Toxicology,2000,40:431-458.
[12]TOMIZAWA M,CASIDA J E.Imidacloprid,thiacloprid,and their imine derivatives Up-Regulate theα4β2nicotinic acetylcholine receptor in M10 cells[J].Toxicology and Applied Pharmacology,2000,169(1):114-120.
[13]TOMIZAWA M,CASIDA J E.Selective toxicity of neonicotinoids attributable to specificity of insect and mammalian nicotinic receptors[J].Annual Review of Entomology,2003,48:339-364.
[14]TOMIZAWA M,CASIDA J E.Neonicotinoid insecticide toxicology:mechanisms of selective action[J].Annual Review of Pharmacology and Toxicology,2005,45:247-268.
[15]BISSON W H,WESTERA G,SCHUBIGER P A,et al.Homology modeling and dynamics of the extracellular domain of rat and human neuronal nicotinic acetylcholine receptor subtypes alpha4-beta2and alpha7 [J].Journal of MolecularModeling,2008,14(10):891-899.
[16]SHIMOMURA M,YOKOTA M,MATSUDA K,et al.Roles of loop C and the loop B-C interval of the nicotinic receptor alpha subunit in its selective interactions with imidacloprid in insects [J].Neuroscience Letters,2004,363(3):195-198.
[17]SHIMOMURA M,YOKOTA M,IHARA M,et al.Role in the selectivity of neonicotinoids of insect-specific basic residues in loop D of the nicotinic acetylcholine receptor agonist binding site[J].Molecular Pharmacology,2006,70(4):1255-1263.
[18]SHIMOMURA M,SATOH H,YOKOTA M,et al. Insect-vertebrate chimeric nicotinic acetylcholine receptors identify a region,loop B to the N-terminus of the Drosophila Dalpha2subunit,which contributes to neonicotinoid sensitivity[J].Neuroscience Letters,2005,385(2):168-172.
