自身免疫性胰腺炎二例报道并文献分析
2013-04-20徐梅梅高福来谢长顺
徐梅梅,高福来,李 莉,谢长顺,郑 岳
自身免疫性胰腺炎(AIP)是胰腺将自身成分作为抗原由CD4阳性辅助细胞产生免疫应答而造成的胰腺炎症性病变,是以胰腺肿大、胰管不规则狭窄为特征的特殊类型的胰腺炎。AIP多以黄疸为首发症状,临床上较少见,发病率较低,我科2011—2013年收治2例AIP患者,现将诊治过程报道如下。
1 病例简介
患者1,男性,69岁,干部,主因“腹胀2个月,发现皮肤、巩膜黄染3 d”入院。患者缘于3个月前无明显诱因出现餐后上腹部胀满不适,间断性发作,伴大便习惯改变(4~6次/d,成型黄色大便),3 d前出现小便黄染,呈酱油色,大便呈白陶土色,并逐渐出现全身皮肤、巩膜黄染,无皮肤瘙痒,伴乏力,食欲差,我院门诊以胰腺炎收入院。自发病以来,体质量下降5 kg。家族史:患者两兄弟均曾因可疑胰腺癌而行手术,术后均未发现癌细胞。入院时查体:意识清楚,全身皮肤、巩膜黄染,浅表淋巴结无肿大,心肺无异常,腹平软,无压痛,肝脾未触及。移动性浊音阴性,肠鸣音正常。胰腺磁共振成像(MRI)、磁共振胰胆管造影(MRCP)、十二指肠乳头及胆总管异常改变,考虑为炎症;胰腺异常改变,考虑为胰腺炎(见图1~3)。实验室检查结果,肝功能示丙氨酸氨基转移酶(ALT):695 U/L,天冬氨酸氨基转移酶(AST):464 U/L,总胆红素:103.7 μmol/L,直接胆红素:68.4 μmol/L,间接胆红素:35.3 μmol/L,球蛋白:47.3 g/L,谷氨酰转肽酶(GGT):843 U/L,免疫球蛋白G(IgG):24.7 g/L;自身免疫肝病,抗核抗体-IF(-),抗线粒体抗体(-),抗润盘抗体(-),抗横纹肌抗体(-),抗平滑肌抗体(-),抗肝-肾微粒体抗体(-),血清淀粉酶正常;肿瘤标志物,CA-199:104.8 U/L,IgG4:24.7 g/L,且患者CA-199明显升高,不能除外胰腺癌。行胰腺活检病理报:胰腺腺泡萎缩,小导管增生,间质大量纤维增生,炎细胞浸润。液基薄层细胞学检查:未见恶性细胞。患者经口服胰酶及熊去氧胆酸治疗胆红素下降,CA-199正常。最终诊断为自身免疫胰腺炎。
患者2,男性,70岁,农民,主因“间断皮肤、巩膜黄染10 d”入院。入院前10 d无明显诱因出现皮肤、巩膜黄染,伴陶土样便,恶心、呕吐,为胃内容物,随时间延长黄疸进行性加重伴明显消瘦,就诊于中国人民解放军281医院:B超示:胆囊增大,胰腺增大。我院门诊MRCP示:胰腺弥漫性病变侵及胆总管。患者后就诊于中国人民解放军总医院(301医院)和北京协和医院,并在两院行病理检查(结果未回报),为进一步诊治,门诊以梗阻性黄疸收入我院。既往体健,有青霉素过敏史,无烟酒嗜好。查体:意识清楚,全身皮肤、巩膜黄染,浅表淋巴结无肿大,心肺无异常,腹平软,无压痛,反跳痛,腹部无包块,肝脾未触及。移动性浊音阴性,肠鸣音正常,4次/min。胰腺MRI及MRCP示:胰腺异常改变及继发胆管扩张,胰腺弥漫性病变侵及胆总管,肝内多发异常信号影,考虑肝囊肿(见图4)。实验室检查:肝功能示ALT 109 U/L,AST 123 U/L,总胆红素:170.1 μmol/L,直接胆红素:120.5 μmol/L,清蛋白:27.6 g/L,球蛋白:58 g/L,谷氨酰转肽酶:224 U/L,碱性磷酸酶:220 U/L,红细胞沉降率:89 mm/h,CA-199:612 U/ml,血清淀粉酶正常,IgG1:11 500 mg/L,IgG2:4 760 mg/L,IgG:3 591 mg/L,IgG4>58 700 mg/L。入院后经内镜逆行性胰胆管造影术(ERCP)示:胆总管下段狭窄(见图5);十二指肠乳头病理检查示:黏膜组织慢性炎。患者为中老年男性,>50岁,以黄疸为主要症状,球蛋白及IgG4明显升高,影像学检查示:胰腺增大,肝内外胆管扩张,胆总管下端狭窄。十二指肠乳头病理检查示:黏膜组织慢性炎,胆总管扩张,考虑为AIP。给予口服泼尼松40 mg,1次/d治疗后黄疸症状逐渐改善。
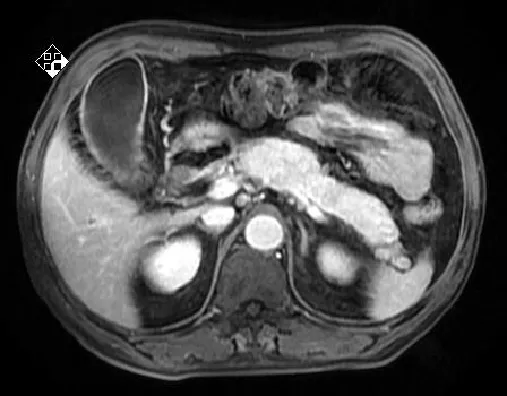
图1 胰腺弥漫性肿大

图2 胰腺弥漫性肿大
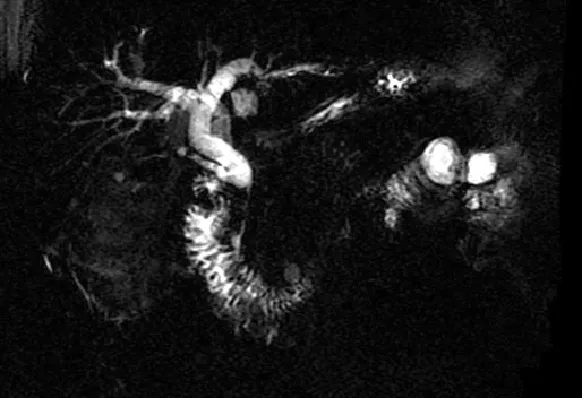
图3 胆总管下端狭窄
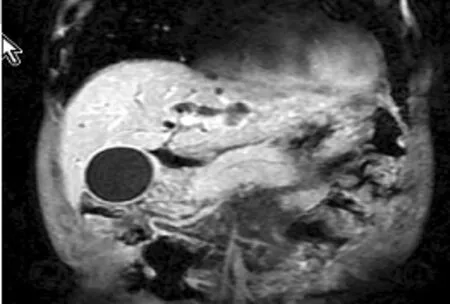
图4 胰腺异常改变及继发胆管扩张,胰腺弥漫性病变侵及胆总管

图5 胆总管下端狭窄,胆总管上端扩张
2 讨论
AIP是一种以自身免疫性炎症过程为表现的慢性胰腺炎,以胰腺大量淋巴细胞浸润伴纤维化为特征[1]。多以黄疸为首发症状,腹痛常不明显,主要以胰腺肿大,胰管不规则狭窄为特征。该病在人群中发病率尚不清楚,在东西方不同国家AIP在慢性胰腺炎所占比例相似,为3.92%~6.00%,AIP发病率可能与种族、地理环境无明显关系。AIP是疑似为胰腺癌而行外科手术切除术最常见的良性病变,占所有胰腺切除术的2.2%~2.5%。Abramham等[2]报道442例手术中有47例为良性病变,其中11例为AIP,术前诊断均为胰腺癌,因此本病很容易误诊。
AIP发病机制尚未明确,目前考虑自身免疫因素是此病的基础[3]。AIP患者常伴有高γ球蛋白血症,血清IgG、IgG4水平升高,自身抗体阳性,同时伴有干燥综合征、类风湿性关节炎、溃疡性结肠炎等,以上均提示其与自身免疫异常有关。我科收治的2例患者球蛋白明显升高,提示与免疫系统疾病有关。
AIP主要临床特征表现为:中老年男性(>50岁),起病隐匿,临床极少有急性胰腺炎表现,约2/3的患者有梗阻性黄疸,多为轻中度,也可为重度,可呈进行性或间歇性,约2/5的患者有非特异性的轻度上腹痛或上腹部不适。
AIP实验室检查:10%~100%患者自身抗体阳性,常有高γ球蛋白血症和(或)IgG4增高,特别是IgG4水平升高在AIP诊断中具有重要作用。Hamano等[4]报道:IgG4水平升高诊断AIP的敏感度为95%,特异度为97%。约半数患者血清淀粉酶轻度升高,但升高3倍以上者少见。白细胞计数基本正常,嗜酸粒细胞、IgE水平可升高,2/3的患者胆红素升高,转氨酶异常。
AIP影像学检查:典型的弥漫性AIP在X线电子计算机断层扫描(CT)和MRI上显示为腊肠样改变,密度降低,部分患者胰周出现低密度包膜样缘包围胰腺,而不累及邻近系膜及系带,此缘界限清晰、平整胰腺钙化和假性囊肿形成罕见[5]。
AIP病理特点:胰腺肿大及淋巴细胞、浆细胞浸润以及胰腺组织纤维化,很少出现胰腺钙化,胰管结石,或胰腺假性囊肿。
AIP治疗:口服糖皮质激素疗效显著,可使症状显著缓解。常用剂量为泼尼松口服,开始剂量30.0~40.0 mg/d,每2周减5.0 mg,至15.0 mg时改为每4~8周减2.5 mg,维持剂量为2.5~5.0 mg/d[6]。除糖皮质激素外,Tsubakio等[7]报道熊去氧胆酸能较好地治疗AIP,使其并发的肝功能损害明显改善,胰腺体积缩小,有望成为激素的替代药物,可以避免因长期应用激素引起的不良反应。
AIP诊断尚未统一,日本和韩国提出的亚洲标准:影像学(2条必备):(1)胰腺实质影像学:腺体弥漫性/局限性/局灶性增大;(2)胰胆管影像学:弥漫性/局限性、局灶性胰管狭窄,伴有胆管狭窄。
血清学(必备1条):(1)血清IgG或IgG4水平升高;(2)其他自身抗体阳性。
组织学:发现胰腺淋巴细胞、浆细胞浸润以及纤维化,有大量IgG4阳性细胞浸润。
可选择的诊断标准:对激素的反应。
本研究2例患者均以黄疸为主要临床表现,无明显腹部疼痛等表现,实验室检查结果均为IgG水平升高,影像学检查患者1 MRI示,胰腺弥漫性肿大,成腊肠样改变,胆总管上段扩张,胰腺段狭窄。曾怀疑为急性胰腺炎,不除外胰腺癌,但最终行胰腺病理活检后诊断为AIP,经口服熊去氧胆酸有效。患者2影像学检查可见胰腺弥漫性肿大,怀疑胰腺癌,行ERCP可见胆总管胰段狭窄,胆总管上段扩张,十二指肠乳头病理检查示,炎性改变,且实验室检查示,IgG4水平升高,考虑为AIP,经激素治疗有效最终诊断为AIP。
综上,分析我院发现并确诊的2例AIP患者的诊治经过,虽然AIP少见,临床容易误诊,但只要认识AIP实验室检查及影像学表现的特点,临床中能怀疑到此病的可能性,再进一步完善相关检查,也可行诊断性治疗,就能明确诊断AIP。
1 Finkeberg DL,Sahani D,Deshpande V,et al.Autoimmune pancreatitis[J].N Engl J Med,2006,355(1):2670-2676.
2 Abraham SC,Wilentz RE,Yeo CJ,et al.Pancreaticoduodenectomy(Whipple Resection)in patients without malignancy:are they all chronic pancreatitis?[J].Am J Surg Pathol,2003,27(3):110-120.
3 Chari ST,Echelmeyer S.Can histopathology be the "Gold STandard" for dignosing autonommune pancreatitis?[J].Gastroenterology,2005,129(6):2118-2120.
4 Hamano H,Kawa S,Horiuchi A,et al.High serum IgG4 concentrations in patients with sclerosing pancreatitis [J].N Engl J Med,2001,344(4):732-738.
5 Wakabayashi T,Kawaura K,Satomura Y,et al.Clinical and imaging features of autoimmune pancreatic with focal pancreatic awelling or mass formation:comparison with so-called tumor-forming pancreatitis and pancreatic carcinoma[J].Am J Gastroenterol,2003,98(6):2679-2687.
6 Takayoshi N,Fummitake T,Hiroyasu O,et al.Long-term outcome of autoimmune pancreatitis after oral prednisolone therapy[J].Internal Medicine,2006,45(8):497.
7 Tsubakio K,Kiriyama K,Matsushima N,et al.Autoimmune pancreatitis successfully treated with ursodeoxycholic acid[J].Intern Med,2002,41(12):1142.
