转化生长因子β1基因-509C/T多态性与原发性肾病综合征相关关系的研究
2013-04-19黄典胜施燕春梁延秀黄振华陆玲娜
项 新,黄典胜,施燕春,梁延秀,黄振华,何 坤,陆玲娜
原发性肾病综合征(PNS)是常见的肾脏疾病,但目前其病因尚不明确。近年来,随着分子生物学等研究手段的成熟和深入,一些研究结果显示某些基因多态性与PNS的易患性、激素疗效、疾病复发、病理进展及预后明显相关,转化生长因子β1(TGFβ1)作为最重要的导致肾小球硬化和肾间质纤维化的细胞因子之一,近年来受到国内外学者的关注。TGFβ1是一种具有多种生物学功能的细胞因子,在调节细胞外基质(ECM)代谢、参与炎症反应和间质纤维化等方面起重要作用[1],TGFβ1基因定位于19q13.1-3,TGFβ1基因-509C/T单核苷酸多态性位点位于基因上游转录起始点前509 bp处-731~-453间,而此区域恰是TGFβ1基因的负性调控区[2]。本研究采用病例-对照研究、临床病理分析和病例追踪随访的方法,探讨这一基因多态性位点与PNS发生、发展的相关关系。
1 资料与方法
1.1 研究对象 (1)PNS组:来自2005年1月—2012年1月广西民族医院肾内科住院患者,均取得患者及家属的知情同意。PNS组80例患者均按照1992年黄山会议建议的肾小球疾病临床分型标准诊断为PNS,排除了继发性肾小球疾病。患者均行肾穿刺活检,并且入院前2周内未应用激素类药物。80例患者中男50例,女30 例,年龄16~70岁,平均(46.5±14.9)岁。(2)对照组:选取同期在本院进行健康体检,且血、尿常规和肝肾功能正常,无原发、继发性肾小球疾病及肿瘤等其他疾病者60例作为对照组。60例对照者中男40例,女20例,年龄20~71岁,平均(42.2±11.2)岁;两组受检者的性别构成、年龄间具有均衡性。
1.2 治疗方法及疗效判定 80例患者入院明确诊断后即给予泼尼松口服,1 mg·kg-1·d-1,疗程8~12周。疗效评定标准,有效:临床症状消失,24 h 尿蛋白定量较前下降 50%以上,血清清蛋白升高,肾功能稳定; 无效:临床症状无改善,仍为肾病综合征或24 h 尿蛋白定量下降未达到治疗前的一半,肾功能无变化或恶化。
1.3 基因组DNA的提取 抽取外周抗凝血5 ml,应用美国G£T公司DAN提取试剂盒,严格按照说明书提取。
1.4 TGFβ1基因-509C/T基因型鉴定 参照文献[2]设计引物,由华大基因上海鼎安生物科技有限公司合成。上游引物序列5′-GCT AAG GCA TGG CAC CGC TT-3′,下游引物序列5′-GAA GGA GGG TCT GTC AAC ATG GG-3′,聚合酶链反应(PCR)扩增含有(-509C/T)单核苷酸多态性位点的TGFβ1基因外显子翻译起始点的上游调控区域。 PCR反应条件:94 ℃预变性5 min;再按下列程序循环35次,即94 ℃变性35 s,57 ℃退火35 s,72 ℃延伸35 s;末次循环后,72 ℃延伸10 min。PCR反应体积为30 μl,Eco811限制性内切酶37 ℃水浴消化,PCR产物琼脂糖凝胶电泳分带,确定基因型。
1.5 收集患者病理资料和临床资料 血压、血肌酐、血尿素氮、血清清蛋白、三酰甘油、总胆固醇、24 h尿蛋白。血压以患者首次入院后治疗前在3个不同时间点安静状态下测量的血压值的平均值为准。
1.6 统计学方法 采用SPSS 13.0统计软件进行统计学处理。Hardy-Weinberg平衡吻合度检验群体代表性。计量资料组间比较采用方差分析,计数资料组间构成比的比较采用χ2检验,检验水准α=0.05。
2 结果
2.1 TGFβ1基因-509C/T基因型分析
2.1.1 PCR扩增产物鉴定 扩增产物为包含TGFβ1基因-509C/T多态性位点在内的DNA片段,片段长度为270 bp,经1.5%琼脂糖电泳鉴定,选择扩增产物含量较高、特异性好者进一步进行RFLP分析(见图1)。
2.1.2 -509C/T多态性酶切电泳和测序 酶切后CT基因型显示3条条带,片段长度分别为270 bp、198 bp和72 bp(72 bp很难观察到),TT基因型显示2条条带,片段长度分别为198 bp和72 bp,CC基因型显示1条清晰条带,片段长度为270 bp(见图2)。
2.2 病例-对照研究 PNS组与对照组受检者的TGFβ1-509C/T基因型及等位基因的分布频率比较,差异均无统计学意义(P>0.05,见表1)。
表1 PNS组与对照组TGFβ1-509C/T基因型和等位基因分布频率的比较〔n(%)〕
Table1 Comparison of the genotype and allele frequency of TGFβ1-509C/T polymorphism of patients with primary nephrotic syndrome and control subjects
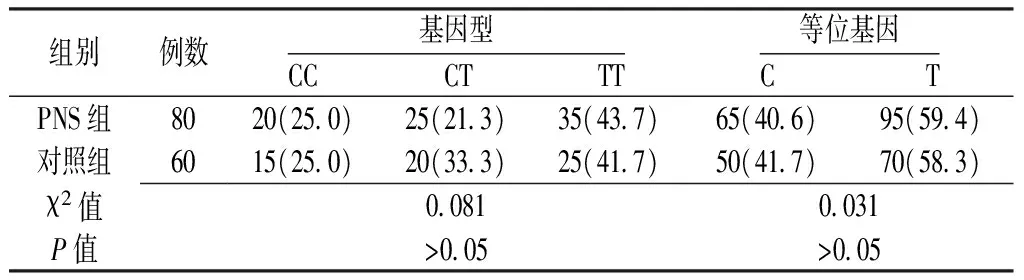
组别例数基因型CC CT TT等位基因CTPNS组8020(25 0)25(21 3)35(43 7)65(40 6)95(59 4)对照组6015(25 0)20(33 3)25(41 7)50(41 7)70(58 3)χ2值0 0810 031P值>0 05>0 05
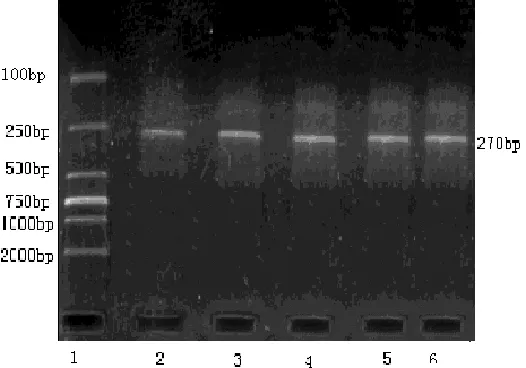
注:Lanes 1为DNA Marker DL 2000;Lanes 2、3、4、5、6为TGFβ1(-509C/T)
图1 PCR扩增产物
Figure1 Amplification products of TGFβ1-509C/T gene
2.3 临床分析 80例PNS患者中CC基因型者20例,CT基因型者25例,TT基因型者35例。TT基因型患者血肌酐、24 h尿蛋白水平高于CT基因型和CC基因型患者,差异均有统计学意义(P<0.05),而3种基因型患者的性别构成、年龄及血压、血脂、血清清蛋白水平间差异均无统计学意义(P>0.05,见表2)。
2.4 病理分析 不同病理类型的PNS患者CC、CT、TT基因型分布频率间差异有统计学意义(χ2=3.902,P<0.05),其中微小病变性肾小球肾炎、膜增生性肾小球肾炎、膜性肾病及局灶硬化性肾小球肾炎患者基因型分布频率间差异无统计学意义(χ2=2.495,P>0.05,见表3)。
2.5 追踪随访 治疗有效组患者与无效组患者基因型及等位基因的分布频率间差异均有统计学意义(P<0.05,见表4)。

注:Lanes 1、3、5、6、8:CT基因型,包括 270 bp 、198 bp、72 bp 片段;Lanes 4、7:CC基因型,包括270 bp片段;Lanes 2:TT 基因型,包括 198 bp、72 bp片段; M:DNA marker DL 2000
图2 TGFβ1基因-509C/T多态性酶切
Figure2 Genotypes of TGFβ1-509C/T polymorphism by PCR-RFLP
表3 TGFβ1-509C/T基因多态性与PNS病理的相关性
Table3 Correlation of TGFβ1-509C/T polymorphism with primary nephrotic syndrome pathology
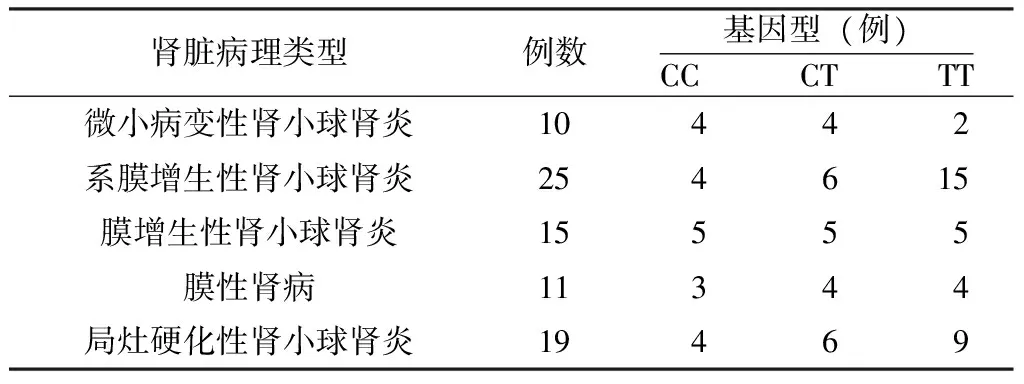
肾脏病理类型例数基因型(例)CCCTTT微小病变性肾小球肾炎10442系膜增生性肾小球肾炎254615膜增生性肾小球肾炎15555膜性肾病11344局灶硬化性肾小球肾炎19469
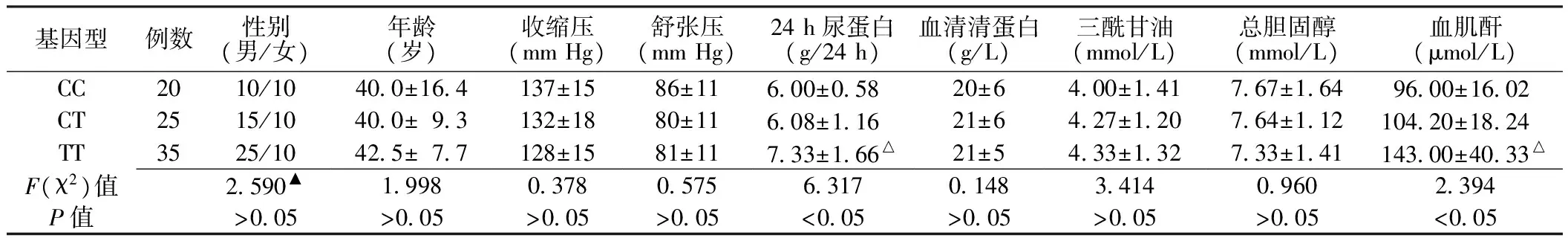
表2 TGFβ1-509C/T基因多态性与PNS临床的相关性Table 2 Correlation of TGFβ1-509C/T polymorphism with primary nephrotic syndrome clinic
注:▲为χ2值;与CT、CC基因型比较,△P<0.05
表4 TGFβ1-509C/T基因多态性与PNS疗效的相关性〔n(%)〕
Table4 Correlation of genotype and allele frequency of TGF β1-509C/T polymorphism with clinical effect in primary nephrotic syndrome
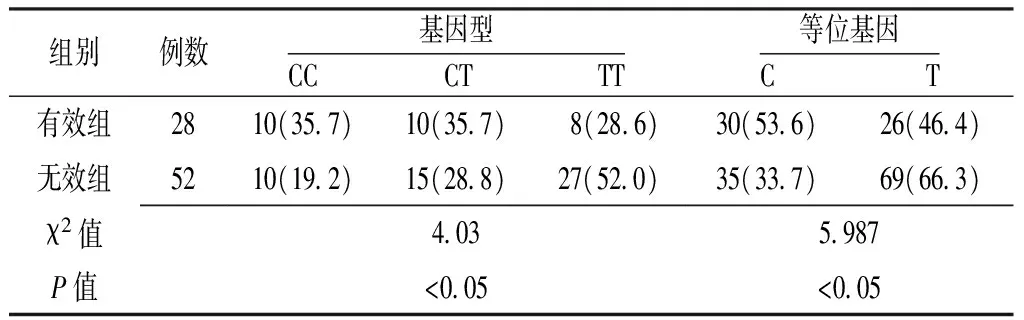
组别例数基因型CC CT TT等位基因CT有效组2810(35 7)10(35 7) 8(28 6) 30(53 6)26(46 4)无效组5210(19 2)15(28 8)27(52 0)35(33 7)69(66 3)χ2值4 035 987P值<0 05<0 05
3 讨论
TGFβ1作为一种具有双向性、多功能的细胞因子,主要在肾小球、肾小管上皮细胞和肾间质成纤维细胞表达,人类肾小球细胞表面有TGFβ1受体,TGFβ1通过与细胞表面特定的受体结合而发挥作用[3-5],是一种公认的强效促纤维化细胞因子,动物实验和临床实践均证实TGFβ1可通过Smad信号转导途径在肾小球硬化的发生、发展中发挥关键作用[6-7]。TGFβ1基因-509C/T单核苷酸多态性位点位于基因上游转录起始点前509 bp,处于-731~-453 bp间,而此区域恰是TGFβ1基因的负性调控区。有研究证实-509T等位基因与TGFβ1分子水平相关,且与杂合子相比,纯合子循环中TGFβ1分子水平更高[4]。
肾病综合征的病因尚未明确,有研究显示血管紧张素转换酶基因多态性[8]、载脂蛋白E基因多态性[9]、血小板活化因子分解酶基因多态性[10]、人类白细胞抗原基因多态性与PNS的易患性、 激素疗效、 疾病复发、 病理进展及预后明显相关,理论上TGFβ1基因-509C/T多态性位点与TGFβ1转录和循环TGFβ1水平有关,也应与肾病综合征有密切关系。
本病例-对照研究结果显示:PNS患者的TGFβ1基因-509C/T基因型及等位基因的分布频率与健康对照者无明显差异,故不认为此位点与PNS的遗传易患性有相关关系,与Li等[11]的研究结果一致。
临床分析结果显示:TT基因型的PNS患者24 h尿蛋白及血肌酐水平较CT和CC基因型的患者明显升高,以往研究发现,TGFβ1的转录活性和血浆水平与该基因启动子区-509 C/T基因多态性有关,其中TT型的TGFβ1水平是CC型的近2倍[4]。因此推测TT基因型通过调控TGFβ1 mRNA转录活性,影响TGFβ1蛋白表达量,从而引起肾小球硬化和肾间质纤维化病变,加重蛋白尿,促进肾功能恶化,但CC、CT和TT基因型的PNS患者在年龄、性别构成及血压、血清清蛋白、血脂水平方面无明显差异,提示不同基因型的PNS患者在这些临床表现方面差别不明显。目前这方面研究报道甚少,有待积累更多的临床资料做进一步探讨。
肾小球系膜细胞和系膜基质弥漫增生为系膜增生性肾小球肾炎的病理特征,本研究中病理分析结果显示系膜增生性肾小球肾炎患者TT基因型所占比例较高,CC基因型所占比例较低,提示CC基因型可能有保护性作用,而TT基因型可促进肾小球硬化,TT基因型与肾小球硬化显著相关,可以推测,在肾组织局部分泌TGFβ1机制中,TT基因型可诱导细胞产生更多的TGFβ1,TGFβ1与肾小球固有细胞上相应受体结合,促进细胞增殖,增加ECM蛋白的合成和减少ECM的降解,并增强细胞表面ECM受体-整合素的表达,使细胞与基质黏附增强,促使ECM 沉积。以上作用的综合结果导致肾小球发生系膜增生病理改变。本研究未发现其他4种病理类型患者的基因型分布频率有差异,提示TGFβ1-509C/T基因多态性可能与这些病理改变关系不大。
跟踪随访发现:治疗有效和无效的患者基因型和等位基因的分布频率明显不同,TT基因型和T等位基因的PNS患者治疗有效率低,易于表现为大量蛋白尿、持续性蛋白尿,因而TGFβ1-509C/T基因可作为判断激素疗效的一个遗传学标志。
本研究结果提示:TGFβ1-509C/T基因多态性与PNS的发病易患性不相关,但可能与较重的蛋白尿、肾损害、肾小球硬化、激素疗效相关。
1 Grannde JP.Role of transforming growth factor β in tissue injury andrepair[J].Proc Soc Biol Med,1997,214(1):27-40.
2 Luedecking EK,DeKosky ST,Mehdi H,et al.Analysis of genetic polymorphisms in the ransforming growth factor-beta1 gene and the risk of Alzheimer′s disease[J].Hum Genet,2000,106(5):565-569.
3 Ando T,Okuda S,Tamaki K,et al.Localization of transforming growth factor-beta and latent transforming growth factor-beta binding protein in rat kidney[J].Kidney Int,1995,47(3):733-739.
4 Grainger DJ,Heathcote K,Chiano M,et al.Genetic control of the circulating concentration of transforming growth factor type beta1[J].Hum Mol Genet,1999,8(1):93-97.
5 Stoll C,Mengsteab S,Stoll D,et al.Analysis of polymorphic TGFB1 codons 10,25,and 263 in a German patient group with non-syndromic cleft lip,alveolus,and palate compared with healthy adults[J].BMC Med Genet,2004,22(5):15.
6 Schnaper HW,Hayashida T,Hubchak SC,et al.TGF-beta signal transduction and mesangial cell fibrogenesis[J].Am J Physiol Renal Physiol,2003,284(2):F243-F252.
7 Ziyadeh FN.Mediators of diabetic renal disease:the case for tgf-Beta as the major mediator[J].J Am Soc Nephrol,2004,15(Suppl 1):S55-S57.
8 Lee DY,Kim W,Kang SK,et al.Angiotensin-converting rnzyme gene polymorphism in patients with minimal-change nephrotic syndrome and focal semental glomerulosclerosis[J].Nephron,1997,77(4):471-473.
9 Oda H,Yorioka N,Ueda C,et al.Apolipoprotein E polymorphism and renal disease[J].Kidney Int,1999,71(Suppl):S25-S27.
10 Xu H,Iijima K,Tanaka SSR,et al.Platelet-activating factor acetylhydrolase gene mutation in Japanese nephrotic syndrome[J].Kidney Int,1998,54(6):1867-1871.
11 Li Y,Liu FY,Peng YM,et al.The relationship between the TGF-beta1 gene -509C/T polymorphism and tubulointerstitial damage resulting from primary nephrotic syndrome[J].Ren Fail,2010,32(4):420-427.
