不同类型环氧化酶2抑制剂对椎间盘退变模型大鼠缺氧诱导因子1α和血管内皮生长因子表达的影响研究
2013-04-19朱立新曹延林黄汉清杨连军
朱立新,王 坤,曹延林,黄汉清,杨连军
椎间盘退变在临床上多表现为脊柱节段不稳、椎管狭窄、颈椎病、腰腿痛、椎间盘突出等,是多种脊柱退行性疾病的病理基础和前提,目前其发病机制尚不完全明确,凋亡髓核细胞、椎间盘内蛋白多糖水平降低以及新生血管形成在椎间盘退变过程中发挥着重要作用[1-2]。Zhang等[3]首先在突出的椎间盘组织中发现血管结构;Akeda等[4]研究发现,新生血管形成在椎间盘自发性吸收过程中起重要作用。环氧化酶2(COX-2)和缺氧诱导因子1α(HIF-1α)在新生血管形成过程中发挥着关键性的作用,且HIF-1α在人类椎间盘组织中表达[5]。COX-2和HIF-1α在诱导新生血管形成过程中密切相关[6],体外研究证明,HIF-1α可诱导人内皮细胞COX-2表达,而COX-2表达产物又进一步促进HIF-1α表达。Huang等[7]研究表明,COX-2/前列腺素E2(PGE2)/HIF-1α/血管内皮生长因子(VEGF)是肿瘤血管生成过程中的重要通路。本研究通过建立椎间盘退变大鼠模型,探讨不同类型COX-2抑制剂对椎间盘退变模型大鼠HIF-1α和VEGF表达的影响,旨在为椎间盘退变的治疗提供参考。
1 材料与方法
1.1实验动物及分组选择12月龄SPF级SD大鼠60只,体质量(210±11)g,均购于广州中医药大学实验动物中心。建立椎间盘退变模型后将大鼠放入单独笼中进行饲养,采用简单随机法将大鼠分为4组,每组15只。对照组采用安慰剂10 mg·kg-1·d-1灌胃给药;塞来昔布组采用塞来昔布胶囊(批号:BK110677,大连辉瑞制药有限公司)10 mg·kg-1·d-1灌胃给药;尼美舒利组采用尼美舒利颗粒(批号:110517,海南中瑞康芝制药有限公司)10 mg·kg-1·d-1灌胃给药;双药组采用塞来昔布胶囊5 mg·kg-1·d-1和尼美舒利颗粒5 mg·kg-1·d-1灌胃给药;共饲喂8周。
1.2大鼠椎间盘退变模型建立方法各组大鼠采用6.5%水合氯醛腹腔注射麻醉,取俯卧位,固定四肢,腰背部备皮,消毒铺单,沿腰背部棘突做后正中切口,切开皮肤后沿骨膜下剥离,咬骨钳去除以L3为中心的L1~S1棘突、关节突和棘上、棘间韧带,切断双侧竖棘肌,然后逐层缝合皮下筋膜、皮肤。
1.3观察指标饲喂完成后处死所有大鼠,迅速取出每只大鼠的L2~3、L3~4、L4~5、L5~S1椎间盘。
1.3.1采用SP免疫组化方法检测HIF-1α和VEGF表达情况HIF-1α的检测采用L2~3椎间盘,VEGF采用L3~4椎间盘,分别固定,制成厚度为4 μm的病理切片;烤片,乙醇和二甲苯梯度脱蜡水化,抗原修复,滴加内源性过氧化酶阻断剂,滴加一抗,4 ℃冰箱过夜,滴加二抗,滴加链霉素抗生物素-过氧化酶溶液,二氨基联苯胺显色,苏木素进行复染,烘片、封片。使用已知阳性切片为阳性对照,磷酸盐缓冲液(PBS)代替一抗为阴性对照。HIF-1α兔抗鼠单克隆抗体、兔抗鼠COX-2单克隆抗体均购自美国Epiomics公司。
每组大鼠选取5个高倍不重叠视野进行观察,HIF-1α和VEGF均以胞质、胞核黄染为阳性判断标准。(1)无染色为0,弱染色(浅黄色)为1,中等染色(棕黄色)为2,强染色(黄褐色)为3;(2)阳性细胞计数<5%为0,5%~为1,25%~为2,>50%为3。(1)和(2)两项结果相加等于0为阴性(-),1~为弱阳性(+),3~为阳性(++),5~6为强阳性(+++)。
1.3.2蛋白多糖水平的检测采用L4~5椎间盘,以吸光度值表示。检测方法:将L4~5椎间盘组织研磨成匀浆,置入离心管中,加入3%氢氧化钠溶液5 ml,恒温振荡器中振荡3 h后加入盐酸,调整溶液pH值为8~9,再加入胰蛋白酶酶解2 h。采用间苯三酚法进行蛋白多糖测定。
1.3.3软骨细胞凋亡指数(AI)采用L5~S1椎间盘,脱钙,制成厚度为4 μm的病理切片,采用末端脱氧核苷酸转移酶介导的dUTP 缺口末端标记测定法(TUNEL法)计数椎间盘组织中凋亡细胞数目,每组计数10个400倍视野,计算平均100个细胞中含有的凋亡细胞数目即为AI。凋亡软骨细胞表现为软骨陷窝内细胞核呈棕黄色或棕色,伴或不伴有核染色质边集或浓集、核碎裂、核固缩;非凋亡细胞表现为细胞核蓝染。
2 结果
2.1HIF-1α和VEGF阳性表达情况对照组大鼠HIF-1α和VEGF均呈阴性表达,其他各组均呈阳性表达,表现为胞质、胞核黄染(见图1)。各组大鼠HIF-1α、VEGF阳性表达情况比较,差异均有统计学意义(P<0.05,见表1)。
2.2蛋白多糖水平及AI各组大鼠蛋白多糖水平、AI比较,差异均有统计学意义(P<0.05,见表2)。
表1各组大鼠HIF-1α和VEGF阳性表达情况比较(只)
Table1Comparison of the positive expression of HIF-1α and VEGF in each group
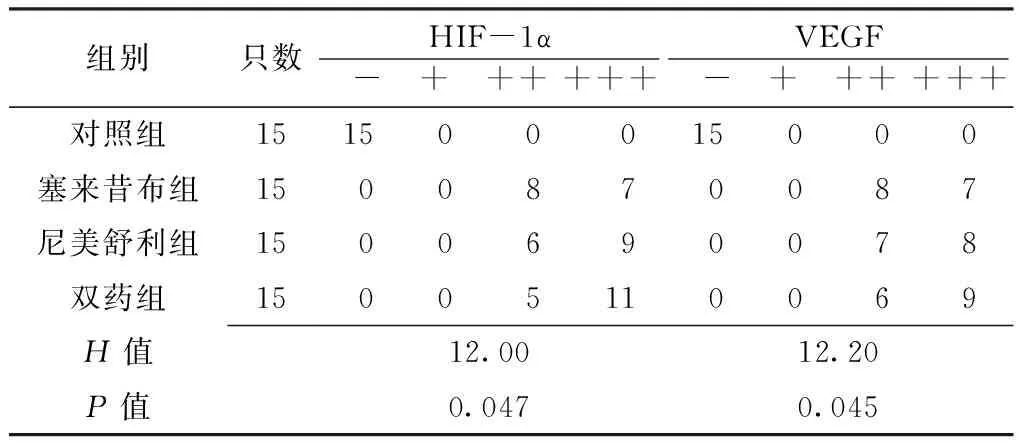
组别只数HIF-1α - + +++++VEGF - + +++++对照组151500 0 15000塞来昔布组15 0 08 7 0 087尼美舒利组15 0 06 9 0 078双药组15 0 0511 0 069H值12.0012.20P值0.0470.045
注:HIF-1α=缺氧诱导因子1α,VEGF=血管内皮生长因子;-表示阴性,+表示弱阳性,++表示阳性,+++表示强阳性
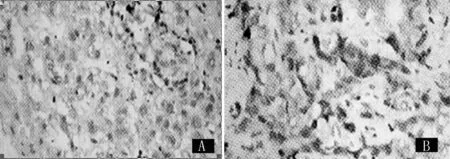
注:A:HIF-1α阳性表达表现为胞质、胞核黄染;B:VEGF阳性表达表现为胞质、胞核黄染
图1 HIF-1α和VEGF阳性表达情况(SP免疫组化,×200)
3 讨论
前列腺类物质是机体炎症反应的始动因子,其被花生四烯酸催化的限速酶是COX-2,而前列腺素类物质引起的炎症反应是椎间盘退变早期出现临床症状的主要原因。研究表明,正常椎间盘组织中前列腺素物质水平明显低于突出椎间盘组织,并具有一定的规律性[8]。Roberts等[9]研究证实,前列腺素类物质可抑制椎间盘组织细胞蛋白多糖的合成,而蛋白多糖水平降低是引起椎间盘发生退变的关键。COX-2可能通过调节前列腺素类物质的生成而影响蛋白多糖水平,进而引起椎间盘发生退变。而且,COX-2与肿瘤的发生、发展及转移密切相关,其可能的作用机制主要有以下几个方面:(1)抑制内皮细胞的凋亡;(2)PGE2等可直接诱导血管生成,促进内皮细胞移位,前列腺素和COX-2在子宫内膜异位症的血管形成中起重要作用[10];(3)增加促血管生成因子如VEGF等的表达,COX-2与VEGF在肿瘤血管形成中有协同效应[11]。曹飞麟等[12]研究表明,COX-2能够调控血管内皮细胞的凋亡;研究表明,COX-2是调节肿瘤新生血管形成,抑制血管内皮细胞凋亡的重要手段[13]。
Ha等[5]通过免疫组化方法证实,突出椎间盘组织中的HIF-1α表达水平明显高于正常椎间盘组织,且HIF-1α的表达与细胞凋亡存在相关性。Zeng等[14]通过在体外正常及缺氧状态下培养椎间盘髓核细胞,证实HIF-1α可通过调节葡萄糖转运蛋白3的表达而影响椎间盘髓核细胞的存活时间及凋亡,在椎间盘退变过程中发挥着重要作用。由于肿瘤组织生长速度快,当其增生的速度超过周围血管的生长速度时,就会使得局部组织严重缺氧,从而诱导HIF-1α的表达。激活的HIF-1α的作用有两方面:一是作用于存在于血管内皮细胞表面的VEGF受体,诱导血管生成增多;二是通过抑制血管内皮细胞的凋亡,促进新生血管的生成[15]。
本研究结果显示,各组大鼠HIF-1α和VEGF表达量间有显著差异,以双药组抑制效果最为明显。表明通过抑制COX-2可有效地抑制HIF-1α和VEGF的表达,可能在延缓椎间盘退变进程中起作用。各组大鼠蛋白多糖水平间有显著差异,以双药组蛋白多糖水平最高,提示不同类型COX-2抑制剂均可以在一定程度上增加椎间盘组织蛋白多糖水平,以联合应用塞来昔布和尼美舒利效果最明显。各组大鼠AI间有显著差异,以双药组AI最小。表明COX-2可调节新生血管形成过程中血管内皮细胞的凋亡。另外,HIF-1α可激活P53基因,通过抑制血管内皮细胞的凋亡使血管生成增多,从而促进新生血管的生成。
综上所述,不同类型COX-2抑制剂塞来昔布和尼美舒利可抑制HIF-1α和VEGF的表达,增加椎间盘组织蛋白多糖水平,降低AI,联合应用效果更明显,可能在椎间盘退变过程中发挥着重要作用。
1李志浩,朱立新,许勇,等.人退变腰椎间盘中HIF-1α和COX-2的表达相关性及其意义[J].颈腰痛杂志,2010,31(1):12-15.
2唐可,张国忠,齐越峰,等.盘内外臭氧联合神经妥乐平椎旁注射对腰椎间盘突出症神经功能的影响[J].疑难病杂志,2011,10(9):670.
3Zhang L,Niu T,Yang SY,et al.The occurrence and regional distribution of DR4 on herniated disc cells:a potential apoptosis pathway in lumbar intervertebral disc[J].Spine,2008,33(4):422-427.
4Akeda K,An HS,Pichika R,et al.The expression of NG2 proteoglycan in the human intervertebral disc[J].Spine,2007,32(3):306-314.
5Ha KY,Koh IJ,Kirpalani PA,et al.The expression of hypoxia inducible factor-1alpha and apoptosis in herniated discs[J].Spine,2006,31(12):1309-1313.
6张国红,陈宋明.冠心病患者缺氧诱导因子-1α与血红素氧化酶-1的相关性研究[J].中国全科医学,2011,14(5):1662.
7Huang SP,Wu MS,Shun CT,et al.Cyclooxygenase-2 increases hypoxia-inducible factor-1 and vascular endothelial growth factor to promote angiogenesis in gastric carcinoma[J].J Biomed Sci,2005,12(1):229-241.
8O′Donnell JL,O′Donnell AL.Prostaglandin E2content in herniated lumbar disc disease[J].Spine,1996,21(14):1653-1656.
9Roberts S,Louise R.Extracellular matrix-induced cyclooxygenase-2 regulates macrophage proteinase expression[J].J Biol Chem,2004,279(21):22039-22046.
10王敏,彭宣荣,朱彦丽.HuR和COX-2蛋白表达与宫颈癌手术预后的关系[J].中国全科医学,2010,13(5):1618.
11Von Rahden BH,Stein HJ,Puhringer F,et al.Coexpression of cyclooxygenases(COX-1,COX-2)and vascular endothelial growth factors(VEGF-A,VEGF-C)in esophageal adenocarcinoma[J].Cancer Res,2005,65(12): 5038-5044.
12曹飞麟,朱敏,谢伯剑,等.COX-2及VEGF在乳腺癌中的表达及临床意义[J].中国肿瘤,2007,16(10):825-827.
13綦惠,赵丹慧,田伟.基质金属蛋白酶与椎间盘退变研究的新进展[J].中国脊柱脊髓损伤杂志,2010,20(1):69-72.
14Zeng Y,Danielson KG,Albert TJ,et al.HIF-1 alpha is a regulator of galectin-3 expression in the intervertebral disc[J].J Bone Miner Res,2007,22(12):1851-1861.
15范大平,陈艳昕,张一梅.非小细胞肺癌中缺氧诱导因子1α、葡萄糖转运蛋白1和Glypican-3的表达及临床意义研究[J].中国全科医学,2010,13(7):2342.
