溶血磷脂酸对心肌细胞缺氧/复氧损伤的保护作用及机制*
2013-04-19杨晋静陈海波王宪云范雪松丛祥凤陈曦
杨晋静 , 陈海波 , 王宪云 , 范雪松 , 丛祥凤 , 陈曦
溶血磷脂酸对心肌细胞缺氧/复氧损伤的保护作用及机制*
杨晋静 , 陈海波 , 王宪云 , 范雪松 , 丛祥凤 , 陈曦
目的:探讨溶血磷脂酸 (LPA)对心肌细胞缺氧 /复氧诱导损伤的保护作用及机制。
溶血磷脂酸;缺氧 /复氧;心肌细胞
(Chinese Circulation Journal, 2013,28:222.)
缺血再灌注损伤常见于急性心肌梗死、冠状动脉旁路移植术、心脏移植,是心血管疾病临床治疗中面临的重要难题。缺血再灌注损伤导致的缺血周边区心肌细胞的凋亡会导致心肌收缩力减低,心功能障碍,严重的甚至发生急性心力衰竭[1,2]。因此,探索防治缺血再灌注损伤的保护药物成为心血管疾病研究领域的热点[3]。
溶血磷脂酸 (LPA)是一种内源性的生物活性脂质分子,通过特异的G蛋白耦联受体调节广泛的生物学功能[4]。本研究组以前发现心肌梗死患者血清LPA 水平显著升高[5],并指出 LPA 可能通过促进心肌细胞肥大及成纤维细胞增殖参与了心肌梗死后的心 室重 塑[6,7]。Liu 等[8]还 发 现 LPA 能 显 著 抑 制 无血清缺氧诱导的骨髓间充质干细胞凋亡。国外报道LPA 对缺血或缺血再灌注诱导的器官或细胞损伤也具有保护作用[9,10]。因此,推测 LPA 可能对缺血再灌注导致的心肌细胞损伤具有保护作用。本文以缺氧复氧诱导的 H9c2 心肌细胞为模型,模拟心肌缺血再灌注损伤,研究 LPA 对 H9c2 心肌细胞缺氧 /复氧损伤的影响及机制。
1 材料与方法
试剂:H9c2 心肌细胞株购自中国医学科学院细 胞 库。DMEM 培 养 液 和 胎 牛 血 清 购 自 美 国 Life Technologies公司;抗甘油醛 -3- 磷酸脱氢酶 (GAPDH)抗 体 购 自 美 国 Sigma 公 司;缺 氧 催 化 剂 购 自法 国BioMerieux 公 司;Hoechst33342 购 自 中杉金 桥 公司;LPA3 受 体 特 异 激 动 剂 OMPT(1-oleoyl-2-Omethylrac-glycero-phosphothionate)和 LPA 购 自 美 国 Avanti公司;细胞活性检测 (MTS)试剂盒和半胱氨酸天冬氨酸蛋白酶 -3/7(Caspase 3/7)活性检测试剂盒购自美 国 Promega 公 司;抗 Caspase-3 抗 体, 抗 cleavedcaspase-3 抗体,抗 Bcl-2 抗体和抗 Bax 抗体均购自美国 Cell Signaling Technologies 公司。
细胞培养及实验分组:本实验开始于 2012-09 到2013-01 结束。原代 SD 乳鼠心肌细胞的分离培养按照本实验室以前建立的方法进行[7]。取出生后 1~3 天的 SD 乳鼠心脏,用 0.08% 胰酶消化分离,差速贴壁培养 1 h 弃除成纤维细胞,将心肌细胞在含 10% 胎牛血清(FBS)和 100 μM Brdu 的 DMEM 中培养。而H9c2 心肌细胞株在含 10% 胎牛血清 DMEM 培养基,37℃和 5% CO2条件下培养。2~3 天传代 1 次。心肌细胞融合达到 70%~80% 时随机分组: 对照组:细胞置于 95% 空气,5%CO2,持续培养 24 h,不加任何处理;缺氧 /复氧 (H/R)组:换无血清 DMEM 培养液,将细胞迅速放入密闭缺氧罐中,缺氧 24 h 后,换含 10%胎牛血清的 DMEM 培养液常氧条件下培养 3 h; LPA预处理 (H/R+LPA) 组和 LPA3 受体特异激动剂(OMPT)预处理(H/R+OMPT)组:细胞用不同浓度 LPA (1, 10, 25 μΜ) 或 OMPT(1,5,10 μM) 处理 1 h,然后进行缺氧 /复氧处理,缺氧过程中 LPA 或 OMPT持续存在,复氧过程中不加 LPA 和 OMPT。
台盼蓝染色:0.4% 的台盼蓝与细胞悬液以 1:1混匀,在 3 min 内用血球计数板在显微镜下分别计数活细胞数和死细胞数:
活细胞数 ( % ) = [活细胞总数 / ( 活细胞总数 +死细胞总数 ) ]× 100%
细胞活性检测:细胞按 1× 104个 /孔接种于 96孔板中,每孔 100 μl。实验结束后,直接加入 MTS反应液 20 μl/孔,继续在 5%CO2,37℃培养箱中培养 2 h,然后迅速用酶标仪在 490 nm 波长处检测吸光度值。不加细胞的培养基作为空白对照,实验结果以细胞存活率表示。
Caspase-3/7 活性检测:Caspase-3/7 活性测定采用 Caspase-3/7 活性分析试剂盒。细胞计数后,将细胞悬液调整到 4×104个细胞 /mL,在不透明的白色 96 孔板的待测各孔添加 50 μl细胞 Caspase-3/7缓冲液和 Caspase-3/7 底物混合液,室温,孵育 2 h,孵育后的样品板放入 VeritasTM 发光检测仪检测。
免疫印迹检测:实验处理完成的心肌细胞,收集 总 蛋 白, 冰 上 裂 解 30 min [1%TritonX-100, 20 mmol/L HEPES, 5 mmol/L MgCl2, 1 mmol/L 乙 二 胺四乙酸 , 1 mmol/L 乙二醇 - 双 -(2- 氨基乙醚 )四乙酸 , 1 mmol/L 二硫苏 糖醇 , 1 mmol/L 苯 甲基磺 酰氟 , 1 mmol/L Na3VO4, 10 μg/ml leupeptin, 10μg/ml aprotinin, 10μg/ml pepstatin]。 测 蛋 白 浓 度, 取 30 μg 蛋白, 进行 4%~10%SDS-PAGE 凝胶电 泳后,转移到硝酸纤维素膜,用含 5% 的脱脂牛奶的 TBST封闭 1 h,一抗 4℃孵育过夜,次日洗膜,辣根过氧化物酶标记的二抗室温孵育 1 h, 然后压片显影。
流式细胞术检测:细胞经胰酶消化,800 rpm,4℃,离心 6 min,PBS 洗 1~2 次,每个样品加入 200 μl binding buffer 和 10 μl Annevin V, 避 光 反 应 30 min,加入 300 μl binding buffer 和 10 μl PI,5 min 内流式细胞仪检测。活细胞、早期凋亡细胞、晚期凋亡细胞及坏死细胞分别标记为 Annevin V-/PI-,Annevin V+/PI-,Annevin V+/PI+, Annevin V-/PI+。
统计学处理:所有数据均以均数±标准差表示,多组间均数比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
LPA 抑制缺氧 /复氧诱导的 H9c2 心肌细胞损伤结果:H9c2 心肌细胞台盼蓝染色和 MTS 检测存活率结果显示:H/R 组 H9c2 心肌活细胞数和 H9c2 心肌细胞存活 率较对照组明 显减低 (P 均 <0.05),H/R + LPA 组 H9c2 心肌活细胞数和 H9c2 心肌细胞存活率(25 μM 浓度除外 )与 H/R 组相比均显著提高(P均 <0.05),图1A、1B)。另外 MTS 检测原代乳鼠心肌细胞存活率结果显示:H/R 组原代乳鼠心肌细胞存活率 较对 照组 下降 (P<0.05), H/R+LPA 10 μM 组 原代乳鼠心肌细胞存活率较 H/R 组明显提高 (P<0.05,图1C)。流式细胞术检测 H9c2 心肌细胞凋亡结果显示:H/R 组早期 H9c2 心肌凋亡细胞比例较对照组显著 增 加 (P<0.05),H/R+LPA 组 10 μM 早 期 H9c2 心肌凋亡细胞比例较 H/R 组显著降低 (P<0.05,图2)。
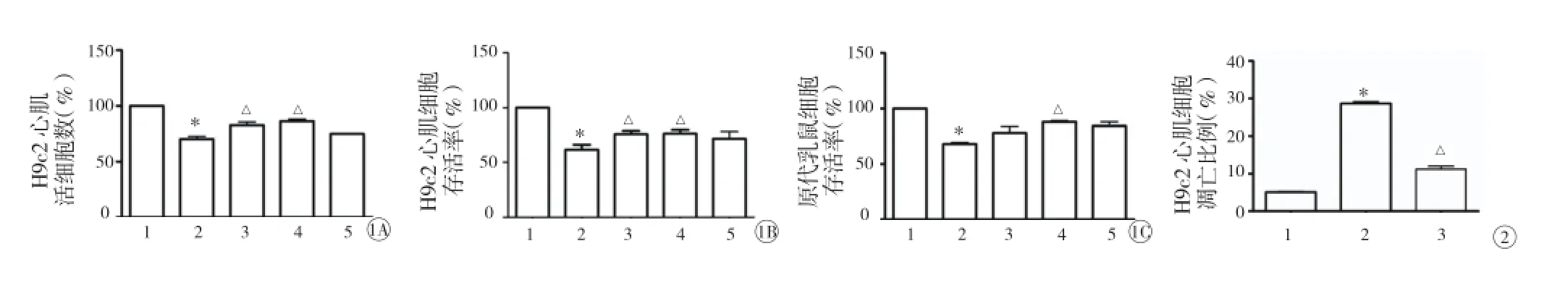
图1 溶血磷脂酸抑制缺氧 /复氧诱导的 H9c2 心肌细胞损伤。 1A: 台盼蓝染色计数 H9c2 心肌细胞活细胞数 1B: MTS 检测 H9c2 心肌细胞存活率1C:MTS 检测原代乳鼠心肌细胞存活率 1:对照组 2:缺氧/复氧组 3:缺氧/复氧+ LPA1μM 4:缺氧/复氧+ LPA10μM 5:缺氧/复氧+ LPA25μM。与对照组相比*P<0.05 与缺氧 /复氧组相比△P<0.05 图2 流式细胞术检测 H9c2 心肌细胞早期凋亡比例图。 与对照组相比*P<0.05;与缺氧 /复氧组相比△P<0.05。1:对照组 2:缺氧 /复氧组 3:缺氧 /复氧 +LPA10 μM
LPA 通过调节线粒体凋亡途径抑制缺氧 /复氧诱导的 H9c2 心肌细胞损伤:Caspase-3/7 活性检测结果显示: H/R 组 Caspase-3/7 活性较对照组明显增加 (P<0.05)。H/R+LPA 组 两 个 浓 度 (LPA 1,10 μM) H9c2 心肌细胞的 Caspase-3/7 活性较 H/R 组显著降低 (P<0.05,图3)。免疫印迹检测结果显示:H/R组较对照组心肌细胞裂解的 Caspase-3 的蛋白表达水平明显增高(P<0.05)。H/R+LPA 组 10 μM 浓度的心肌细胞裂解的 Caspase-3 的蛋白表达水平较 H/R组明显降低 (P<0.05,图4)。
LPA3 受体激活调节线粒体凋亡蛋白抑制缺氧 /复氧诱导的 H9c2 心肌细胞损伤:由于缺乏 LPA 受体特异的抑制剂,本研究用 OMPT 研究介导 LPA 抗缺氧 /复氧诱导 H9c2 心肌细胞损伤的受体亚型。结果显示:H/R+OMPT 组三个浓度较 H/R 组线粒体促凋亡Bax 蛋白表达都减少,线粒体抗凋亡 Bcl-2 蛋白表达都增加 (P<0.05~0.01),差异均有统计学意义 (图5)。

图3 LPA 对缺氧 /复氧诱 导 的 H9c2 心 肌 细 胞Caspase-3/7 活性的影响。与 对 照 组 相 比*P<0.05;与 缺 氧 /复 氧组 相 比△P<0.05。余注见图1 图4 免疫印迹检测 LPA 对缺氧 /复氧诱导的 H9c2 心肌 细 胞 裂 解 的 Caspase-3蛋 白 的 影响。4A:免 疫印 迹 检 测 Caspase-3 前体 和 裂 解 的 Caspase-3的 蛋 白 水 平。4B:Cl.caspase-3 相对 表达量柱 状 图 LPA:溶 血 磷 脂酸 Procaspase-3: Caspase-3前 体 Cl.caspase-3:裂 解的 Caspase-3。 与 对 照 组相 比*P<0.05;与 缺 氧 / 复氧组相比△P<0.05。 1:对照组 2:缺氧/复氧组 3:缺氧/复氧+LPA1μM 4:缺氧/复氧+ LPA5μM 5:缺氧/复氧+ LPA10μM

图5 OMPT 对缺氧 /复氧诱导的 H9c2 心肌细胞线粒体凋亡蛋白 Bcl-2 和 Bax的影响。5A:免疫印迹检测 Bax 蛋 白、Bcl-2 蛋 白水 平 5B:Bax 蛋 白 表 达水 平 柱 状 图 5C: Bcl-2蛋白表达水平柱状图 与对照 组 相比*P<0.05;与 缺氧 /复 氧 组 相 比△P<0.05△△P<0.01。 OMPT:LPA3受体激动 剂 GAPDH:甘油醛-3- 磷酸脱氢酶。1:对照组 2:缺氧/复氧组 3:缺氧/复氧+OMPT1μM 4:缺氧/复氧+OMPT5μM 5:缺氧/复氧+ OMPT10μM
3 讨论
溶血磷脂酸是一种内源性的生物活性脂质分子,主要来源于血液中应激的血小板[11]。LPA 通过 G 蛋白耦联受体调节广泛的细胞学功能。本课题组早期的研究发现心肌梗死患者血清中 LPA 水平显著升高[5]。并在动物实验研究中指出:早期重塑过程中,LPA3 受体表达明显上调,并且LPA 可以通过LPA3 受体介导的信号促进心肌细胞肥大以及成纤维细胞的增殖[6,7],表明LPA-LPA3信号可能在心肌梗死后的心室重塑中扮演着重要角色。同时我们还发现LPA显著减少无血清缺氧诱导的骨髓间充质干细胞凋亡。本研究首次报道LPA信号在缺血再灌注诱导的心肌细胞损伤中的保护作用。我们发现缺氧 /复氧导致 H9c2 和原代乳鼠心肌细胞出现明显的损伤,细胞存活率明显降低。而LPA预处理后,明显减少了缺氧/复氧诱导的心肌细胞损伤,提高细胞存活率,并减少早期凋亡细胞数。线粒体是调节细胞凋亡的中心。抗凋亡 Bcl-2 和促凋亡 Bax 是线粒体凋亡途径中两个关键的基因。前者通过调节线粒体细胞色素 C 的释放抑制凋亡执行者 caspase-3 激活,而后者调节细胞色素 C 释放后则激活 caspase-3。本研究发现缺氧 /复氧诱导的 H9c2 心肌细胞具有活性的 Caspase-3 和裂解的 Caspase-3 蛋白表达,明显被 LPA 预处理抑制,提示LPA通过调节线粒体凋亡途径发挥其保护作用。重要的是,LPA3受体激动剂OMPT预处理明显抑制缺氧 /复氧诱导的 H9c2 心肌细胞 Bax的蛋白表达,并提高了 Bcl-2 的蛋白表达,表明 LPA3 受体的激活参与了LPA在心肌细胞缺氧/复氧损伤中的保护作用,同时表明 LPA 的确通过抑制线粒体凋亡途径,抗缺氧复氧诱导的 H9c2 心肌细胞损伤。 LPA3 受体激动剂 OMPT 预处理明显提高了 Bcl-2/Bax 比值,表明 LPA3 受体的激活可能通过抑制线粒体凋亡途径,从而抗缺氧复氧诱导的H9c2心肌细胞损伤。原代心肌细胞培养过程复杂,耗时,耗力,同时贴壁性强,不适合进行流式细胞凋亡检测,胚胎心肌细胞 H9c2 已成为代替原代心肌细胞进行缺氧或缺氧/复氧实验研究的一种广泛使用的心肌细胞株。同时我们在原代乳鼠心肌细胞的细胞活力检测中发现LPA的确提高缺氧复氧诱导的原代乳鼠心肌细胞存活率,这一结果有力的支持了LPA在缺氧/复氧诱导的心肌细胞损伤中的保护作用。作为磷脂类分子的代表之一,LPA 分子小,结构简单,易透过细胞膜 , 这些特性赋予其将来作为小分子药物的可能。特别需要指出的是,与LPA 类似的脂质分子-1-磷酸鞘氨醇 (SIP)治疗多发性硬化疾病,已经进入临床Ⅲ期试验,这提示磷脂类分子可能是一种具有应用前景的新型治疗药物。我们的研究仅在细胞水平探讨了LPA对心肌细胞缺氧复氧损伤的保护作用,进一步的整体动物实验在将来的研究需要证实。
[1]Sabbah HN. Apoptotic cell death in heart failure. Cardiovasc Res ,2000,45:704-712.
[2]赵亚玲 ,敖虎山 . 心肌缺血再灌注损伤的研究进展 .中国循环杂志 ,2011, 5:396-398.
[3]张昱 ,程卫平 . 硫化氢对乳鼠心肌细胞缺氧—复氧损伤的保护作用 . 中国循环杂志 ,2009, 3:227-230.
[4]Mutoh T, Rivera R, Chun J. Insights into the pharmacological relevance of lysophospholipid receptors. Br J Pharmacol, 2012, 165:829-844.
[5]Chen X, Yang XY, Wang ND, et al. Serum lysophosphatidic acid concentrations measured by dot immunogold filtration assay in patients with acute myocardial infarction. Scandinavian Journal of Clinical & Laboratory Investigation, 2003,63:497-504.
[6]Chen J, Han Y, Zhu W, et al. Specific receptor subtype mediation of lpa-induced dual effects in cardiac fibroblasts. FEBS Lett ,2006,580:4737-4745.
[7]Chen J, Chen Y, Zhu W, et al. Specific lpa receptor subtype mediation of lpa-induced hypertrophy of cardiac myocytes and involvement of akt and nfκb signal pathways. Journal of Cellular Biochemistry,2008,103:1718-1731.
[8]Liu X, Hou J, Shi L, et al. Lysophosphatidic acid protects mesenchymal stem cells against ischemia-induced apoptosis in vivo. Stem Cells Dev, 2009,18:947-954.
[9]Gao J, Zhang D, Yang X, et al. Lysophosphatidic acid and lovastatin might protect kidney in renal i/r injury by downregulating mcp-1 in rat. Renal Failure, 2011,33:805-810.
[10]Savitz SI, Dhallu MS, Malhotra S, et al. Edg receptors as a potential therapeutic target in retinal ischemia reperfusion injury. Brain Research, 2006,1118:168-175.
[11]Aoki J. Two pathways for lysophosphatidic acid production. Biochimica et Biophysica Acta (BBA) - Molecular and Cell Biology of Lipids,2008,1781:513-518.
The Protective Role With its Mechanism of Lysophosphatidic Acid on Hypoxia/Re-Oxygenation Induced Neonatal Rat’s H9c2 Cardiomyocyte Injury
YANG Jin-jing, CHEN Hai-bo, WANG Xian-yun, FAN Xue-song, CONG Xiang-feng, CHEN Xi.
State Key Laboratory of Cardiovascular Disease, Cardiovascular Institute and Fu Wai Hospital, CAMS and PUMC, Beijing (100037), China
Corresponding Author: CHEN Xi, Email: chenxifw@126.com
Objectives: To investigate the protective role with its mechanism of lysophosphatidic acid (LPA) on hypoxia/reoxygenation (H/R) induced neonatal rat’s H9c2 cardiomyocyte injury.Methods: The H/R model of neonatal rat’s H9c2 cardiomyocyte was established and the experiment was divided into 4 groups. Control group, with normal H9c2 cell. H/R group, no FBS cultured H9c2 cell was incubated in hypoxia condition for 24 hours and then cultured in 10% FBS-DMEM with routine oxygen concentration for 3 hours. H/R+LPA group and H/R+OMPT (LPA3 receptor agonist) group, the cells were treated by either LPA at (1, 10, 25)μM or OMPT at(1, 5, 10)μM for 1 hour respectively, then the cells received H/R procedures. The cell viability was examined by trypan blue staining, cell caspase-3/7 activity was detected with the commercial kit, cell apoptosis was measured by flow cytometry, and apoptotic proteins were analyzed by western blot analysis.Results: Compared with Control group, H/R group had decreased cell viability and increased early stage cell apoptosis, P<0.05 respectively. Compared with H/R group, H/R+LPA group showed increased cell viability, P<0.05, and LPA 10μM was the best, in addition, LPA (1, 25)μM treated cells had decreased caspase-3/7 activity, P<0.05. Comparedwith H/R group, H/R+OMPT group presented reduced Bax protein expression and elevated Bcl-2 protein expression, P<0.05 or P<0.01.Conclusion: LPA may protect H/R induced neonatal rat’s H9c2 cardiomyocyte injury by activating LPA3 receptor and suppressing the mitochondrial apoptotic pathway.
Lysophosphatidic acid; Hypoxia/Re-oxygenation; Cardiomyocytes
2013-01-14)
(编辑:常文静 )
国家重点基础研究发展计划 (973 计划 2010CB529500) 国家自然科学基金资助项目 (81170154)
100037 北京市,北京协和医学院 中国医学科学院 阜外心血管病医院 心血管疾病国家重点实验室
杨晋静 博士研究生 主要研究方向为磷脂分子及其信号调控 Email:imyangjj@163.com 通讯作者:陈曦 Email:chenxifw@126.com
R54
A
1000-3614(2013)03-0222-04
10.3969/j.issn.1000-3614.2013.03.018
方法:建立 H9c2 心肌细胞和原代乳鼠心肌细胞缺氧 /复氧模型。实验分组 : 对照组:不做任何处理; 缺氧 /复氧组 (H/R 组 ):无血清培养的细胞在缺氧罐中缺氧 24 h 后,换含 10% 胎牛血清的 DMEM 培养液在常氧条件下培养 3 h;LPA 预处理组 (H/R+LPA 组 )和 LPA3 受体特异激动剂(OMPT)预处理组 (H/R+OMPT 组 ):细胞分别用 LPA(1,10,25 μM) 和 OMPT(1,5,10 μM) 处理 1 h 后,进行缺氧 /复氧,复氧时不加 LPA 和 OMPT。台盼蓝染色和细胞活性试剂盒检测细胞活力。流式细胞术检测凋亡细胞,Caspase-3/7 活性检测试剂盒分析 Caspase-3/7 活性,免疫印迹检测凋亡相关蛋白包括裂解的 Caspase-3,Bcl-2 和 Bax 蛋白表达。
结果:与对照组相比,H/R 组的 H9c2 心肌细胞的活细胞数和细胞存活率均降低 (P 均 <0.05);早期凋亡细胞数增加 (P<0.05)。与 H/R 组相比,H/R+LPA 组的心肌细胞活细胞数和细胞存活率增加 (P 均 <0.05),其中以 10 μM 浓度的 LPA 作用最为明显。10 μM LPA 也提高了原代乳鼠心肌细胞存活率 (P<0.05)。H/R+LPA 组两个浓度 (LPA 1,10 μM) H9c2 心肌细胞的 Caspase-3/7 活性较 H/R 组显著降低 (P<0.05)。同时,H/R+OMPT 组三个浓度较 H/R 组都减少线粒体促凋亡 Bax 蛋白表达,增加了线粒体抗凋亡 Bcl-2 蛋白表达 (P<0.05 或 0.01)。
结论:LPA 可能通过激活 LPA3 受体,抑制线粒体依赖的细胞凋亡途径,保护缺氧 /复氧诱导的心肌细胞损伤 ,为心肌缺血再灌注损伤的防治提供了新的理论依据。
