神经激肽1受体拮抗剂对大鼠脑缺血再灌注的神经保护作用
2013-04-18封菲王晓楠章顺荣丁美萍高越
封菲 王晓楠 章顺荣 丁美萍 高越
神经激肽1受体拮抗剂对大鼠脑缺血再灌注的神经保护作用
封菲 王晓楠 章顺荣 丁美萍 高越
目的 观察大鼠局灶性脑缺血再灌注后神经激肽1受体拮抗剂对脑梗死体积、脑组织含水量及神经行为学变化的影响,探讨减轻神经源性炎症反应对脑缺血再灌注的保护作用。 方法 将54只大鼠分为药物组、假手术组、对照组,用线栓法建立右侧大脑中动脉缺血再灌注大鼠模型,药物组和对照组大鼠在再灌注时经尾静脉分别注入神经激肽1受体拮抗剂及生理盐水,假手术组只分离右侧颈总、颈内、颈外动脉。缺血再灌注后24h时采用免疫组化法检测P物质表达,氯化三苯基四氮唑染色法测定脑梗死体积,干-湿称重法检测脑组织含水量;分别于再灌注24h及72h时利用转棒试验和肢体不对称试验检测神经行为学变化。 结果脑缺血再灌注后24h大鼠脑缺血区P物质的表达明显升高,脑组织含水量明显增加。药物组与对照组比较,脑组织含水量减少,神经功能改善。 结论 神经激肽1受体拮抗剂可通过抑制神经源性炎症反应而达到缺血再灌注损伤时的脑保护作用。
【关键词】缺血再灌注 P物质 脑水肿 神经源性炎症反应
缺血性脑卒中患者的预后与脑水肿是否形成密切相关,现已证实外周组织水肿形成与神经肽物质释放引起血管通透性增加密切相关[1],这一炎症过程称之为神经源性炎症,其主要特点为血管扩张和血浆蛋白外渗[2]。在神经肽物质中目前认为P物质(substance P,SP)是神经源性炎症反应的始动因素并起到最关键的作用[3]。SP受体中神经激肽1受体具有更高的亲和性,关于在急性中枢神经系统损害时应用神经激肽1受体拮抗剂的研究很少。本研究拟通过检测大鼠脑缺血再灌注后缺血半暗带神经源性炎症反应相关免疫指标SP的表达变化、脑水肿程度、脑梗死体积及神经功能的改变,探索神经激肽1受体拮抗剂在缺血再灌注损伤中的保护作用。
1 材料和方法
1.1 动物模型制备及处理 成年健康雄性Sprague-Dawley大鼠54只(体重250~300g,清洁度Ⅱ级,浙江省医学科学院动物中心提供),随机分为药物组、假手术组及对照组3组,每组18只。每组再分为3亚组(每亚组6只),分别用于检测大鼠脑缺血再灌注24h脑组织SP的表达及脑梗死体积、再灌注24h神经行为学评估及脑组织含水量和再灌注72h神经行为学评估。用10%水合氯醛300mg/kg腹腔注射麻醉后,按照Bederson等的方法制作线栓法大鼠脑缺血再灌注模型,手术前后大鼠肛温维持(37.0±0.5)℃。缺血90min后抽提栓线至颈外动脉残端内进行再灌注。药物组大鼠于再灌注时立即尾静脉给予神经激肽1受体拮抗剂N-乙酰-L-半月光氨酸(25μmol/kg)[4]。假手术组大鼠手术时只分离右侧颈总、颈内及颈外动脉,不插入栓线,并于再灌注时予1ml 0.9%氯化钠注射液。
1.2 试剂和仪器 神经激肽1受体拮抗剂(国准字号H20053574)购自天津天安药业股份有限公司,兔抗鼠SP多克隆抗体购自美国Sigma公司,SP免疫组化试剂盒及DAB显色系统购自北京中杉金桥生物技术公司,氯化三苯基四氮唑购自中国医药上海化学试剂公司,Olympus-CH2显微镜购自日本Olympus光学工业株式会社,Rotarod仪由香港中文大学器械服务公司提供。
1.3 免疫组化技术检测SP的分布 大鼠脑缺血再灌注24h时取脑连续冠状切片得第4脑片(厚2.0mm),常规脱水、透明、浸蜡、包埋、用切片机连续5μm厚冠状切片。石蜡切片经常规脱蜡、水化、煮沸法修复,过氧化氢阻断,滴加一抗(工作浓度1∶1 000),根据免疫组化试剂盒说明书对切片标本进行操作,予DAB显色,自来水冲洗后苏木素复染,脱水、封片,表达SP处在光镜下为棕黄色物质。
1.4 脑梗死体积测定 各组大鼠于再灌注24h用200ml0.9%氯化钠注射液经心脏灌流后快速断头取脑,去除嗅球和脑干,连续冠状切片(厚2.0mm)。取第4脑片转入-80℃冰箱保存用于免疫组化,其余脑片放入0.5%的氯化三苯基四氮唑溶液,37℃孵育箱中孵育30min后,多聚甲醛固定24h。摄片后采用Medbrain 2.0处理系统(浙江大学医学院神经生物学实验室提供),计算每一脑片正常侧及缺血侧脑半球红染(未缺血)的面积,两者相减得到矫正后的缺血面积。面积乘以厚度,并迭加每片数据后得到脑梗死灶体积百分比,采用单盲法。
1.5 脑组织含水量测定 利用干湿称重法。大鼠快速断头取脑,取右侧大脑半球用电子天平获取湿重,置入100℃恒温干燥箱内48h再获取干重,脑组织含水量(%)=(湿重-干重)/湿重×100%。
1.6 神经行为学评估
1.6.1 转棒试验 将各组大鼠于时间观察点放于Rotarod仪上,Rotarod的转速在5min之内匀速增加到40r/ min,若大鼠从Rotarod仪上落下,或紧抓于Rotarod上连续2圈不作运动则实验结束,记录大鼠在Rotarod上运动的时间,一旦大鼠从Rotarod仪上落下,下面的电刺激器将给大鼠电刺激促使大鼠尽最大能力在Rotarod仪上运动。手术前3d开始训练大鼠,手术前1 d对每只大鼠进行3次测试,取最长持续时间为基线。观察点对每只大鼠进行3次测试,取其最长持续时间与正常基线值的百分比作为反映大鼠运动功能的指标。
1.6.2 肢体不对称试验 正常大鼠在玻璃圆桶中会不时站立,用双侧前肢交替或同时触及桶壁,应用双侧前肢的频率应该相等,有缺血性脑损伤的大鼠偏瘫侧肢体应用较少。观察并记录双侧前肢的应用情况,对每只大鼠每次记录20次活动,以肢体应用的百分率计算最后得分,得分=(R-L)/(R+L+B)×100%[R:右侧前肢(健侧)独立应用次数;L:左侧前肢(患侧)独立应用次数;B:双前肢同时应用次数]。
1.7 统计学处理 采用SPSS 11.0统计软件,计量资料以表示,组间比较采用单因素方差分析,显示方差齐性的资料进一步采用SNK检验作两两比较,若方差不齐用Dunnett’s检验。
2 结果
2.1 免疫组化检测 假手术组及对照组的未缺血侧大脑半球基本未见阳性细胞,而对照组的右侧大脑半球皮质缺血区可见胞质呈棕黄色的SP免疫阳性细胞,在半暗带区域及血管周围尤其明显。
2.2 大鼠脑梗死体积及脑组织含水量测定 药物组及对照组大鼠脑梗死体积较假手术组明显增加,药物组与对照组比较,梗死体积差异无统计学意义(P>0.05)。假手术组大鼠脑梗死体积和脑组织含水量均较对照组减少,药物组与对照组比较脑组织含水量减少(P<0.05),见表1。
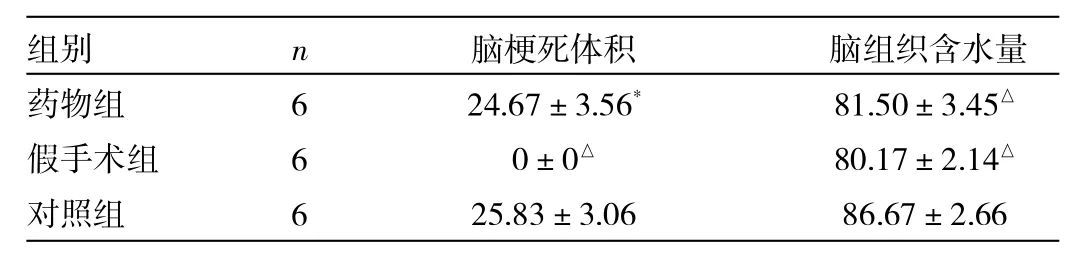
表1 3组大鼠缺血再灌注后24h脑梗死体积和脑组织含水量的比较(%)
2.3 神经行为学评估 转棒试验和肢体不对称试验结果均提示假手术组较对照组神经行为功能明显改善(P<0.05),提示脑缺血再灌注造成大鼠神经行为功能显著损害;药物组与对照组比较,大鼠神经行为功能明显改善(P<0.05),见表2。
3 讨论
在本实验中我们发现大鼠脑缺血再灌注后缺血半暗带区域SP免疫活性明显增高,提示神经源性炎症反应在脑缺血中起作用,通过使用神经激肽1受体拮抗剂抑制神经源性炎症反应使损伤大鼠脑组织含水量有所减少,神经行为学功能得到改善,但脑梗死体积无明显减小。
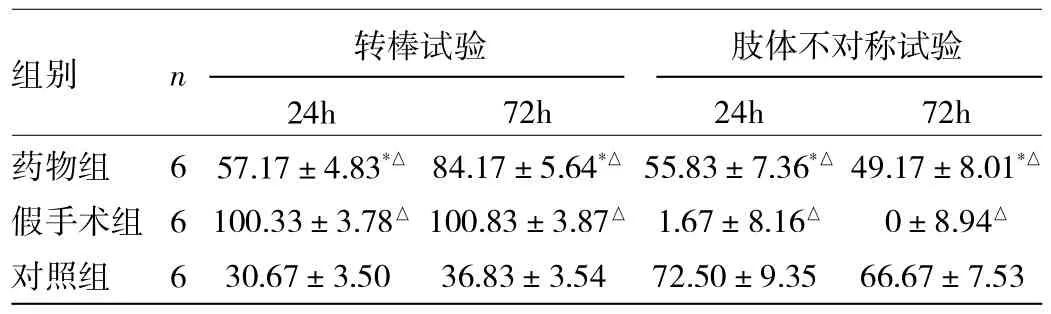
表2 3组大鼠缺血再灌注后转棒试验和肢体不对称试验结果的比较(%)
本实验发现脑缺血再灌注24h后SP在脑组织缺血半暗带区域活性明显增高,在血管周围尤其明显。急性神经系统损伤中关于神经肽的报道较少,局限于周围神经系统损伤、脊髓损伤、脑缺血及脑外伤等。Donkin等[4]证实创伤性脑损伤后神经源性炎症的主要标志物SP在损伤组织周围表达增多,并且与血脑屏障损害、脑水肿及神经功能损害显著相关。Turner等[5]证实大鼠脑缺血再灌注24h时血管周围组织、神经胶质组织、缺血半暗带等区域SP免疫活性增加且其表达程度较梗死中心区明显,而SP活性增加与脑水肿形成显著相关,提示在脑梗死中神经源性炎症与脑水肿相关。一项创伤性脑损伤人群试验发现1周内死亡的患者经过神经病理学检查证实患者皮质中微血管P物质免疫活性提高,血管周边神经元损伤后产生局部神经肽释放继而血管通透性增加导致水肿[6]。另外在脑梗死、短暂性脑缺血发作及脑外伤人群中均有发现其血清SP水平增高的报道。也有研究证实脑组织SP活性增高但仅发生于可逆性缺血而非永久性缺血,提示再灌注损伤在引发神经源性炎症反应的必要性[7]。
本实验发现神经激肽1受体拮抗剂使脑缺血再灌注后24h脑组织含水量减少,证实了SP介导的神经源性炎症反应和血管源性水肿在脑缺血后脑水肿形成中的作用。Donkin等[4]首次证实了神经激肽1受体拮抗剂可减轻大鼠创伤性脑损伤后血脑屏障通透性和脑水肿形成,并减轻神经功能损害。Turner等[8]证实在短暂性脑缺血再灌注试验中神经激肽1受体拮抗剂减轻了再灌注24h时脑水肿程度。除了使用神经激肽1受体拮抗剂,有学者证实可利用神经肽清除的方法显著减轻创伤后早期血脑通透性[9],也推断血管源性水肿是细胞毒性水肿的前提。因此我们猜想抑制神经源性炎症反应可成为治疗梗死后脑水肿的新途径。
本实验利用转棒试验及肢体不对称试验评估大鼠脑缺血后神经行为学,发现改善了脑缺血再灌注后神经功能损伤,但脑梗死体积无明显减少,提示梗死体积并非决定脑梗死后神经功能的唯一因素,而神经突触的可塑性与连接性对提高有效神经功能具有重要意义,神经激肽1受体拮抗剂是否有该作用有待进一步考证。
[1]Black P H.Stress and the inflammatory response:a review of neurogenic inflammation[J].Brain Behav Immun,2002,16(6): 622-653.
[2]Severini C,Improta G,Falconieri-Erspamer G,et al.The tachykinin peptide family[J].Pharmacol Rev,2002,54(2):285-322.
[3]Gartshore G,Patterson J,Macrae I M.Influence of ischemia and reperfusion on the course ofbrain tissue swelling and blood-brain barrier permeability in a rodent model of transient focal cerebral ischemia[J].Exp Neurol,1997,147(2):353-360.
[4]Donkin J J,Nimmo A J,CernakI,et al.Acritical role for substance P in the development of traumatic brain edema[J].J Cereb Blood Flow Metab,2009(8):1388-1398.
[5]Turner R J,Blumbergs P C,Sims N R,et al.Increased substance P immunoreactivity and oedema formation following reversible ischemic stroke[J].ActaNeurochir,2006,Suppl,96:263-266.
[6]Zacest A C,Vink R,Manavis J,et al.Substance P immunoreactivity increases following human traumatic brain injury[J].Acta Neurochir,2010,Suppl,106:211-216.
[7]Fu D,Ng Y K,Gan P,et al.Permanent occlusion of the middle cerebral artery upregulates expression of cytokines and neuronal nitric oxide synthase in the spinal cord and urinary bladder in the adult rat[J].Neuroscience,2004,125(4):819-831.
[8]Turner R J,Vink R.Inhibition of neurogenic inflammation as a novel treatment for ischaemic stroke[J].Drug NewsPerspect,2007, 20(4):221-226.
[9]Nimmo A J,Cernak I,Heath D L,et al.Neurogenic inflammation is associated with development of edema and functional deficits following traumatic brain injury in rats[J].Neuropeptides,2004, 38(1):40-47.
Neuroprotective effects of neurokinin1 receptor antagonist on cerebral ischemia-reperfusion in rats

Objective To investigate the neuroprotective effects of neurokinin1 receptor antagonist on cerebral ischemia-reperfusion in rats.Methods Fifty four rats were randomly assigned to medication group,sham-operation group and control group with 18 animals in each group.Cerebral ischemia was induced using a reversible thread model of middle cerebral artery occlusion.The expression of substance P was observed by immunohistochemistry.Volume of brain infarction was calculated by TTC stain and edema formation was determined by wet weight-dry weight method.Neurological outcome was assessed using the rotarod test and asymmetry test.Results Immunohistochemistry revealed increase of SP following ischemia-reperfusion.Compared to control group the brain water content and neurological function impairment were attenuated in medication group, but the infarction volume was not reduced. Conclusion Neurokinin1 receptor antagonist may attenuate ischemia-reperfusion injury through inhibition of neurogenic inflammation.
Ischemia-reperfusion Substance P Brain edema Neurogenic inflammation
2012-02-21)
(本文编辑:杨丽)
杭州市医药卫生科技计划项目2012B003
310006 杭州市第一人民医院老年科
高越,E-mail:gy9821@sina.com
