肥大细胞在人乳头瘤病毒感染导致宫颈鳞癌发生发展中的作用研究
2013-04-18郑建琼陈育梅冯国飞黄凌霄潘丹朱雪燕朱雪琼
郑建琼 陈育梅 冯国飞 黄凌霄 潘丹 朱雪燕 朱雪琼
肥大细胞在人乳头瘤病毒感染导致宫颈鳞癌发生发展中的作用研究
郑建琼 陈育梅 冯国飞 黄凌霄 潘丹 朱雪燕 朱雪琼
目的 观察人乳头瘤病毒(HPV)和肥大细胞(MC)在正常宫颈组织、宫颈上皮内瘤变(CIN)及宫颈鳞癌(SCC)组织中的表达。方法 采用S-P免疫组化法检测60例CIN患者、40例SCC组患者和20例子宫肌瘤患者(对照组)组织中MC的表达,同时采用DNA导流杂交基因芯片技术检测各级组织脱落细胞中HPVDNA分型。结果 随着宫颈病变程度的加重,高危型(HR)-HPV感染阳性率逐渐增加,分别为10%、55%、65%、85%、100%,其中最常见的高危型HPV感染的基因型为:16、58、52、18。与CIN III组比较,MC密度在CINⅡ组、SCC组、对照组中的表达明显升高(P<0.01或0.05),并且MC与肿瘤临床分期和血管转移有关(均P<0.05)。MC低表达者与高表达者间HR-HPV阳性率的差异有统计学意义(P<0.01)。 结论 HR-HPV感染可以降低MC的表达,癌组织中浸润的MC可以促进肿瘤血管的形成和肿瘤的浸润转移。
宫颈鳞癌 宫颈上皮内瘤变 人乳头瘤病毒 肥大细胞
宫颈癌是一种常见的妇科肿瘤,严重威胁广大女性的生命和健康。全世界每年有37万新发病例,有20万人死亡;中国每年新发病例13万,占全世界的1/3[1]。宫颈癌病因很多,目前认为只有高危型人乳头瘤病毒(high risk human papillomavirus,HR-HPV)持续感染才是导致宫颈上皮恶性转化的必要条件。宿主的免疫反应对HPV感染转归起决定性作用,直接影响到HPV感染是否被清除或转为持续性感染[2]。肥大细胞(mast cell,MC)是体内重要的间质炎性细胞,不仅可以发挥非特异性免疫功能,而且可以促进肿瘤血管新生,并参与构建肿瘤的微环境[3]。本研究中,笔者观察MC在各级宫颈组织中的表达情况,研究其与宫颈鳞癌(squamous cell carcinoma,SCC)的临床病理参数之间的关系,同时检测各宫颈组织脱落细胞中HPV DNA情况,研究两者的相关性,为治疗HPV感染导致的SCC提供新的理论依据。
1 对象和方法
1.1 对象 选择2012-01—06因患宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN)在温州市人民医院妇产科行宫颈电环切术(loop electrosurgical excisional procedure,LEEP)或全子宫切除术的60例患者,年龄24~66岁,平均(46.47±8.42)岁。均无合并其他内外科疾病,术后病理检查诊断为CINⅠ20例,CINⅡ20例,CINⅢ20例。选择2010-09—2012-12因患SCC在温州市人民医院妇产科行全子宫切除术或广泛子宫切除术加盆腔淋巴结清扫术的40例患者,年龄33~71岁,平均(47.92±9.61)岁。均无合并其他内外科疾病,术前未进行过放化疗,术后经病理检查证实,组织学分级中、高分化21例、低分化19例;FIGO临床分期[4]≤Ib 22例,≥IIa 18例;浸润深度(浸润至深肌层)<3cm 25例,≥3cm 15例;伴有血管转移13例,无血管转移27例;伴有淋巴结转移14例,无淋巴结转移26例。选择2012-01—06因患子宫肌瘤在温州市人民医院妇产科行全子宫切除术的20例患者作为对照组,年龄43~75岁,平均(52.35± 8.27)岁。均无合并其他内外科疾病。
1.2 方法
1.2.1 HPV DNA的检测 取材时机:LEEP术患者于门诊妇科检查时,其他SCC患者于住院行妇科检查时。取材方法:以窥阴器暴露宫颈,擦去宫颈口黏液,将宫颈刷置于宫颈口,顺时针旋转5圈;取出宫颈刷,放入已加有专用细胞保存液的取样管中,拧紧瓶盖。样本处理:将有样本的微量离心管以14 000 r/min离心5min,弃上清液,保留管底沉淀物,加入50μl裂解液悬浮沉淀,100℃加热10min,14 000r/min离心10min,取上清液待检。采用DNA导流杂交基因芯片技术检测HPV DNA,HPV分型基因芯片检测系统(上海凯普生物化学有限公司)一次性检测21种HPV亚型的基因分型,包括13种高危亚型:16、18、31、33、35、39、45、51、52、56、58、59、68,5种低危亚型:6、11、42、43、44,3种中国人群常见亚型:53、66和CP8304。
1.2.2 MC的检测
1.2.2.1 S-P免疫组化法 一抗为小鼠抗人类胰蛋白酶(Tryptase)单克隆抗体(美国Neomarkers公司)。切片脱蜡入水,3%过氧化氢阻断过氧化物酶活性10min;PBS洗涤5min,3次;组织抗原微波修复,高温5min,中高温5min,室温20min;PBS洗涤5min,3次;相应的一抗4℃过夜,PBS洗涤5min,3次;生物素标记二抗室温孵育30min;DAB显色,显微镜观察,水洗终止;苏木素复染;树脂封片,光镜下观察。每次实验均设阴性和阳性对照。以PBS代替一抗作阴性对照,用已知有表达的宫颈癌切片作为阳性对照。
1.2.2.2 结果判断 MC类胰蛋白酶阳性者表达于间质细胞的胞质,呈棕褐色。肥大细胞密度(mast cell density,MCD)采用Orii等[5]方法,连续计数20个高倍视野(×400)的MC个数,再计算每个高倍视野下MC的平均数。
1.3 统计学处理 采用SPSS14.0统计软件。计量资料以表示,多组间比较采用One-Way ANOVA检验,两两比较采用LSD法。SCC组中各临床病理参数之间差异的比较采用成组t检验。宫颈各级组织中MC低表达组和高表达组HR-HPV阳性率的比较采用χ2检验。
2 结果
2.1 宫颈各级病变组织中HPV分型情况 对照组中多重阳性1例;CINⅠ和CINⅡ组中,多重阳性各有3例;CINⅢ组中,多重阳性7例;SCC组中,多重阳性5例。随着宫颈病变程度的加重,HR-HPV感染阳性率呈递增趋势,分别为10%、55%、65%、85%、100%,其中最常见的HR-HPV感染的基因型为16、58、52、18,详见表1。
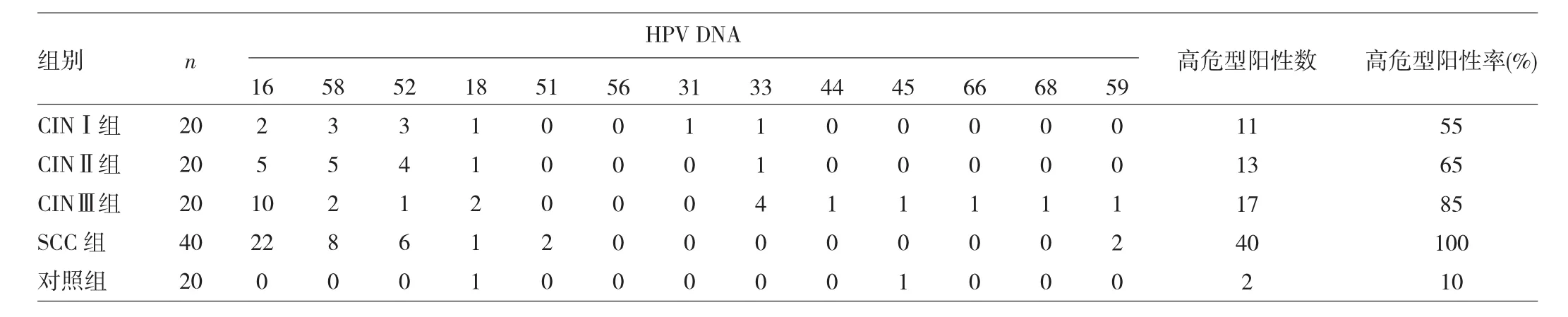
表1 宫颈各级病变组织中HPV DNA分布情况(例)
2.2 各级宫颈病变组织中MC表达情况 与CINⅢ组比较,MC在CINⅡ组、SCC组、对照组中的表达明显升高,差异有统计学意义(P<0.01或0.05),详见图1、表2。
2.3 SCC组患者各临床病理分期组织的MCD 在SCC组患者各临床病理分期组织中,MCD仅与不同临床分期、血管是否转移有关,高临床分期者高于低临床分期者,有血管转移者高于无血管转移者,差异均有统计学意义(均P<0.05),详见表3。
2.4 宫颈各级组织中MC低表达者和高表达者HRHPV感染情况 宫颈各级组织中MCD为0~10不等,平均4.13,设0~4为低表达者,共77例;5~10为高表达者,共43例。MC低表达者HR-HPV阳性率为77.92%,高表达者阳性率为53.49%,两者间的差异有统计学意义(χ2=7.72,P<0.01),详见表4。
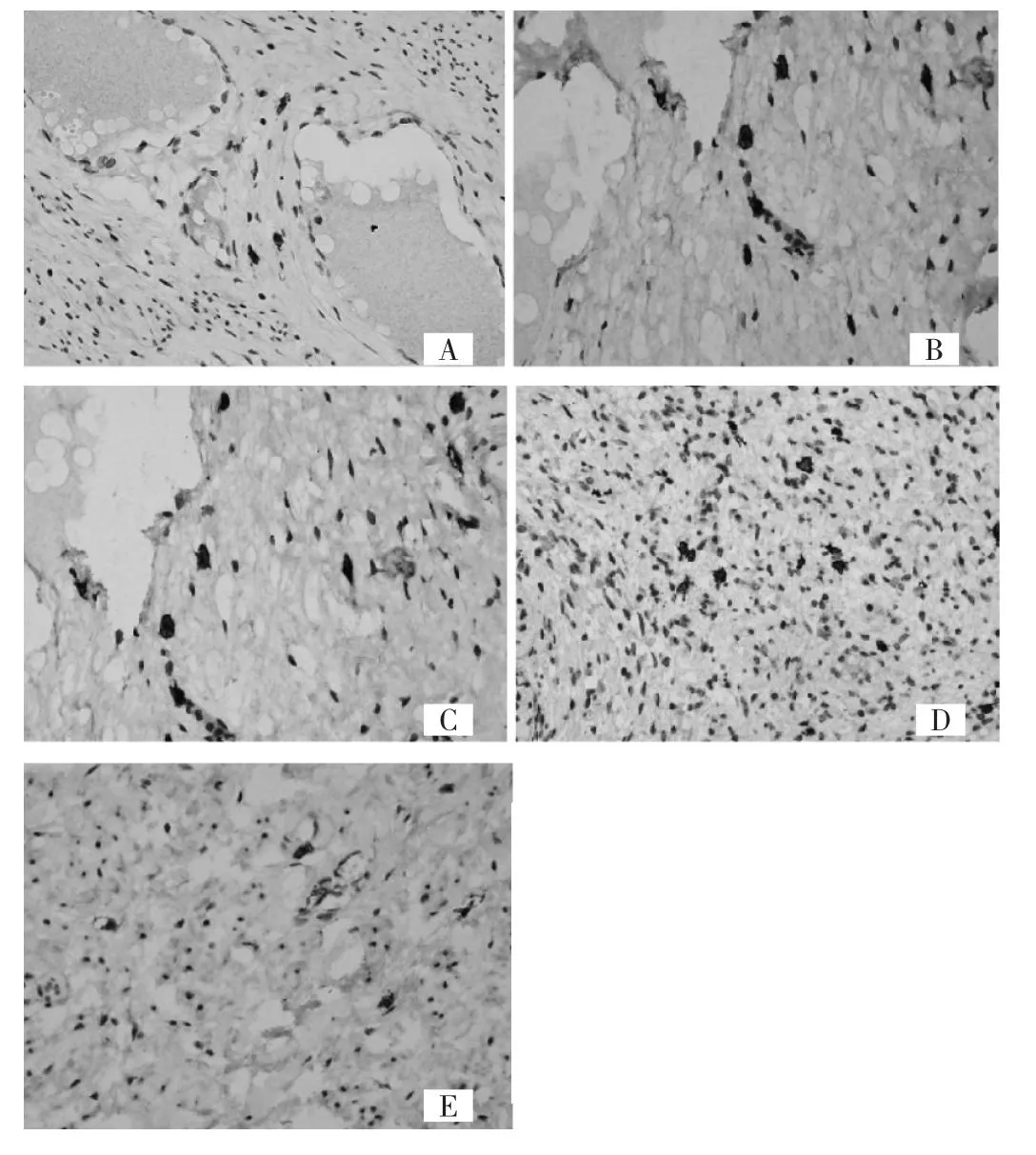
图1 肥大细胞在宫颈各病变组织中的表达(A:正常宫颈组织;B:CINⅠ组织;C:CINⅡ组织;D:CINⅢ组织;E:SCC组织;SP法,×400)

表2 宫颈各级病变中MCD的表达情况

表3 SCC组患者MC表达情况

表4 MC低表达和高表达者HR-HPV感染情况(例)
3 讨论
3.1 HPV和SCC的关系 HPV是一种无包膜的小DNA病毒,具有双链闭环的DNA基因组,大小为7.2~8.0kb,相对分子量为5×106,编码8个主要开放读码框架(ORFs),分为3个功能区:(1)早期区(E区),约4~5kb,含E1~E7 6个亚区;(2)晚期区(L区),约2.5kb,含L1、L2两个亚区;(3)非调控区(UCR),位于L区末端与E区起始端之间,一般为800~900bp。E区由E1、E2、E4、E5、E6、E7 6个开放阅读框架组成,主要功能为参与病毒复制、转录、翻译、调控与细胞转化。机体感染HPV后,其E6、E7致癌基因与抑癌基因pRB和p53结合,p53、pRB的功能受到抑制,细胞分化发生S期阻滞,最终细胞增殖失控,病毒的DNA断裂,部分DNA片段整合到宿主细胞基因组DNA中,从而使病毒E2基因失活,失去了对E6、E7基因的转录抑制调节,E6、E7基因得以持续表达,细胞转化为恶性。病毒基因的表达由病毒和宿主细胞的转录因子调控,包括E2、调控区(LCR)及细胞内反式调节因子,它们的改变可使转化蛋白过表达而致肿瘤[6]。至今已鉴定一百二十多种HPV基因型。世界卫生组织根据HPV亚型致癌危险性高低,可将HPV分为低危型和高危型两大类:(1)低危型:主要引起肛门皮肤及外生殖器的外生性疣类病变和低度子宫颈上皮内瘤变,其病毒亚型主要有HPV 6、11、30、39、42、43、44型等。(2)高危型:除可引起外生殖器疣外,更重要的是引起外生殖器癌、子宫颈癌及高度子宫颈上皮内瘤变,其病毒亚型主要有HPV l6、18、31、33、35、39、45、51、52、56、58、59、66、68、73型等,其中感染率最高的是HPV16和HPV18型,引起SCC的常为HPV16型,引起宫颈腺癌的常为HPV18型。目前认为,有性行为的女性约80%曾感染过HPV。感染HPV后,通常6~12个月内可自行消退。1年后HPV持续阳性率为30%,2年后为9%。只有HR-HPV持续感染才是导致宫颈癌的必要条件,其中对机体感染HPV后是否被清除或转为持续性感染,起决定性作用的是宿主的免疫反应[2]。HPV感染导致SCC的发病因素还包括:病毒的DNA存在形式、病毒负荷量、宿主免疫反应、遗传易感性、宿主性激素水平、合并其他病毒感染等。
朱丽丹等[7]利用DAN杂交技术检测2 561例温州地区妇科门诊和住院病例的下生殖道HPV并进行基因分型,HPV总阳性率为26.08%(668/2 561),高危型HPV与低危型HPV各占检出构成比的87.3%和12.7%,高危型HPV阳性率在CINⅠ、CINⅡ、CINⅢ、宫颈癌中分别为31.6%、53.1%、63.5%、75.0%,高危型中以16型最多(23.6%),其次为52型(16.3%)、58型(15.0%)。随着宫颈病变程度的加重,HR-HPV感染阳性率有递增趋势,分别为10%、55%、65%、85%、100%,其中感染前4位基因型为16、58、52、18,提示HR-HPV持续感染是宫颈癌发生的必要条件,与上述研究结果稍有差别,可能是本研究样本量太少有关。
3.2 MC和SCC的关系 MC来源于骨髓CD34+造血干细胞,是一类广泛分布于哺乳动物体内,以胞质中包含多种活性介质的嗜碱性颗粒为特征的细胞。不同亚型的MC胞浆中含有的蛋白酶存在差异。MCT型含有类胰蛋白酶,MCTC型含有类胰蛋白酶和类糜蛋白酶。活化后的MC可合成和分泌血管活性介质、趋化性介质、蛋白酶及细胞因子等40余种生物活性物质,参与体内多种生理和病理过程,如生殖、免疫、速发型变态反应、寄生虫感染和肿瘤等[8-9]。
关于MC和宫颈癌的关系,目前报道不一。Bentez-Bribiesca等[10]观察到类胰蛋白酶阳性的MC数量从正常子宫颈组织到子宫颈浸润癌逐渐增加。然而Cabanillas-Saez等[11]报道在CIN的Ⅰ~Ⅲ级中,MC数目无统计学差异,而在子宫颈浸润癌中MC数目较正常子宫颈组织有明显的提高。Karpanen等[12]报道,MC可以分泌血管内皮生长因子(VEGF)-A与血管内皮细胞上的VEGF-2受体结合,主要促进肿瘤血管的生成,导致宫颈癌的浸润转移。关于宫颈癌中MC的具体分型,也有不同的报道。Cabanillas-Saez等[11]发现在正常宫颈组织和宫颈癌组织中主要以MCT型为主,并且在宫颈病变恶性转化的不同时期MC的数量持续升高。然而Nicolae-Costin等[13]通过免疫组化方法分析SiHa细胞和ME-180细胞MC表达情况时发现,在宫颈浸润癌中,MTC表型占75%~79%,MCT表型仅占21%~25%,远远低于以前的研究报道(以前的研究报道占80%~83%),同时发现,类糜蛋白酶,而不是类胰蛋白酶,可以引起肿瘤细胞的迁移,从而导致肿瘤的转移。
本研究发现,与CINⅢ组比较,MC在CINⅡ组、SCC组、对照组中的表达明显升高(P<0.01或0.05)。在CINⅢ组中的表达最低,原因可能为:HPV感染和MC表达有关,持续的HPV感染会降低MC表达;但进展为SCC时,肿瘤微环境的改变,如MCP-1、巨噬细胞的增加,导致MC增加,促进肿瘤的浸润转移。本研究发现,在宫颈癌各临床病理分期中,MC表达与不同临床分期、血管转移有关,提示MC可以作为宫颈癌血管转移的预测指标之一。而对于具体的亚型,由于本研究使用的是小鼠抗人类胰蛋白酶单克隆抗体标计MC,MCTC和MCT表型均可以表现为阳性,尚不能区分具体分型。
3.3 MC和HPV的关系 MC参与机体抗HPV感染的非特异性免疫功能。其既可以吞噬杀伤病原菌或异质细胞,又能够释放多种生物活性介质,介导炎性反应。同时,由于MC存活时间长,有时可达数年,能对同一刺激做出重复性应答,因而对病原体、肿瘤有免疫监视及效应[14]。本研究发现,MC低表达组HR-HPV阳性率为77.92%,高表达组HR-HPV阳性率为53.49%,差异有统计学意义(P<0.01),提示HR-HPV的持续感染,可以下调MC的表达,促进宫颈上皮向恶性转化。
综上所述,HR-HPV持续感染是宫颈癌发生的必要条件,可以降低MC的表达,促进宫颈上皮向恶性转化;但在宫颈癌阶段,MC可以促进肿瘤血管新生,促进宫颈癌的浸润转移。进一步研究MC的功能及其与HPV之间的关系,必将有助于我们深入了解其在HPV感染导致的SCC癌变中的作用,为治疗SCC提供新的思路。
[1] 李亚里.HPV感染与宫颈癌前病变的临床研究进展 [J].武警医学, 2012,23(2):93-96.
[2] Parkin D M,Bray F.Chapter 2:The burden of HPV-related cancers[J].Vaccine,2006,24(Suppl3):S3/11-25.
[3] Castle P E,Phillips T M,Hildesheim A,et al.Immune profiling of plasma and cervical secretions using recycling mmunoaffinity chromatography[J].Cancer Epidemiol Biomarkers Prev[J].2003, 12(12):1449-1456.
[4] 丰有吉,沈铿.妇产科学[M].2版.北京:人民卫生出版社,2012:328.
[5] Orii A,Mori A,Zhai YL,et al.Mast cells in smooth muscle amaors of the uterus[J].Int J Gynecol Pathol,1998,17(4):336-342.[6] Yugawa T,Kiyono T.Molecular mechanisms of cervical carcinogenesis by high-risk human papillomaviruses:novel functions of E6 and E7 oncoproteins[J].Rev Med Virol,2009,19(2):97-113.
[7] 朱丽丹,郑晓群,余坚,等.2561例女性人乳头瘤病毒检测结果及分析[J].中国卫生检验杂志,2010,20(12):78-80.
[8] Rudolph M I,Boza Y,Yefi R,et al.The influence of mast cell mediators on migration of SW756 cervicalcarcinoma cells[J].J Pharmacol Sci,2008,106(2):208-218.
[9] 郭海平,高桦,邱明才,等.吡格列酮对糖尿病大鼠胃黏膜肥大细胞和单核细胞趋化蛋白-1表达的影响[J].实用医学杂志,2010,26(17): 3112-3113.
[10] Bentez-Bribiesca L,Wong A,Utrera D,et al.The role of mast cell tryptase in neoangiogenesis of prem alignant and malignant lesions ofthe uterine cervix[J].J Histochem Cytochem,2001, 49(8):1061-1062.
[11] Cabanillas-Saez A,Schalper J A,Nicovani S M,et al.Characterization of mast cells according to their content of tryptase and chymase in normal and neoplastic human uterine cervix [J].Int J Gynecol Cancer,2002,12(1):92-98.
[12] Karpanen T,Alitalo K.Molecular biology and pathology of lymphangiogenesis[J].Annu Rev Pathol,2008,3(10):367-397.
[13] Nicolae-Costin Diaconu,Jaana Rummukainen,Anita Naukkarinen,et al.Mast cell chymase is present in uterine cervical carcinoma and it detaches viable and growing cervical squamous carcinoma cells from substratum in vitro[J].Arch Dermatol Res, 2011,303(3):499-512.
[14] 向梅,吕杰强,朱雪琼.肥大细胞局部募集机制的研究进展[J].医学综述,2006,12(10):67-70.
The role of mast cells in progression of squamous cervical cancer induced by HPV infection
ZHENG Jianqiong,CHEN Yumei,FENG Guofei,et al.
Department of Gynecology,Wenzhou People's Hospital,Wenzhou 325000,China
Objective To investigate the expression of human papillomavirus(HPV)and mast cells(MCs)in normal cervical tissue,cervical intraepithelial neoplasia(CIN)and squamous cervical carcinoma(SCC). Methods The streptavidin peroxidase (SP)immunohistochemical staining was used to detect the expression of MCs in 20 specimens of normal cervical squamous epithelial tissue,60 specimens of CIN tissue and 40 specimens of SCC tissue.The HPV typing in exfoliated cells was determined by DNA diversion hybrid gene chip technique. Results The positive rates of HPV infection in normal cervical tissue,CIN I,CIN II,CIN III and SCC were 10%,55%,65%,85%and 100%,respectively.The most common genotypes of high risk HPV(HR-HPV) infection were:16,58,52 and 18.Compared to CINIII,the mast cell density(MCD)in CINⅡ,normal tissue and SCC was significantly increased(P<0.05 or 0.01);the MCD was correlated the clinical stage of tumor and the metastasis of blood vessel(P<0.05).There was significant difference in infection rate of HR-HPV between high MCD group and low MCD group(P<0.01). Conclusion HR-HPV infection is associated with the down-regulation of MC expression,indicating that infiltrating MC in cancer tissue may promote the tumor angiogenesis,invasion and metastasis.
Squamous cervical carcinoma Cervical intraepithelial neoplasm HPV Mast cell
2013-03-08)
(本文编辑:严玮雯)
温州市科技局项目(Y20120037)
325000 温州市人民医院妇产科(郑建琼、陈育梅、黄凌霄、朱雪燕),病理科(冯国飞、潘丹);温州医科大学附属第二医院妇产科(朱雪琼)
朱雪琼,E-mail:zjwzzxq@163.com
