转化生长因子-β1诱导小鼠足细胞凋亡实验研究
2013-04-18王宇晖童孟立杨汝春
王宇晖 童孟立 杨汝春
转化生长因子-β1诱导小鼠足细胞凋亡实验研究
王宇晖 童孟立 杨汝春
目的 探讨转化生长因子-β1(TGF-β1)是否能诱导小鼠足细胞株凋亡以及诱导凋亡的途径。 方法 (1)体外培养小鼠足细胞株;(2)应用不同浓度(10-1~104ng/L)TGF-β1诱导小鼠足细胞凋亡;(3)103ng/L TGF-β1诱导不同时间(12、24、48h)后观察足细胞凋亡情况;(4)采用流式细胞仪检测Annexin V、Caspase 3;(5)实时定量PCR及Western印迹法检测p38丝裂原活化蛋白激酶(p38MAPK)、Smad2、Smad3、Smad7mRNA及蛋白质的表达情况。 结果 (1)小鼠足细胞在不同浓度(10-1~104ng/L)TGF-β1刺激下,细胞凋亡率明显高于正常对照组(均P<0.05);(2)随着TGF-β1浓度增加、凋亡时间增加,足细胞凋亡率增高(P<0.05);p38MAPK、Smad2、Smad3、Smad7 mRNA表达增加;TGF-β1103ng/L为最佳诱导小鼠足细胞凋亡浓度,24h为最佳诱导凋亡时间;(3)与正常对照组比较,103ng/LTGF-β1诱导后Caspase 3阳性细胞比率显著增加(P<0.01),p38MAPK、Smad2、Smad3、Smad7蛋白质表达亦显著增加(P<0.01)。 结论 TGF-β1能诱导小鼠足细胞凋亡,呈浓度及时间依赖性。TGF-β1通过Smad通路、p38MAPK通路以及线粒体通路诱导小鼠足细胞凋亡。
TGF-β1足细胞 凋亡
足细胞是高度特异性的终末分化细胞,当其出现损伤、凋亡进而坏死、脱落、缺失,就会引起细胞数量减少和密度降低,导致肾小球进行性硬化,最终导致肾功能丧失[1]。足细胞凋亡已被认为是肾脏疾病发展的一种十分重要的机制,其中转化生长因子-β1(TGF-β1)对足细胞凋亡的调节作用十分重要[2]。TGF-β1是一种多功能的细胞因子,在肾小球硬化时表达增加。越来越多的研究表明足细胞在损伤时表达TGF-β1增加,而TGF-β1通过何种细胞传导途径发挥作用尚不明确。本研究旨在进一步明确TGF-β1是否能诱导小鼠足细胞凋亡及其诱导通路。
1 材料和方法
1.1 材料 实验试剂:小鼠足细胞株购自北京协和医学院,足细胞培养试剂(RPMI1640培养液、Ⅰ型胶原及0.25%胰蛋白酶)购自美国Gibco公司,FBS(10%)购自杭州四季青公司,小鼠IFN-γ购自美国Sigma公司,流式细胞仪试剂 Annexin V-FITC购自奥地利 Bender MedSystems公司,CaspGLOWTMCaspase 3购自美国BioVision公司,实时定量PCR试剂Trizol Reagent购自Invitrogen公司,Reveraid Frist Strand cDNA Synthesis kit购自加拿大Fermentas公司,引物合成由上海生工生物工程公司完成,Western-印迹法试剂盒及试剂(BCA蛋白分析试剂盒、NE-PER细胞核和细胞质蛋白抽提试剂、ECL Western Blot)购自美国Pierce公司,小鼠抗大鼠p38MAPK、Smad2、Smad3、Smad7、GAPDH抗体购自美国Santa Cruz公司,重组人转化生长因子-β1试剂购自Peprotech公司。主要仪器:EPICS XL流式细胞仪(美国Beckman Coulter公司),荧光定量PCR仪(FTC3000型,加拿大Funglyn Biotech公司),RNA/DNA calculator(Pharmacia公司),高速冷冻离心机(美国BECKMAN公司),凝胶成像仪(美国Pharmacia Biotech公司)。
1.2 方法
1.2.1 足细胞培养 将小鼠肾小球足细胞株置于含10%FBS的RPMI1640完全培养基中培养,细胞培养瓶中预先经0.1mg/ml胶原Ⅰ37℃处理1h,每瓶细胞加入10U/ml IFN-γ、100U/ml青链霉素,于33℃、5%CO2条件下培养箱内培养。细胞于24h后完全贴壁,每2~3d传代1次,至足够实验所需数量。将传代后足细胞株放入37℃、5%CO2条件下培养箱内培养,14d后足细胞分化成熟,开始进行实验。
1.2.2 实验分组 不同浓度:分别以0、10-1、100、101、102、103、104ng/L浓度TGF-β1刺激小鼠足细胞24h,其中0ng/L浓度TGF-β1为正常对照组。不同时间:选择0、103ng/L作为刺激浓度,分别刺激12、24、48h,其中0ng/L浓度为正常对照组。另外,选择103ng/L作为刺激浓度,刺激时间为24h,流式细胞仪测定小鼠足细胞Caspase 3阳性细胞数,Western印迹法检测小鼠足细胞p38MAPK、Smad2、Smad3、Smad7蛋白质的表达。
1.2.3 Annexin V及Caspase 3检测 (1)Annexin V:收集各孔细胞上清液及细胞,洗涤后调整细胞密度为2×105~5×105/ml;加入Annexin V-FITC后在常温下孵育洗涤细胞,再加入碘化丙啶,在流式细胞仪上分析。(2)Caspase 3:调整细胞密度106/ml;加入1μl FITC-DEVD-FMK在37℃、5%CO2培养箱中孵育1h;离心细胞洗涤,加入缓冲液再次悬浮细胞,通过流式细胞仪FL-1通道进行检测。
1.2.4 p38MAPK、Smad2、Smad3、Smad7mRNA表达检测 采用实时定量PCR方法检测,定量PCR检测每个基因设3复孔,数据以3次实验测定结果进行统计,采用双ΔCt的方法计算目的基因表达量,每个样品目的基因表达量除以GAPDH表达量即为样品基因相对含量。用Trizol提取细胞RNA;核酸分析仪测定RNA样品浓度;1.5%琼脂凝胶(agarose gel)2~4μl RNA上样,电泳检测RNA完整性;合成cDNA第一链;以25μl反应体系进行PCR扩增。引物设计:运用Primer Premier 5结合Dnastar分析软件及网上BLAST分析,设计并合成引物。引物序列:GAPDH上游序列为TGGCCTTCCGTGTTCCTAC,下游序列为GAGTTGCTGTTGAAGTCGCA;p38MAPK上游序列为GGGACACCCCCTGCTTATCT,下游序列为TCCCTGCTTTCAAAGGACTGG;Smad2上游序列为AATACGGTAGATCAGTGGGACA,下游序列为CAGTTTTCGATTGCCTTGAGC;Smad3上游序列为TCTCCCCGAATCCGATGTCC,下游序列为 GCTGGTTCAGCTCGTAGTAGG;Smad7上游序列为GCATTCCTCGGAAGTCAAGAG,下游序列为CCAGGGGCCAGATAATTCGT。每个样本均采用3复孔。PCR扩增条件:95℃30s、95℃5s、60℃30~34s,共40个循环。
1.2.5 p38MAPK、Smad2、Smad3、Smad7蛋白质表达检测 采用Western印迹法检测。刮下细胞洗涤后,按100:1加入细胞裂解液和蛋白酶抑制剂(100ul+1μl),充分裂解后,离心取上清液。按BCA法测蛋白浓度。样品与2×上样缓冲液1∶1混合,煮沸5min,在12%SDS-聚丙烯酰胺凝胶进行SDS-PAGE电泳分离,转膜,封闭后分别加入小鼠抗大鼠p38MAPK、Smad2、Smad3、Smad7和内参照GAPDH一抗(1∶200),一抗用封闭液稀释,4℃孵育过夜。TBST洗膜3次,15min/次。将膜在1∶1 000稀释的抗兔IgG-HRP中室温孵育1h,TBST洗膜3次,将膜贴在ECL发光液上,曝光,凝胶成像分析系统进行扫描分析,系统直接得出结果。
1.3 统计学处理 采用SPSS17.0统计软件,计量资料以表示,先进行正态分布及方差齐性检验,符合正态分布及方差齐性,则用方差分析;非正态分布及方差齐性,则用秩和检验。
2 结果
2.1 不同浓度TGF-β1诱导后小鼠足细胞凋亡情况比较 见表1。
由表1可见,10-1~104ng/L TGF-β1诱导后小鼠足细胞凋亡率及坏死率均明显高于正常对照组(均P<0.05);随着TGF-β1诱导浓度的升高,细胞凋亡率及坏死率呈不同程度升高(均P<0.05)。
2.2 不同浓度 TGF-β1诱导后 p38MAPK、Smad2、Smad3、Smad7 mRNA表达量 见表2。
由表2可见,小鼠足细胞在不同浓度TGF-β1刺激下,p38MAPK、Smad2、Smad3、Smad7 mRNA表达量逐渐增加,至101ng/L时达到1.5倍,至103ng/L时达到2倍以上。
2.3 不同时间诱导后小鼠足细胞凋亡情况的比较 见表3。
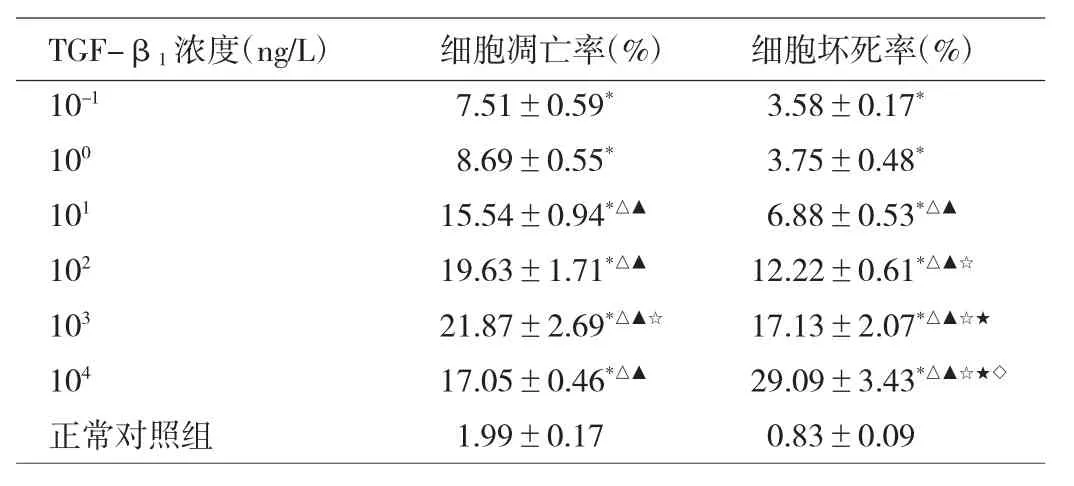
表1 不同浓度TGF-β1诱导后小鼠足细胞凋亡情况比较

表2 不同浓度TGF-β1诱导后p38MAPK、Smad2、Smad3、Smad7 mRNA表达量

表3 不同时间诱导后小鼠足细胞凋亡情况的比较
由表3可见,与正常对照组比较,诱导12、24、48h后足细胞凋亡率及坏死率均明显增加,差异有统计学意义(P<0.01);与诱导12h比较,诱导24、48h后足细胞凋亡率明显增加(P<0.01)。诱导后48h细胞坏死率明显高于诱导12、24h组(P<0.01)。
2.4 不同时间诱导后p38MAPK、Smad2、Smad3、Smad7mRNA表达量 见表4。
由表4可见,诱导12h后,p38MAPK、Smad2、Smad3、Smad7 mRNA表达不明显,诱导24h后p38MAPK、Smad2、Smad3、Smad7 mRNA表达量升高(达1.5倍),诱导48h后p38MAPK、Smad2、Smad3、Smad7mRNA表达明显升高(达2倍)。
2.5 103ng/L TGF-β1诱导小鼠足细胞24h后Caspase 3及p38MAPK、Smad2、Smad3、Smad7蛋白质表达量 诱导24h后Caspase 3阳性细胞比率为(62.93±5.88)%,显著高于正常对照组的(4.73±1.38)%,差异有统计学意义(P<0.01)。p38MAPK、Smad2、Smad3、Smad7蛋白质表达情况见图1、表5。

表4 不同时间诱导后p38MAPK、Smad2、Smad3、Smad7 mRNA表达量

图1 小鼠足细胞p38MAPK、Smad2、Smad3、Smad7蛋白质表达电泳图

表5 p38MAPK、Smad2、Smad3、Smad7蛋白质表达量
由图1和表5可见,TGF-β1组p38MAPK、Smad2、Smad3、Smad7蛋白质表达量均显著高于正常对照组,差异均有统计学意义(均P<0.01)。
3 讨论
足细胞属于高度分化细胞,有独特复杂的结构,参与肾小球毛细血管襻滤过屏障的构成。在人类及动物模型的肾小球疾病如微小病变、局灶节段肾小球硬化、塌陷型肾病、膜性肾病、新月体肾病、糖尿病肾病和狼疮肾炎等中,都发现有足细胞损伤。足细胞损伤包括:裂孔隔膜结构和成分的改变[3]、肌动蛋白细胞骨架的调节异常等[4],严重的足细胞损伤则是细胞凋亡[5]或足细胞与肾小球基底膜(GBM)及其连接异常导致足细胞从基底膜脱落[6]。足细胞损伤及脱落在蛋白尿的发生以及肾小球硬化进展中起关键作用。研究表明,足细胞丢失20%就可以引起系膜扩张、一过性轻度蛋白尿;足细胞丢失20%~40%可出现少量蛋白尿,球囊粘连和局灶节段肾小球硬化;足细胞丢失>40%,球囊粘连显著增加,肾小球硬化增多,持续大量蛋白尿,肾功能异常[7]。
多种应答机制可以导致足细胞数量的减少,包括凋亡、足细胞从GBM上脱落以及足细胞增殖能力的丧失[8]。足细胞凋亡已被认为是肾脏疾病发展的一种十分重要的机制,其中TGF-β1对足细胞凋亡的调节作用非常重要。TGF-β1在大多数细胞内起调节生长、分化和凋亡的作用。Schiffer等[9]的研究发现,2周龄的TGF-β1转基因小鼠,其足细胞凋亡率比野生型小鼠增加20倍。TGF-β1诱导足细胞凋亡的通路如下:(1)Smad通路。研究发现,在培养的足细胞中加入5.0ng/ml TGF-β1可迅速诱导Smad2/3磷酸化,15min即出现磷酸化,并持续8~24h,同时发现TGF-β1能强烈诱导转基因小鼠和体外培养的足细胞内Smad7蛋白表达上调,上调的Smad7蛋白通过抑制抗凋亡的存活因子(NF-κB)/p65的活化,从而导致足细胞凋亡[9]。(2)p38丝裂原活化蛋白激酶(MAPK)通路。MAPK也是足细胞内重要的信号通路,nephrin可通过p38和JNK MAPK激活作为转录因子的激动蛋白,而podocin可明显加强nephrin的这一信号传递[10],MAPK通路的活化与足细胞损伤、足突融合和蛋白尿的发生有关[11]。研究表明,葡萄糖可使足细胞产生过多的TGF-β1,通过p38MAPK使足细胞凋亡增加、数量下降[12]。体外实验研究发现,足细胞在TGF-β1刺激20min~8h内p38即持续磷酸化;2~12h时Bax表达增加,6h是Caspase 3开始激活,24h后即出现了特异性的DNA片段,加入Caspase 3的抑制剂可以减少TGF-β1诱导的DNA片段产生[9],表明TGF-β1可以通过激活Caspase来诱导足细胞凋亡,此即凋亡的线粒体通路。
本研究结果显示,随着TGF-β1诱导剂量的增加,足细胞凋亡细胞数目增加,在103ng/L浓度时最明显,至104ng/L浓度时足细胞凋亡数目并未增加,但坏死细胞数增多。因此本研究选择103ng/L作为诱导足细胞凋亡最佳诱导浓度。小鼠足细胞在103ng/L TGF-β1刺激下,随着TGF-β1刺激时间延长,足细胞凋亡数目亦逐步增加,但刺激48h和24h之间差异无统计学意义,并且诱导48h后坏死细胞数目显著增加。定量PCR实验显示,随着TGF-β1诱导剂量、诱导时间的延长小鼠足细胞Smad2、Smad3、Smad7 mRNA表达增加。同时,Western印迹法显示,与正常组相比,TGF-β1组Smad2、Smad3、Smad7蛋白质的表达明显增加,提示TGF-β1诱导小鼠足细胞凋亡是通过Smad通路完成的。随着TGF-β1诱导剂量、诱导时间的延长,小鼠足细胞p38MAPK mRNA表达亦增高,TGF-β1组p38MAPK蛋白质表达增加,Caspase 3阳性细胞数也明显增多,提示TGF-β1亦激活了p38MAPK通路,通过线粒体通路诱导小鼠足细胞凋亡。TGF-β1能通过Smad通路、p38MAPK通路、线粒体通路等诱导小鼠足细胞凋亡,并呈浓度及时间依赖性,抑制TGF-β1表达或拮抗TGF-β1可能是防治足细胞凋亡的重要手段之一。
[1] Wiggins R C.The spectrum of potocytopathies:a unifying view of glomerular diseases[J].Kidney Int,2007,71(12):1205-1214.
[2] Wada T,Pippin J W,Terada Y,et al.The cyclin-dependent kinase inhibitor p21 is required for TGF-beta1-induced podocyte apoptosis[J].Kidney Int,2005,68(4):1618-1629.
[3] Michaud J L,Lemieux L I,Dube M,et al.Focal and segmental Glomerulosclerosis in mice with podocyte-specific expression of mutant alpha-actinin-4[J].J Am Soc Nephrol,2003,14(5):1200-1211.
[4] Verma R,KovariI,SoofiA,et al.Nephrin ectodomain engagement results in Src kinase activation,nephrin phosphorylation,Nck recruitment,and actin polymerization[J].J Clin Invest,2006,116(5): 1346-1359.
[5] Zou M S,Yu J,Nie G M,et al.1,25-dihydroxyvitamin D3 decreases adriamycin-induced podocyte apoptosis and loss[J].Int J Med Sci,2010,7(5):290-299.
[6] Mundel P,and Shankland S J.Podocyte biology and response to injury[J].J Am Soc Nephrol,2002,13(12):3005-3015.
[7] Wharram B L,GoyalM,Wiggins J E,et al.Podocyte depletion causes glomerulosclerosis:Diphtheria toxin-induced podocyte depletion in rats expressing human diphtheria toxin receptor transgene [J].J Am Soc Nephrol,2005,16(10):2941-2952.
[8] Xavier S,Niranjan T,Krick S,et al.TβRI independently activates smad-and CD2AP-dependent pathways in podocytes[J].J Am Soc Nephrol,2009,20(10):2127-2137.
[9] Schiffer M,Bitzer M,Roberts I S D,et al.Apoptosis in podocytes induced by TGF-β and Smad7[J].The Journal of Clinical Investigation,2001,108(6):807-816.
[10] Huber T B,Kottgen M,Schilling B,et al.Interaction with podocin facilitates nephrin signaling[J].J BiolChem,2001,276(45):41543-41546.
[11] Koshikawa M,Mukoyama M,Mori K,et al.Role of p38 mitogen-activated protein kinase activation in podocyte injury and proteinuria in experimental nephrotic syndrome[J].J Am Soc Nephrol,2005,16(9):2690-2701.
[12] Dalla VM,Masiero A,Roiter AM,et al.Is podocyte injury relevant in diabetic nephropathy?Studies in patients with type 2 diabetes [J].Diabetes,2003,52(4):1031-1035.
TGF-β1induces apoptosis of mouse podocytes in vitro
WANG Yuhui,TONG Mengli,YANG Ruchun.
Department of Nephrology, Hangzhou Hospital of Traditional Chinese Medicine,Hangzhou 310007,China
Objective To investigate the effect of TGF-β1on apoptosis of mouse podocytes and its signal pathway. Methods Cultured mouse podocytes were treated with different concentrations of TGF-β1(0,1x10-1~104ng/L)for 24 h,or treated with 103ng/L TGF-β1for different time duration(12,24,48h).Annexin V and Caspase 3 were measured by flow cytometry.The mRNAs and proteins of P38MAPK,Smad2,Smad3 and Smad7 were detected by real time PCR and Western blotting. Results Compared to controls(0ng/L TGF-β1)the ratio of apoptotic podocytes and mRNA expressions of p38MAPK,Smad2,Smad3 and Smad7 were increased in TGF-β1(10-1~104ng/L)treatment groups in a concentration and time-dependent manner(P<0.05). Treatment with TGF-β1(103ng/L)for 24 h induced maximal apoptosis in podocytes.The ratio of Caspase3-positive podocytes was increased after treated with TGF-β1(103ng/L,24h)compared to controls(P<0.01). Conclusion TGF-β1induces the apoptosis of mouse podocytes time-dependently and dose-dependently,in which Smad,p38MAPK signal pathway and mitochondrion might be involved.
TGF-β1Podocyte Apoptosis
2013-03-15)
(本文编辑:欧阳卿)
浙江省中医药管理局立项资助课题(2006C108)
310007 杭州市中医院肾内科
