慢病毒介导的hGM-CSF修饰的肿瘤疫苗免疫活性研究
2013-04-18林阿丽孙青
林阿丽 孙青
慢病毒介导的hGM-CSF修饰的肿瘤疫苗免疫活性研究
林阿丽 孙青
目的 构建编码人粒细胞-巨噬细胞集落刺激因子(human granulocyte-macrophage colony stimulating factor,hGM-CSF)的慢病毒载体,研究编码hGM-CSF的慢病毒载体对树突状细胞(dendritic cell,DC)疫苗抗肿瘤活性的增强作用。方法以质粒pORFhGM-CSF为模板,采用PCR方法扩增出hGM-CSF基因片段;通过BamHⅠ和XhoⅠ限制性内切酶位点,将hGM-CSF基因定向克隆到慢病毒连接载体L166中构建重组载体L166-hGM-CSF。将重组载体L166-hGM-CSF和包装载体L205以及包膜载体L311共同转染慢病毒包装细胞293T,72h后收集病毒上清液获得编码hGM-CSF的慢病毒颗粒LentihGM-CSF。从脐血中分离出单核细胞,rhGM-CSF、rhIL-4和α-TNF诱导获得DC,通过相差显微镜和流式细胞仪鉴定。应用反复冻融法制备可溶性肿瘤抗原,分别将负载肿瘤抗原的DC疫苗和慢病毒Lenti-hGM-CSF感染的负载肿瘤抗原的DC疫苗与T淋巴细胞共同培养,MTT方法检测并比较两者所诱导的CTL对反应细胞的体外杀伤活性。结果 编码hGM-CSF的慢病毒载体L166-hGM-CSF成功构建,获得了编码hGM-CSF的慢病毒。该慢病毒的Hela细胞上清液中hGM-CSF的表达明显高于未感染者。从脐血中分离出的DC,显示其高表达CD80(87.2%)和CD86(92.8%),而单核细胞标志CD14的表达率较低(3.56%)。慢病毒介导的分泌hGM-CSF的树突状细胞肿瘤疫苗刺激同种T淋巴细胞增殖的能力和抗肿瘤活性较普通DC疫苗明显增强(P<0.01)。结论本实验制备的慢病毒Lenti-hGM-CSF感染反应细胞后能够显著增强DC肿瘤疫苗刺激同种T淋巴细胞增殖的能力及其诱导的CTL细胞对肿瘤细胞的杀伤能力,为hGM-CSF修饰的DC肿瘤疫苗的临床应用提供了一定的实验依据。
慢病毒载体 粒细胞巨噬细胞集落刺激因子 树突状细胞 肿瘤疫苗
树突状细胞(dendritic cell,DC)是已知的功能最强的抗原递呈细胞,也是惟一能够激发机体初始免疫反应的抗原递呈细胞。DC可摄取肿瘤抗原,发育成熟后在膜上高表达MHCⅠ、Ⅱ类分子,并递呈大量的肿瘤抗原给T细胞受体;同时也可提高协同刺激分子B7-1、B7-2和CD40等的表达,并使T细胞被激活;而且DC与T细胞结合后可分泌大量的IL-12,IL-12强有力地诱导T细胞、自然杀伤细胞(NK)和淋巴因子激活的杀伤细胞(LAK),产生大量TNF-γ、穿孔素和颗粒酶,增强细胞毒性T淋巴细胞(CTL)和NK对反应细胞的溶解作用。动物实验、体外实验和早期临床试验表明,通过载体将肿瘤抗原、细胞因子佐剂或共刺激因子等转入DC制备的DC疫苗,有较强的抑制肿瘤细胞生长的作用[1-4]。人粒细胞-巨噬细胞集落刺激因子(human granulocyte macrophage colony stimulating factor,hGM-CSF)具有多种生物活性,可促进DC等抗原递呈细胞的分化、成熟和活化;增加DC表面的主要组织相容复合物Ⅱ,促进肿瘤抗原的有效递呈;同时还可增强外周血单核细胞及淋巴细胞的细胞毒效应、抗体依赖细胞介导的细胞毒效应等,从而诱导有效的抗肿瘤免疫应答。hGM-CSF已被广泛应用到肿瘤疫苗的研究中,并取得了一定成效。本研究拟构建编码hGM-CSF的慢病毒载体,经修饰后感染负载肿瘤抗原的DC细胞制备肿瘤疫苗,研究其抗肿瘤细胞活性,旨在为肿瘤的生物治疗开辟新的途径。
1 材料和方法
1.1 材料
1.1.1 载体及细胞系 本研究使用的载体L166、L205、L311和pORFhGM-CSF由美国Alabama大学血液学与肿瘤学实验室惠赠;作为慢病毒的包装细胞的293T细胞系由美国Alabama大学血液学与肿瘤学实验室惠赠;Hela细胞由山东省千佛山医院病理科实验室提供,采用1640培养基培养。
1.1.2 主要试剂 DMEM培养基、1640培养基、四甲基偶氮唑蓝(MTT)及嘌呤霉素产自美国Gibco公司;胎牛血清产自杭州四季青公司;BamHⅠ和XhoⅠ限制性内切酶及T4连接酶产自美国Promega公司;重组人粒细胞-巨噬细胞集落刺激因子、rhIL-4、α-TNF、rhIL-2、FITC标记的CD14、CD80和CD86产自深圳晶美公司;淋巴细胞分离液产自天津TBD公司;质粒提取试剂盒Endo-free kit Maxi产自德国Qiagen公司;胶回收试剂盒E.Z.N.A.Gel Extraction Kit产自美国Omega公司;ELISA检测试剂盒Human GM-CSF DuoSet kit产自美国R&B公司。
1.2 方法
1.2.1 编码hGM-CSF的慢病毒载体的构建 (1)hGM-CSF基因全长的PCR扩增,根据Invivogen公司提供的质粒pORFhGM-CSF的基因序列,设计一对特异性引物,上游引物hGM-CSF 1:BamHⅠ5′-GCGGATCCATGTGGCTGCAGAGCCTGCT-3′,下游引物hGM-CSF 2:XhoⅠ 5′-GCCTCGAGTGACTCCTGGACTGGCTCC-3′,同时分别在5′端设计上BamHⅠ和XhoⅠ限制性内切酶位点,委托上海生物工程技术有限公司合成。以pORFhGM-CSF为模板,PCR扩增hGM-CSF基因。PCR产物长度为489bp。(2)重组载体L166-hGM-CSF的构建:将纯化回收的hGM-CSF目的基因插入到载体L166的BamHⅠ和XhoⅠ酶切位点之间。用氨苄青霉素筛选阳性重组载体,用Endo-free kit Maxi试剂盒大量提取载体。(3)编码hGM-CSF慢病毒的包装:将重组载体L166-hGM-CSF、包装载体L205及包膜载体L311共同转染至包装细胞293T内,次日换普通的DMEM培养基,5d后收集漂浮层,3 000r/min离心20min。将上清液用0.45μm的滤膜负压过滤,收集编码hGM-CSF的慢病毒,即为慢病毒Lenti-hGM-CSF[5]。
1.2.2 宫颈癌抗原的制备 收集对数生长期的Hela细胞装入冻存管,将冻存管浸入液氮中冻存,10min后取出,迅速置37℃,待其完全融化后,再次放入液氮中,如此反复5次。将肿瘤细胞裂解物加入离心管,2 000r/min离心20min,收集上清液,经0.45μm无菌滤膜过滤,紫外分光光度仪检测抗原浓度。4℃保存备用。
1.2.3 DC的体外诱导与培养 无菌抽取新鲜的健康新生儿脐血(山东省千佛山医院妇产科分娩的健康新生儿),经淋巴细胞分离液梯度离心,收集单个核细胞,置培养瓶内,加入含10%FBS的PRMI1640培养液37℃5%CO2培养2h,除去非贴壁细胞,加入PRMI1640培养液(10%FBS+50ng/ml rhGM-CSF+100ng/ml rhIL-4)常规培养,3d后半量补加培养液。第7天加入10ng/ml的α-TNF,继续培养24h,次日收集悬浮细胞即得活化的DC细胞(DC组)。
1.2.4 冻融抗原冲击DC 收集培养第6天的DC细胞用含RPMI1640培养液(10%FBS+50ng/ml rhGM-CSF+ 100ng/ml rhIL-4)制成细胞悬液,接种于2个60mm培养皿,分别加入制备的宫颈癌抗原(100μg/ml)培养过夜。次日加入α-TNF(10ng/ml)继续培养24h即得到活化的宫颈癌DC疫苗(DC/H组)。其中一培养皿在加入宫颈癌抗原的同时加入200μl慢病毒Lenti-hGM-CSF进行感染,得到的DC疫苗为Lenti-DC/H组。
1.2.5 测定慢病毒转染前后DC的hGM-CSF浓度 于DC诱导的第8天,分别收集DC组、DC/H组、Lenti-DC/ H组3组细胞的培养液10μl,用ELISA试剂盒检测慢病毒转染前后DC培养液上清液中OD450的变化。通过回归分析得出计算公式:浓度(pg/ml)=(OD450值-0.2883)/ 0.0029,将各标本的OD450值同其比较,获得3组的hGM-CSF浓度。
1.2.6 混合淋巴细胞反应的测定 DC用RPMI-1640完全培养基悬浮,调整密度为1×106/ml,加入丝裂霉素25μg/ml,37℃孵育30min。DC及T细胞用完全RPMI1640培养基重悬。按照刺激细胞和反应细胞之比分别为1∶10、1∶100、1∶1 000的比例将DC细胞加入96孔培养板。每组各设6个复孔,每孔100μl。同时设T细胞对照组和空白对照组。37℃5%CO2培养箱培养72h,取出后每孔加入MTT 10μl(5mg/ml),37℃5%CO2培养箱培养4h。每孔吸弃上清液100μl,再加入100μl盐酸异丙醇,避光保存10min,于492nm处用酶标仪测量OD值,结果用6孔均值表示。根据下述公式:DC刺激淋巴细胞增殖指数(SI)=(实验组OD值-空白对照组OD值)/(T细胞对照组OD值-空白对照组OD值)。
1.2.7 肿瘤特异性CTL对反应细胞的杀伤能力的测定于DC培养的第7天收集处于对数生长期的Hela细胞,调细胞浓度为1×104/ml,每孔100μl接种于96孔板,37℃5%CO2培养箱培养过夜。次日收集DC、Lenti-DC/H和DC/H细胞,按照效靶比为20∶1、10∶1和5∶1接种96孔板。同时设T细胞对照组。每组均设6个复孔。37℃5%CO2培养箱培养24h,每孔加入10μl MTT(5mg/ ml),继续培养4h,每孔吸弃100μl上清液,加入100μl盐酸异丙醇溶液,避光保存10min后,于492nm处用酶标仪测量OD值,结果用3孔均值表示。根据以下公式计算抑瘤率:抑瘤率(%)=(1-实验组OD值/对照组OD值)×100%。
1.3 统计学处理 采用SPSS 13.0统计软件,计量资料以表示,组间比较采用t检验。
2 结果
2.1 重组慢病毒载体L166-hGM-CSF的鉴定 筛选阳性重组载体L166-hGM-CSF,快速小量提取载体DNA,经BamHⅠ和XhoⅠ双酶切后,得到两条明亮清晰的条带,一条为hGM-CSF片段(约14 000bp),另一条与hGM-CSF片段大小一致(434bp),见图1。
2.2 DC的体外培养与鉴定 从脐血中获得的单个核细胞经贴壁培养2h后,获得黏附细胞,加入rhGM-CSF(100ng/ml)和rhIL-4(50ng/ml)培养48h后细胞出现不规则形态,同时悬浮细胞增多,以后随着时间的延长,悬浮细胞逐渐增多,细胞周边可见突起。第5天时细胞均匀分布在培养液中,细胞体积较大,部分细胞出现树突状突起(图2)。经肿瘤抗原冲击后的DC体积变大,细胞突起更加明显。慢病毒转染后的DC细胞在形态上未见明显变化。收集诱导第7天的成熟DC细胞进行流式检测,结果显示DC细胞表面CD14、CD80和CD86的表达率分别为3.56%、87.2%和92.8%,单核细胞特异性标志CD14已基本丢失,说明成功诱导出DC。DC表型CD14、CD80、CD86流式图见图3。

图1 限制性内切酶BamHⅠ和XhoⅠ双酶切重组载体L166-hGMCSF电泳结果(M:D2000 Marker;1:hGM-CSF片段)
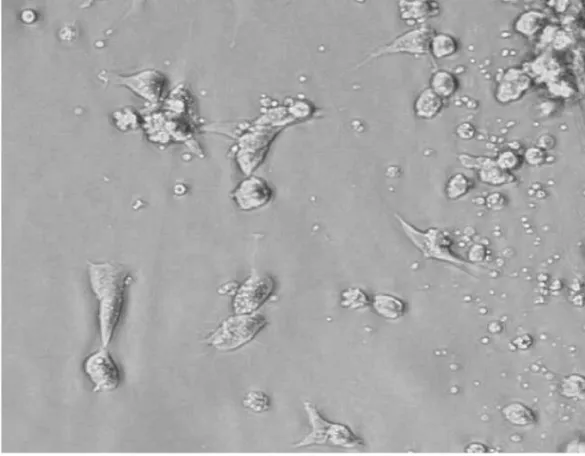
图2 从人脐带血分离培养至第5天的DC细胞
2.3 慢病毒转染前后DC分泌hGM-CSF的变化 A、B、C 3组hGM-CSF浓度分别为92、93和213ng/ml。C组DC培养液中hGM-CSF含量高于未经慢病毒转染的A组和B组。
2.4 混合淋巴细胞反应 经肿瘤抗原冲击后的DC刺激淋巴细胞增殖的能力优于未负载肿瘤抗原的DC,差异有统计学意义(P<0.01)。经慢病毒感染后DC细胞刺激淋巴细胞增殖的能力有了明显的增加(P<0.05或0.01),SI均>1.5。具体结果见表1。
2.5 肿瘤特异性CTL对反应细胞的杀伤能力 经肿瘤抗原冲击的DC所诱导的CTL对肿瘤细胞的杀伤效力高于未经抗原冲击的一组,差异有统计学意义(P<0.01)。而经编码hGM-CSF的慢病毒感染后肿瘤抗原冲击的DC所诱导的CTL对肿瘤细胞的抑制作用有了更显著提高(P<0.05或0.01)。具体结果见表2。
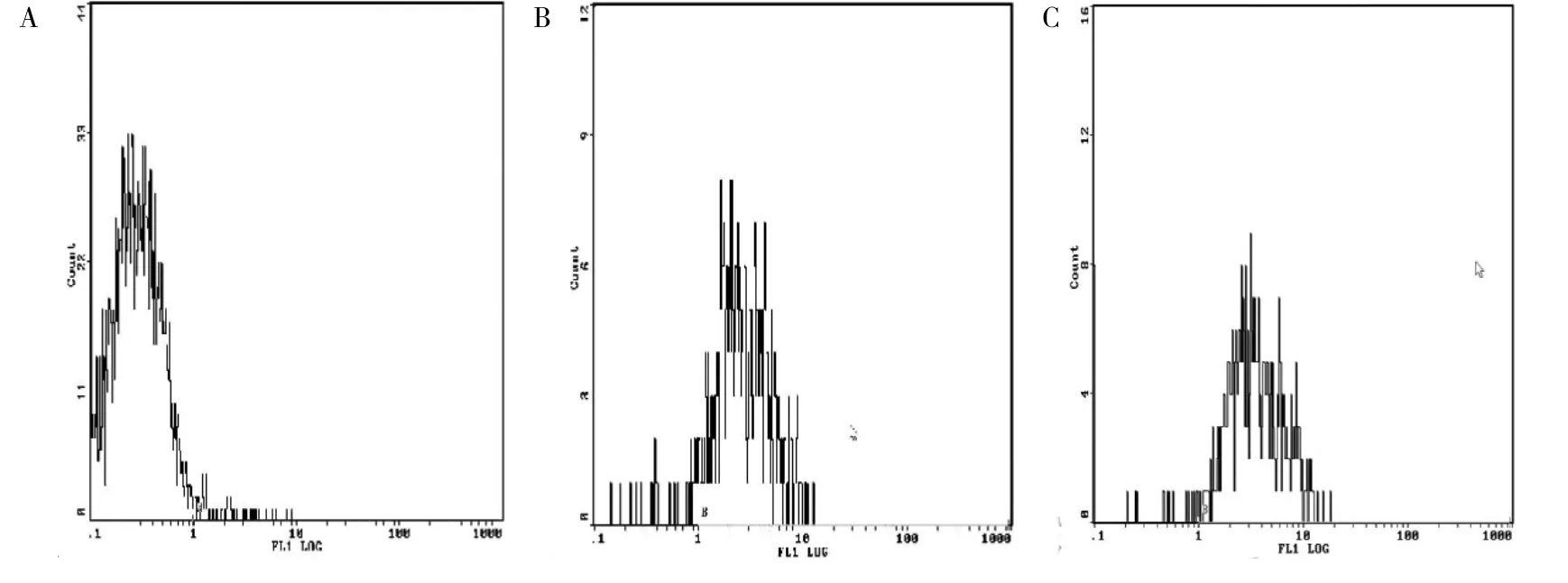
图3 DC表型CD14、CD80、CD86流式图(A:CD14,B:CD80,C:CD86)
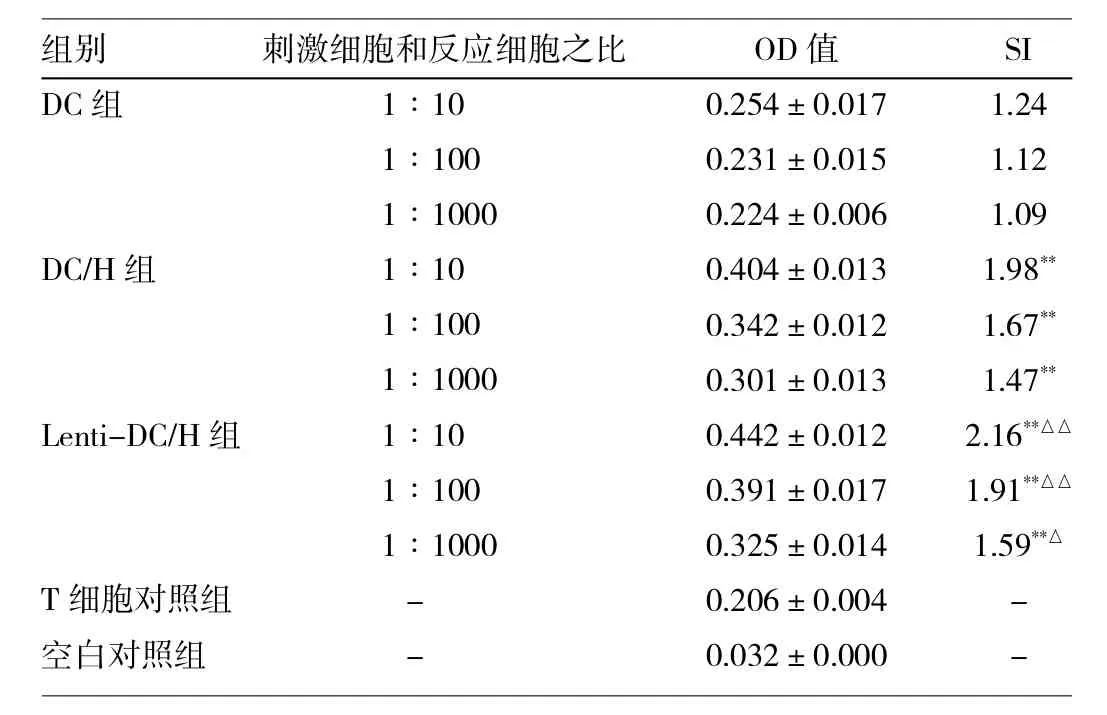
表1 不同组别DC细胞刺激T细胞增殖能力

表2 慢病毒转染前后DC疫苗对肿瘤细胞的体外杀伤能力
3 讨论
GM-CSF是一种对细胞和体液免疫功能都具有广泛调节作用的细胞因子[6]。GM-CSF不仅可以刺激T细胞、巨噬细胞和树突细胞的增殖和活化,从而增强宿主抗肿瘤免疫力,还可以刺激巨噬细胞产生TNF-α,直接调节宿主抗肿瘤活性[7-9]。Urdinguio等[10]研究发现,GMCSF过表达的结肠肿瘤患者其5年生存率高达100%。Songbing等[11]构建了hHGM-CSF腺病毒载体,并以此转染DC制备肿瘤疫苗,用以体外杀伤结肠癌CT26细胞,结果90%的肿瘤细胞被杀伤。
肿瘤疫苗的制备需借助一定的载体将目的基因转移至反应细胞内。非病毒学的基因转移方法效率较低;已用于人体试验的基因治疗方案绝大多数是以病毒学方法进行基因转移的,目前的细胞因子肿瘤疫苗大多采用复制缺陷型腺病毒做载体[4,6-7],但hGM-CSF仅能短期表达,而且腺病毒本身某些抗原的表达也可引起人体免疫反应,效果不甚理想。慢病毒载体是以Ⅰ型人免疫缺陷病毒为基础构建的载体,具有可感染非分裂细胞、目的基因稳定有效整合至反应细胞基因组且长期表达、对宿主细胞的转染率高、免疫反应小等优点是目前最通用且最有效的基因转载工具[12-14]。本实验所构建的慢病毒颗粒滴度达3.2×106IU/ml,对反应细胞的转染率为90%。ELISA检测发现,编码hGM-CSF慢病毒感染后,反应细胞内的hGM-CSF表达量显著提高,且持续表达2个多月。DC细胞内hGM-CSF的持续高水平表达,为DC的递呈作用提供了一个长期有利的局部体液环境,可以增强DC对肿瘤抗原的递呈作用,刺激更多的肿瘤特异性CTL的增殖,达到更好的杀伤肿瘤细胞的作用。MTT检测结果也证实了这一推断,编码hGM-CSF慢病毒感染后,DC疫苗诱导的CTL对肿瘤细胞的杀伤能力得到了显著提高。
我们通过反复冻融人宫颈癌肿瘤细胞来获取可溶性宫颈癌肿瘤抗原,使用这一可溶性肿瘤抗原冲击DC制备DC疫苗,利用编码hGM-CSF的慢病毒颗粒感染部分DC疫苗,与未经感染的DC疫苗进行比较发现,无论是刺激同种T淋巴细胞增殖的能力还是诱导的CTL杀伤宫颈癌肿瘤细胞的能力,编码hGM-CSF的慢病毒感染后的DC疫苗都略胜一筹。提示编码hGM-CSF的慢病毒能够显著提高DC疫苗的抗肿瘤活性,可作为肿瘤生物治疗的有效载体。
[1]Chauvin C,Philippeau J M,He′mont C,et al.Killer dendritic cells link innate and adaptive immunity against established osteosarcoma in rats[J].Cancer Res,2008,68(22):9433-9440.
[2]Sidhu M,Griffiths M M,Bradley D S.Vaccination with collagen-pulsed dendritic cells prevents the onset and reduces the disease severity in the mouse model of spontaneous polychondritis[J].Clin Exp Immunol,2009,157(3):350-351.
[3]Mule′J J.Dendritic cell-based vaccines for pancreatic cancer and melanoma[J].Ann N Y Acad Sci,2009,1174:33-35.
[4]Nencioni A,Grnebach F,Schmidt S M,et al.The use of dendritic cells in cancer immunotherapy[J].Crit Rev Oncol Hematol, 2008,65(3):191-199.
[5]林阿丽,孙青.编码hGM CSF基因的慢病毒包装及表达[J].山东大学学报(医学版),2007,45(6):554-557.
[6]Loudon P T,Yager E J,Lynch D T,et al.GM-CSF increases mucosal and systemic immunogenicity of an H1N1 influenza DNA vaccine administered into the epidermis of non-human primates[J].PLoS One,2010,5(6):e11021.
[7]Westermann J,Hecker A C,Flrcken A,et al.Granulocyte macrophage-colony stimulating factor plus interleukin-2 plus alpha-interferon plus 5-fluorouracil in the treatment of metastatic renalcell cancer:induction of CD80/86+T cells indicates adverse outcome[J].J Immunother,2009,32(6):667-675.
[8]Ohlschlger P,Quetting M,Alvarez G,et al.Enhancement of immunogenicity of a therapeutic cervical cancer DNA-based vaccine by co-application of sequence-optimized genetic adjuvants[J].Int J Cancer,2009,125(1):189-198.
[9]Inoue H,Iga M,Xin M,et al.TARC and RANTES enhance antitumor immunity induced by the GM-CSF-transduced tumor vaccineinamousetumormodel[J].CancerImmunolImmunother,2008, 57(9):1399-1411.
[10]Urdinguio R G,Fernandez A F,Moncada-Pazos A,et al.Immune-Dependentand IndependentAntitumorActivityof GM-CSF Aberrantly Expressed by Mouse and Human Colorectal Tumors[J].Cancer Res,2013,73(1):395-405.
[11]He S,Wang L,Wu Y,et al.CCL3 and CCL20-recruited dendritic cells modified by melanoma antigen gene-1 induce anti-tumor immunity against gastric cancer ex vivo and in vivo[J].J Exp Clin Cancer Res,2010,29:37.
[12]Escors D,Breckpot K.Lentiviral vectors in gene therapy:their current status and future potential[J].Arch Immunol Ther Exp (Warsz),2010,58(2):107-119.
[13]Matrai J,Chuah M K,VandenDriessche T.Recent advances in lentiviral vector development and applications[J].Mol Ther, 2010,18(3):477-490.
[14]Papayannakos C,Daniel R.Understanding lentiviral vector chromatin targeting:working to reduce insertional mutagenic potential for gene therapy[J].Gene Ther,2012,22(10):1038.
Immunocompetence of dendritic cells transfected with lentiviral vector-encoding human granulocyte-macrophage colony-stimulating factor
Objective To construct lentiviral vector encoding human granulocyte-macrophage colony-stimulating factor (hGM-CSF)gene and to investigate the immunocompetence of dendritic cell(DC)vaccine transfected with lenti-hGM-CSF.Methods DNA fragment of hGM-CSF was cloned from the plasmid pORFhGM-CSF with PCR and was inserted into the delivery vector L166 at the restriction nuclease sites BamHⅠand XhoⅠdirectionally to construct the recombinant vector L166-hGM-CSF.The recombinant vector L166-hGM-CSF,packing vector L205 and VSVG L311 were co-transfected into lentivirus packaging cell line 293T,and the lentivirus-produced lenti-hGM-CSF was gained from supernatant after 72h.Cord blood was collected to isolate monocytes which were cultured in medium supplemented with rhGM-CSF,rhIL-4 and α-TNF.Suspending cells were collected to analyze their phenotypes by flow cytometer.Tumor lysate was obtained by rapid freeze/thaw exposures.Dendritic cells pulsed with tumor lysate or dendritic cells pulsed with tumor lysate transfected with lenti-hGM-CSF were co-cultured with T lymphocytes.The killing activity of cytotoxic T lymphocytes(CTLs)activated by these DC vaccines were assayed by MTT method.Results The recombinant vector L166-hGM-CSF was successfully constructed,and human GM-CSF was presented highly in the supernatant of Hela cells transfected with lenti-hGM-CSF.The cytotoxic effects of DC pulsed with tumor lysate were significantly enhanced after transfected with lenti-hGM-CSF.Conclusion GM-CSF DC vaccine has been successfully prepared by trasfection of human GM-CSF to dendritic cells using the lentiviral vector,which demonstrates an enhanced anti-tumor effects in vitro.
Lentivirus VectorGranulocyte-macrophage colony-stimulating factorDendritic cellTumor vaccine

2013-01-29)
(本文编辑:杨丽)
山东省科技发展计划项目(2004GG3202003)
310009 杭州市第三人民医院病理科(林阿丽);山东省千佛山医院病理科(孙青)
孙青,E-mail:qingsw99@sina.com
