大鼠全脑照射后海马区VEGF表达变化及超微结构改变
2013-04-18杨伟芳丁维军孙晓南朱敏杨海华
杨伟芳 丁维军 孙晓南 朱敏 杨海华
●论 著
大鼠全脑照射后海马区VEGF表达变化及超微结构改变
杨伟芳 丁维军 孙晓南 朱敏 杨海华
目的 探讨单次大剂量全脑照射后大鼠海马区血管内皮生长因子(VEGF)表达的变化及其超微结构改变。 方法 以雌性SD大鼠作为研究对象,使用RT-PCR检测全脑照射后大鼠海马区VEGF mRNA的表达变化,电镜观察照射后大鼠海马区神经元线粒体及血管内皮等超微结构改变。 结果 全脑照射后1d大鼠海马区VEGF mRNA表达出现短暂下降,放疗后1、2、4和8周时VEGF mRNA表达水平与对照组比较均无统计学差异(均P>0.05)。20Gy放疗后4周,大鼠海马区神经元出现线粒体水肿,空泡形成;毛细血管内皮间隙增加,管腔狭窄。结论 VEGF参与大鼠脑部放疗后损伤应答反应,这可能为将来的脑损伤防护提供新的靶点。
血管内皮生长因子 海马 脑损伤 放射疗法 大鼠 电子显微镜
随着肿瘤治疗的快速发展,患者生存期延长,放射治疗后脑损伤等问题日益突出,严重影响患者生活质量。放射性脑损伤与脑水肿、血脑屏障破坏等密切相关。海马是认知、学习的关键部位,在认知发展过程中发挥重要作用,而血管内皮生长因子(vascular endothelial growth factor,VEGF)可通过调节海马区血管、神经形成从而增强学习和记忆能力[1],具有一定的神经保护作用。本研究通过观察放疗后大鼠海马区VEGF mRNA的表达变化,并利用电子显微镜观察该区神经元线粒体及血管内皮细胞形态变化,以探讨海马区在放射性脑损伤导致的认知功能障碍发病过程中的病理改变及部分分子基础。
1 材料和方法
1.1 材料 SPF级健康雌性SD大鼠共36只,6~8周龄,体重(200±10)g,由浙江大学医学院实验动物中心提供,饲养于温州医科大学附属台州医院公共科研平台动物房IVC独立通风系统。TRIzol购于美国Invitrogen公司,随机引物、M-MuLV逆转录酶、Taq DNA聚合酶等购自上海吉瑞公司。
1.2 动物分组与全脑照射 按简单随机法将大鼠分为全脑照射后1d、1、2、4和8周及对照6个组别,每组各6只。单次全脑照射方法:大鼠经3.6%水合氯醛(1ml/100g)腹腔注射麻醉后,俯卧于西门子加速器床板(西门子KD2型),应用加速器产生的6mV-X线(剂量率200~210cGy/min),源皮距100cm。照射野3cm× 2cm,上界位于双眼后眦连线,下界位于双耳后连线,左右露空。用1cm厚的组织补偿物覆盖照射野,铅块屏蔽双眼、颈部及胸腹部。参考深度为1.5cm,照射总剂量20Gy[2]。
1.3 标本制作及海马区VEGF mRNA检测 全脑照射后1d、1、2、4和8周,各组大鼠经3.6%水合氯醛(1ml/100g)腹腔注射麻醉后开胸,0.9%氯化钠溶液250ml灌洗后,完整取脑,分离海马区脑组织,液氮速冻研磨成粉后,TRIzol抽提总RNA。引物序列:VEGF上游引物5′-CAC TGG ACC CTGGCT TTA CT-3′,下游引物5′-TGC TGGCTT TGGTGA GGT T-3′,扩增片段长458 bp。RT-PCR检测VEGF mRNA的表达:在提取的总RNA中加入随机引物及M-MuLV逆转录酶合成cDNA链。取cDNA 0.1μg,加入10×Buffer 2.5μl,25mmol/L MgCl21μl,10mmol/L dNTP 0.5μl,20pmol/μl的上下游引物各0.5μl,TaqDNA聚合酶0.5μl,灭菌双蒸水将反应体系补足至25μl。于Thermo PX2型PCR仪进行扩增,以β-actin作为内参照。反应条件为:95℃预变性2min;94℃变性45s,61℃复性1min,72℃延伸1min,35个循环,最后延伸10min。扩增产物行1.7%琼脂糖凝胶电泳,于BIO-RAD Gel 2000凝胶成像仪上成像,Quantity One软件作半定量分析,记录每条目的条带灰度值与内参的比值。
1.4 电镜观察 大鼠全脑照射后4周,3.6%水合氯醛(1ml/100g)腹腔注射麻醉后开胸,0.9%氯化钠溶液250ml灌洗后,完整取脑,切取1mm×2mm的海马区脑组织条,以2.5%戊二醛前固定,l%锇酸后固定,乙醇丙酮系列梯度脱水后Epon 812包埋,超薄切片机切片,铀铅染色,H-600A-2透射电镜下观察并摄片。
1.5 统计学处理 应用SPSS 11.5统计软件。计量资料以表示,组间比较采用单因素方差分析。
2 结果
2.1 各组大鼠海马区VEGF mRNA的表达 与对照组比较,全脑照射后1d大鼠海马区VEGF mRNA表达出现短暂下降(0.782±0.065 vs 0.570±0.044,P<0.01),而放疗后1、2、4和8周时VEGF mRNA表达水平分别为0.797±0.055、0.657±0.065、0.844±0.058 和 0.669± 0.061,与对照组比较均无统计学差异(均P>0.05),见图1。
2.2 各组大鼠海马神经元超微结构变化 全脑照射后4周,大鼠海马区神经元出现线粒体水肿,空泡形成;毛细血管内皮细胞间隙增宽,血管周围间隙扩大,血管管壁增厚,管腔狭窄,见图2。
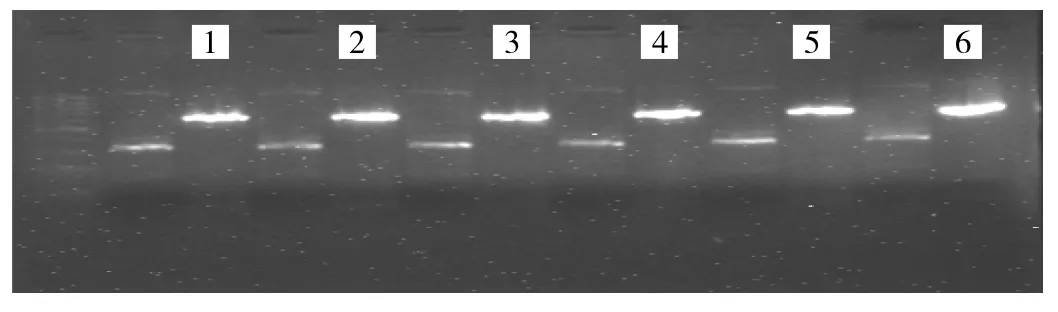
图1 各组大鼠海马区VEGF mRNA的表达(1:对照组;2~6分别为照射后1d、1、2、4和8周)
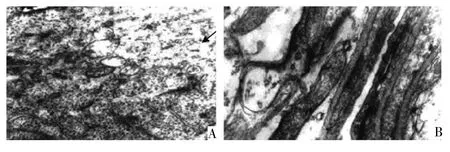
图2 全脑照射后4周大鼠海马神经元超微结构变化(A:线粒体水肿,空泡形成(箭头所示),×20 000;B:血管内皮细胞间隙增宽,管腔狭窄,×40 000)
3 讨论
对位于脑、脊髓及其邻近部位肿瘤的患者来说,放射性脑损伤是主要的放疗不良反应[3]。放射性脑损伤根据出现时间分为急性期损伤和迟发性反应。急性期损伤多发生于中枢神经系统单次大剂量照射后24h以内,血脑屏障破坏和脑水肿是主要病理基础。迟发性反应形态学改变包括毛细血管扩张、膨胀、血管壁透明化、血管壁增厚和纤维坏死等。全脑照射后的认知障碍与海马区神经再生功能受损有关[4]。
VEGF也被称为血管渗透因子,它是血管形成的关键调节因子,也是强有力的内皮细胞有丝分裂原,可促进细胞生长和血管形成,与脑损伤、血脑屏障功能破坏等相关。研究报道其具有神经保护活性,可调节新生血管,影响海马区神经形成从而增强学习和记忆能力[1]。脑损伤时内源性VEGF信号途径是细胞生存所必需的,VEGF抑制可减少细胞增殖,增加细胞死亡。内源性VEGF在促进脑损伤后星形细胞的存活和增殖中起重要作用[5]。大鼠创伤性脑损伤模型中,海马区VEGF表达水平在脑外伤后12h出现升高,7d时达峰值。随着VEGF表达水平的升高,海马区神经元形成亦增加,而VEGF抑制则减少了海马区神经元形成[6]。大鼠蛛网膜下腔出血后24h海马区VEGF表达升高伴有凋亡发生[7]。而肺炎球菌脑膜炎模型中,VEGF水平明显下降[8]。因此,不同的损伤类型中VEGF表达变化可能存在差异。电离辐射既可激发内皮细胞凋亡致早期血脑屏障破坏,引起急性期放射性脑损伤,也可通过诱导基因表达改变、促使乏氧微环境形成等导致迟发性反应。乏氧可诱导VEGF产生,而VEGF可使血管渗透性增高,从而形成恶性循环。VEGF还可通过影响细胞间黏附分子1(ICAM-1)和紧密连接蛋白的表达从而破坏血脑屏障的完整性,导致血脑屏障破坏,引起迟发性反应[1]。
本研究中,海马区VEGF mRNA表达在放射后早期存在短暂下降,证实其参与海马区急性期放射性脑损伤应答。电镜显示全脑照射后4周时海马区神经元出现线粒体水肿、空泡形成,合并海马区毛细血管内皮细胞间隙增宽、管腔狭窄等迟发性反应病理改变,但海马区VEGF mRNA表达在放射后4、8周时与对照组无统计学差异。因此,海马区VEGF mRNA水平是否与放射性迟发性反应相关尚需进一步研究明确,其对海马区ICAM-1表达的影响将在后续研究中进一步报道。
Nordal等[9]研究报道,与野生型和VEGF高表达的小鼠相比,VEGF低表达的小鼠在放射后更具有神经保护作用,且其出现虚弱、瘫痪的时间间隔相对延长。早期抑制VEGF可以通过降低血管渗透性从而减少放射性坏死的发生[10]。本研究中放射后1d内海马区的VEGF mRNA表达水平短暂下降是否是体内的一种自我保护机制尚不明确。与上述报道相反,亦有研究显示VEGF可能具有神经保护作用。研究报道低剂量放疗后海马颗粒层细胞VEGF表达下降,并对海马区神经元形成产生长时间的抑制作用,与长时间的行为缺陷相关。Wong-Goodrich等[11]研究亦显示,全脑照射后每日跑步可以通过上调海马区脑源性VEGF表达减轻放疗后空间记忆功能的下降。本研究中全脑照射后早期海马区VEGF mRNA表达水平短暂下降是否与脑功能缺陷相关尚需进一步研究明确。
综上所述,本研究表明大剂量全脑照射后急性期内,海马区VEGF mRNA表达水平出现短暂下降,而照射后1、2、4和8周时VEGF mRNA表达水平恢复正常。说明VEGF参与大鼠全脑照射后海马区的急性期放射损伤应答,它可能是体内的损伤后自我保护机制,亦可能影响海马区的神经元形成,具体作用尚需进一步研究明确。照射后4周海马区存在神经元线粒体水肿、血管内皮间隙扩大等形态学改变,可能是放射治疗后认知功能障碍的病理学基础。VEGF的早期变化是否与晚期损伤直接相关尚需进一步研究明确,通过不同时相对VEGF的干预能否影响海马区的神经形成及功能将为放射性脑损伤的防护提供新的依据。
[1]Hawkins B T,Sykes D B,Miller D S.Rapid,reversible modulation of blood-brain barrier P-glycoprotein transport activity by vascular endothelial growth factor[J].J Neurosci,2010,30(4):1417-1425.
[2]Liu Y,Xiao S,Liu J,et al.An experimental study of acute radiation-induced cognitive dysfunction in a young rat model[J].AJNR Am J Neuroradiol,2010,31(2):383-387.
[3]Nordal R A,Wong C S.Molecular targets in radiation-induced blood-brain barrier disruption[J].Int J Radiat Oncol Biol Phys, 2005,62(1):279-287.
[4]Rola R,Raber J,Rizk A,et al.Radiation-induced impairment of hippocampal neurogenesis is associated with cognitive deficits in young mice[J].Exp Neurol,2004,188(2):316-330.
[5]Schmid-Brunclik N,Burgi-Taboada C,Antoniou X,et al.Astrocyte responses to injury:VEGF simultaneously modulates cell death and proliferation[J].Am J Physiol Regul Integr Comp Physiol,2008,295(3):R864-R873.
[6]Lu K T,Sun C L,Wo P Y,et al.Hippocampal neurogenesis after traumatic brain injury is mediated by vascular endothelial growth factor receptor-2 and the Raf/MEK/ERK cascade[J].J Neurotrauma,2011,28(3):441-450.
[7]Ostrowski R P,Colohan A R,Zhang J H.Mechanisms of hyperbaric oxygen-induced neuroprotection in a rat model of subarachnoid hemorrhage[J].J Cereb Blood Flow Metab,2005,25(5): 554-571.
[8]Paul R,Angele B,Popp B,et al.Differential regulation of blood-brain barrier permeability in brain trauma and pneumococcal meningitis-role of Src kinases[J].Exp Neurol,2007,203(1): 158-167.
[9]Nordal R A,Nagy A,Pintilie M,et al.Hypoxia and hypoxia-inducible factor-1 target genes in central nervous system radiation injury:a role for vascular endothelial growth factor[J].Clin Cancer Res,2004,10(10):3342-3353.
[10]Matuschek C,Bolke E,Nawatny J,et al.Bevacizumab as a treatment option for radiation-induced cerebral necrosis[J].Strahlenther Onkol,2011,187(2):135-139.
[11]Wong-Goodrich S J,Pfau M L,Flores C T,et al.Voluntary running prevents progressive memory decline and increases adult hippocampal neurogenesis and growth factor expression after whole-brain irradiation[J].Cancer Res,2010,70(22):9329-9338
Changes of VEGF expression and ultrastructure in hippocampus of adult rats after whole-brain irradiation
Objective To investigate the changes of VEGF expression and ultrastructure in hippocampus of adult rats after whole-brain irradiation.Methods The whole brain of female Sprague-Dawley rats was irradiated by 20Gy 6mV X-ray.The expression of VEGF mRNA in hippocampus tissue before and 1d,1,2,4,8w after ionizing radiation was detected by RT-PCR.The ultra-structural changes of hippocampus were observed by electronic microscope.Results RT-PCR showed a transient decrease in VEGF mRNA expression within 1d after exposure to a single dose of 20Gy 6mV X-ray ionizing radiation;however,there were no differences in VEGF mRNA expression at 1,2,4,8w after ionizing radiation when compared to controls(P>0.05).Neuronal mitochondria edema,vacuolization,endothelial gap increase and lumen narrow were demonstrated by electron microscope at 4w after whole brain irradiation.Conclusion VEGF may be involved in early radiation-induced damage in the hippocampus, which indicates that VEGF might be a novel target for prevention of radiation-induced brain injury.
VEGF Hippocampus Brain injury Radiation RatElectron microscopy

2012-12-17)
(本文编辑:胥昀)
浙江省自然科学基金项目(Y2110739)
317000 台州,温州医科大学附属台州医院放疗科(杨伟芳、丁维军、杨海华),公共科研平台(朱敏);浙江大学医学院附属邵逸夫医院放疗科(孙晓南)
丁维军,E-mail:dingwj@enzemed.com
