水杨酸钠注射后大鼠听觉通路突触素表达的变化
2013-04-18朱艳双赵德安
朱艳双 赵德安
水杨酸钠注射后大鼠听觉通路突触素表达的变化
朱艳双 赵德安
目的 检测水杨酸钠注射后大鼠耳蜗核、上橄榄核、下丘脑及听皮层突触素表达的变化,探讨听觉通路的可塑性变化与耳鸣发病机制的关系。 方法 将36只大鼠随机分为6组(每组6只):按照注射药物时间长短的不同分为Ⅰ、Ⅱ组,其中Ⅰ组注射药物时间为14d,Ⅱ组注射药物时间为21d(空白对照组不注射药物);两组又各自分为A、B、C 3个亚组,其中A组为水杨酸钠组,B为0.9%氯化钠溶液组,C为空白对照组。ⅠA组:每次条件反射训练前3h腹腔注射10%水杨酸钠溶液(350mg/kg),至实验结束;ⅠB组:每次条件反射训练前3h腹腔注射同体积0.9%氯化钠溶液,至实验结束;ⅠC组:饲养在安静环境中,不限饮食,不注射药物,不进行条件反射训练;ⅡA、ⅡB、ⅡC组的分组方法同前。应用免疫组化技术检测各组大鼠听觉通路中4个核团突触素表达的情况。 结果 早期耳鸣组(ⅠA)与持续耳鸣组(ⅡA)同其余组大鼠相比,耳蜗核、上橄榄核、下丘脑、听皮层突触素的表达都明显增多(均P<0.01);且ⅡA组各核团中突触素的表达均较ⅠA组增多(均P<0.01)。结论 水杨酸钠注射可成功建立大鼠耳鸣模型,耳鸣大鼠听觉通路突触素表达的改变为耳鸣的中枢源性学说提供了部分理论依据。
水杨酸钠 耳鸣 神经可塑性 突触素 听觉核团
既往学者多认为耳鸣产生于外周听觉感受器,但是近年来越来越多的研究证明耳鸣是在听觉中枢部位产生[1]。因水杨酸可引起可逆性的耳鸣及听力损失,故现已成为常用诱发药物广泛应用于与耳鸣相关的基础研究中。研究表明,水杨酸钠能引起动物听觉通路上神经元电活动及各种神经递质和受体的一系列改变,故推测听觉系统发生功能重组或可塑性变化,是耳鸣产生与维持的主要原因。突触素(synaptophysin,SYN)是一种与突触功能密切相关的膜蛋白,相对分子量为38 kd,英文缩写可为p38、SYP或SYN,1985年由Jahn等[2]年首先从大鼠脑突触囊泡中提取。它广泛存在于机体所有神经末梢,特异性地分布于突触前膜囊泡上,与神经生长、修复、再生和突触重建密切相关。在突触重建时,SYN的表达明显增多,因此SYN和神经可塑性密切相关,可作为中枢神经系统活性的指标。
本研究通过注射水杨酸钠建立大鼠耳鸣模型,检测大鼠听觉通路中4个核团SYN表达的变化,分析水杨酸钠对听觉通路神经元可塑性变化的影响,并探讨耳鸣产生的中枢源性机制。
1 材料和方法
1.1 实验动物 选用2~3月龄、健康、耳廓反应灵敏、无中耳感染、无强噪声暴露及耳毒性药物使用史,体重200~250g的雄性Wistar大鼠36只,由上海斯莱特实验动物中心提供。
1.2 主要仪器和试剂 水杨酸钠购于AMRESCO公司,小鼠抗大鼠SYN抗体(一抗)购于武汉博士德公司,即用型SP染色试剂盒(内含5%BSA封闭液、二抗及SABC)购于福州迈新生物技术公司,10%水合氯醛溶液及40g/L多聚甲醛溶液均来自厦门大学附属第一医院制剂室。
1.3 耳鸣动物模型建立与分组 参照贾明辉等[3]的方法,建立耳鸣动物行为学模型。将干渴的大鼠置于有背景白噪声的隔声室内反复进行条件反射训练,在关闭背景噪声后即于大鼠嘴部给予电刺激,使动物将耳内声音的有无与安全与否联系起来,形成“背景噪声停止-舔水减少或停止”的条件反射。于厦门大学附属第一医院隔声室适应性喂养1周后按照纸袋抽签法将大鼠随机分为6组。ⅠA组:早期耳鸣组,在条件反射建立前每次训练前3h腹腔注射10%水杨酸钠溶液(350mg/kg)直至实验结束;ⅠB组:早期0.9%氯化钠注射液对照组,在条件反射建立前每次训练前3h腹腔注射同体积0.9%氯化钠注射液,直至实验结束;ⅠC组:早期空白对照组,大鼠饲养在安静的环境中,不限饮食、不注射药物,不进行条件反射训练,直至与ⅠA组、ⅠB组一同断头取标本。ⅠA组和ⅠB组动物共注射药物14d。ⅡA组:持续耳鸣组,在条件反射建立前每次训练前3h腹腔注射10%水杨酸钠溶液(350mg/kg),直到耳鸣模型建立成功后,每天同一时间腹腔继续注射同体积水杨酸钠7d;ⅡB组:持续0.9%氯化钠注射液对照组,在条件反射建立前每次训练前3h腹腔注射同体积0.9%氯化钠注射液,直到条件反射消退后,继续每天同一时间继续腹腔注射同体积0.9%氯化钠注射液7d;ⅡC组:持续空白对照组。饲养在安静环境中,不限饮食、不注射药物,不进行条件反射训练,直至与ⅡA、ⅡB组一同断头取标本。ⅡA组和ⅡB组动物共注射药物21d。
1.4 取材及免疫组织化学染色
1.4.1 心脏灌注及组织切片 最后1次注射药物后3h,予10%水合氯醛(0.4ml/kg)腹腔内注射麻醉,自左心室向外主动脉插管,快速注入0.9%氯化钠溶液200ml冲出血液后切开右心房,再以40g/L多聚甲醛液400ml灌注固定,待大鼠出现四肢抖动、强直、头向后仰似角弓反张时迅速断头取脑。根据大鼠脑立体定位图谱[4]分别切取含听皮层、下丘、上橄榄核、耳蜗核的脑组织,多聚甲醛固定过夜,经脱水、透明、浸蜡包埋后,连续4μm冠状位切片,用于免疫组化染色。
1.4.2 SYN免疫组化检测 切片常规脱蜡至水化,柠檬酸缓冲液高温高压抗原修复后加入3%过氧化氢灭活10min,PBS洗涤3min×3次后滴加5%BSA,室温放置20min后,滴加一抗室温下湿盒内孵育1h,PBS洗涤3次后滴加二抗,室温下湿盒内孵育20min,PBS洗涤3次后滴加SABC,室温下孵育20min,PBS洗涤3次后加入100μl新鲜配制的DAB显色液,显微镜下观察3~10min;自来水冲洗,苏木素复染,脱水、透明,中性树胶封片。SYN表达阳性的神经元轴突终末为棕黄色,在光镜下呈点状或颗粒状分布。
1.4.3 图像采集分析 以图像分析系统测定特异性免疫反应产物的平均光密度值(average optical density, AOD)来反映突触数量的变化[5]。Olympus显微摄像系统在同一光强度、同一放大倍数下采集图片。每个标本取2张切片,每张切片随机取5个非重叠视野,采用IPP6.0软件进行分析,最后取5个数值的平均值为每张切片的AOD。计算每组大鼠各个听觉通路核团:听皮层、下丘脑、上橄榄核和耳蜗核的AOD。
1.5 统计学处理 采用SPSS17.0统计软件。计量资料以表示,多组间比较采用单因素方差分析,再用LSD-t检验进行两两比较。
2 结果
2.1 建模结果 ⅠA、ⅡA组大鼠条件反射消退时间分别为(5.67±0.82)、(6.00±0.63)d;ⅠB、ⅡB组分别为(4.00±0.89)、(4.17±0.75)d,ⅠA、ⅡA组与ⅠB、ⅡB组比较均有统计学差异(均P<0.01),说明ⅠA和ⅡA组大鼠耳鸣模型造模成功。
2.2 免疫组化检测 结果提示SYN在各组大鼠各个核团中均有表达,各组AOD见表1。
由表1可见,ⅠA组、ⅡA组同对照组(B、C组)大鼠相比,耳蜗核、上橄榄核、听皮层、下丘脑SYN的表达均明显增多(均P<0.01);且在各核团中ⅡA组均比ⅠA组增多(均P<0.01);B、C组间各核团表达无统计学差异(P>0.05)。
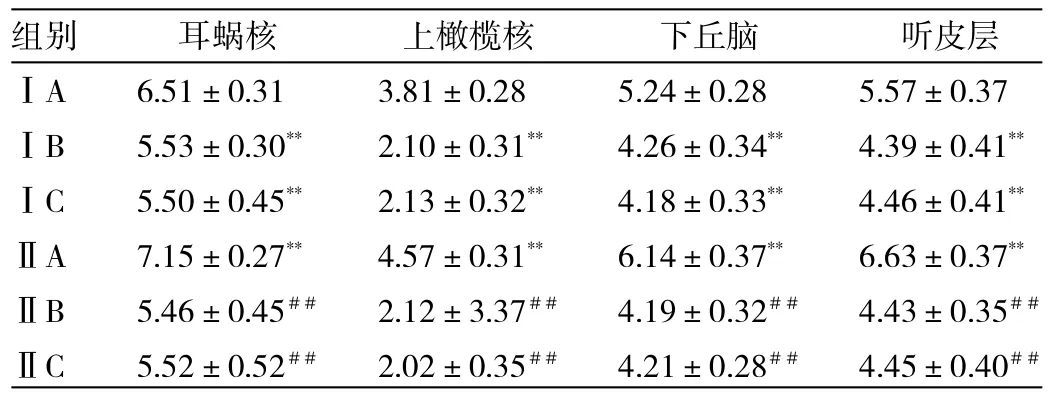
表1 各组大鼠各个核团中SYN的表达情况(AOD)
3 讨论
SYN作为突触前终末特异性标记物,目前常用来反映突触的密度、分布及突触重建。检测SYN含量变化是监测神经系统突触形成及其功能状态的方法之一,广泛用于衰老、痴呆、脑缺血、癫痫、神经发育及动物模型等研究[6-9]。近年来,SYN也被应用于听觉系统的相关研究。国外学者对大鼠单侧耳蜗切除或噪音暴露后耳蜗核、下丘中央核、上橄榄核SYN的表达变化进行了研究[10-12],国内也有学者探索了双侧耳蜗毁损后大鼠听皮层SYN表达的改变[13]。研究表明,去传入后听觉核团(耳蜗核、上橄榄核、下丘脑、听皮层)中SYN的表达都发生了显著的改变,说明由耳蜗切除所致的去传入支配,会导致突触发生一系列形态学、生理学及代谢等方面的变化,包括突触变性、蛋白合成、突触重建、由于纤维变性导致的轴突消减以及轴突萌芽[14-16]。
目前国内外尚未见到SYN与耳鸣相关性的研究,本研究结果可以说明以下几点:(1)耳鸣组大鼠(ⅠA、ⅡA)的耳蜗核、上橄榄核、下丘脑、听皮层中,SYN表达比对照组(B组和C组)均明显增多,这表明在耳鸣动物中听觉中枢的各核团的SYN表达发生了改变,也就是说耳鸣大鼠听觉通路发生了突触重建,突触功能活跃。由于突触重建导致听觉中枢形成了一些异常的突触连接,从而导致神经元放电的增多和异常,这就可能导致了大鼠耳鸣。(2)ⅡA组大鼠SYN的表达较ⅠA组增多,说明随着水杨酸钠注射时间的延长,剂量的增加,听觉中枢突触重建增多。有关研究表明,临床上患者服用阿斯匹林几天后即可能出现耳鸣,随服用时间延长,耳鸣响度持续[17]。大鼠的行为实验也提供了给药几天后存在耳鸣的依据,并随给药时程延长耳鸣响度增加[18]。黄治物等[19]的研究中也观察到长期注射水杨酸盐后出现耳蜗神经活动的平均谱上升,且随注射期延长逐渐增加。因此笔者推测耳鸣的严重程度随着水杨酸盐的使用剂量的增加而增加,其原因可能是随着注射水杨酸钠剂量的增加,听觉中枢突触重建增多因而加重神经元异常放电,突触的重建可能是耳鸣维持并加重的原因。(3)与空白对照组相似,0.9%氯化钠溶液组大鼠SYN表达水平在四个核团中无统计学差异,这说明限食、条件反射、嘴部电击等这些非特异的环境因素并不能对大鼠听觉通路中SYN的表达造成影响。
综上所述,水杨酸钠注射后大鼠听觉通路(耳蜗核、上橄榄核、下丘脑、听皮层)SYN表达明显升高,说明水杨酸钠能够诱导耳鸣,并引起听觉通路的神经元重塑,说明耳鸣与听觉通路重塑密切相关,为听觉通路可塑性在耳鸣的发生机制中的作用提供了一个理论依据。
[1]Kaltenbach A J,Zhang J,Finlayson P.Tinnitus as a plastic phenomenon and its possible neural underpinnings in the dorsal cochlear nucleus[J].Hear Res,2005,206(1-2):200-226.
[2]Jahn R,Schiebler W,Quimet C,et al.A 38,000 dalton membraneprotein(p38)present in synaptic vesicles[J].Proc Natl Acad Sci USA,1985,82(12):4137-4141.
[3] 贾明辉,秦兆冰.耳鸣动物行为学模型的制作[J].听力学及言语疾病杂志,2007,15(1):73-75.
[4]Paxinos.大鼠脑立体定位图谱[M].诸葛启钏,主译.北京:人民卫生出版社,2005:15-35.
[5]Huang X,Chen S,Tietz E.Immunocytochemical detection of regional protein changes in rat brain sections using computerassisted image analysis[J].J Histochem Cytochem,1996,44(9): 981-987.
[6] 王建平,曹亚芹,苏怡凡,等.癫痫幼鼠海马和颞叶皮质区缝隙连接蛋白43和突触体素表达的变化[J].中国实用神经疾病杂志,2008,11(9): 9-11.
[7] 邹伟,陈冬冬,王红霞,等.衰老大鼠学习行为与海马突触相关蛋白表达的研究[J].辽宁师范大学学报(自然科学版),2009,32(2):227-230.
[8]赵源征,刘其强,白宏英,等.大鼠脑缺血再灌注后海马CA1区AS与Syp相关性分析[J].中国实用神经疾病杂志,2008,11(4):51-53.
[9] 石广滨,张昱,于明.胰岛素样生长因子1对痴呆模型大鼠学习记忆能力及突触素表达的影响[J].中国临床康复,2006,10(2):79-81.
[10]Alvarado J C,Fuentes-Santamaria V,Franklin S R,et al.Synaptophysin and Insulin-like growth factor-1 Immunostaing in the central nucleus of the inferior colliculus in adult ferrets following unilateral cochlear removal:A densitometric analysis[J].Synapse, 2007,61(5):288-302.
[11]Benson C G,Gross J S,Suneja S J,et al.Synaptophysin immunoreactivity in the cochlear nucleus after unilateral cochlear or ossicular removal[J].Synapse,1997,25(3):243-257.
[12]Fuentes-Santamaria V,Alvarado J C,Henkel C K,et al.Cochlear ablation in adult ferrets results in changes in insulin-like growth factor-1 and synaptophysin immunostaining in the cochlear nucleus[J].Neuroscience,2007,148(4):1033-1047.[13] 李孟,华清泉,廖华,等.双侧耳蜗毁损后大鼠听皮层突触素表达的变化[J].听力学及言语疾病杂志,2008,16(6):495-498.
[14]Alvarado J C,Fuentes-Santamaria V,Franklin S R,et al.Unilateral cochlear ablation in adult ferrets results in upregulation in calretinin immunostaining in the central nucleus of the inferior colliculus[J].Neuroscience,2005,136(3):957-969.
[15]Illing R B,Kraus K S,Michler S A.Plasticity of the superior olivary complex[J].Microsc Res Technol,2000,51(4):364-381.
[16]Syka J.Plastic changes in the central auditory system after hearing loss,restoration of function,and during learning[J]. Physiol Rev,2002,82(3):601-636.
[17]Cazals Y.Auditory sensori-neural alterations induced by salicylate[J].Prog Neurobiol,2000,62(6):583-631.
[18]McMahon C M,Patuzzi R B.Spectral peaks in spontaneous and sound evoked cochlear electrical activity and tinnitus[A].In: Patuzzi R.eds.Proceedings VIIth International Tinnitus Seminar [M].Perth:University of Western Australia,2002:34-38.
[19] 黄治物,陈平,吴展元,等.实验性耳鸣动物模型的建立[J].中国病理生理杂志,2004,20(12):2363-2364.
Expression of snaptophysin in rat auditory pathway after sodium salicylate injection
Objective To investigate the expression of synaptophysin in cochlear nucleus,superior olivary nucleus,inferior colliculus and auditory cortex of rats after salicylate injection.Methods Thirty-six Wistar rats were randomly divided into 3 groups:rats in group A received intraperitoneal(i.p)infection of 350 mg/kg sodium salicylate 3h before conditioned response training,while rats in group B received i.p injection of normal saline 3h before conditioned response training,and no conditioned response training and drug injection was given to animals in group C(blank control);the animals were further divided into 6 subgroups(n=6,in each subgroup):AI,BI and CI subgroups received treatment for 7d,subgroups AII,BII and CII for 14d.Samples were collected after animals were sacrificed,the expression of synaptophysin in rat cochlear nucleus,superior olivary nucleus,inferior colliculus and auditory cortex were detected by immunohistochemical technique. Results The expressions of synaptophysin in cochlear nucleus,superior olivary nucleus,hypothalamus and auditory cortex in group A were significantly higher than those in groups B and C(P<0.01),and the expression of synaptophysin inⅡA group was higher than that inⅠA group in auditory pathway tested(P<0.01).Conclusion The tinnius model can be established by injection of sodium salicylate in rats,and the alteration of synaptophysin expression in auditory nucleus provides a experimental basis for the central source of tinnius.
Sodium salicylate Tinnitus Neuronal plasticity Synaptophysin Auditory nuclei
2012-11-13)
(本文编辑:胥昀)
361003 厦门大学附属第一医院耳鼻咽喉头颈外科(朱艳双系硕士研究生,现在义乌市中心医院耳鼻咽喉科工作)
朱艳双,E-mail:502127584@qq.com
