SKP2和p27kip1在放疗后鼻咽癌CNE2细胞应答中的作用
2013-04-18杨伟芳孙晓南丁维军
杨伟芳 孙晓南 丁维军
●论 著
SKP2和p27kip1在放疗后鼻咽癌CNE2细胞应答中的作用
杨伟芳 孙晓南 丁维军
目的 探讨SKP2、p27kip1及细胞周期阻滞在放疗后鼻咽癌细胞应答中的作用。 方法 以人鼻咽低分化鳞癌CNE2细胞株作为研究对象,流式细胞仪检测放疗前后细胞周期变化,West blot检测放疗前后不同时间点SKP2及p27kip1表达的变化。 结果 放疗后鼻咽癌CNE2细胞株出现G2/M期细胞周期阻滞,低剂量(2Gy)放疗后0.5~1.5h出现SKP2表达短暂下降,同时伴p27kip1表达相应增高;放疗后4h出现SKP2表达升高而p27kip1表达下调。高剂量(6Gy)放疗后1.5h内出现SKP2表达升高,而放疗后2~4h表达下降;而p27kip1表达在放疗后0.5h出现短暂下降,1.5~4h表达上调,两者之间关联性不确定。 结论 SKP2、p27kip1和细胞周期阻滞参与放疗后鼻咽癌CNE2细胞的应答反应,且低剂量放疗时,p27kip1表达可能受SKP2调控。
SKP2 p27kip1鼻咽癌 放射疗法 细胞周期
鼻咽癌是东南亚及我国南方各省的常见病、多发病。放疗是鼻咽癌的基本治疗手段,但放疗后局部复发及远处转移仍是影响生存的主要因素。因此,对放疗后细胞应答机制的研究可能为鼻咽癌的治疗带来新的希望。S期激酶相关蛋白2(S-phase kinase-associated protein 2,SKP2)是泛素连接酶复合体(skp1/cullin/F-box,SCF)的关键组成成分,对细胞衰老、自噬、凋亡及DNA修复、放射敏感性、肿瘤形成、转移等过程均有一定的调节作用[1-5],有可能成为新的肿瘤治疗靶点[6]。本实验以鼻咽癌CNE2细胞为对象,研究SKP2、p27kip1及细胞周期阻滞在癌细胞放疗后应答中的作用。
1 材料和方法
1.1 细胞培养 人鼻咽癌CNE2细胞株购自中山大学细胞库,在含10%胎牛血清的RPMI 1640培养基中,37℃,5%CO2条件下培养。
1.2 主要仪器及试剂 RPMI 1640培养基、胎牛血清为美国Hyclone公司产品。SKP2和p27kip1抗体购自美国Cell Signaling公司。GAPDH抗体购自杭州贤至生物科技有限公司。RIPA裂解液和BCA蛋白浓度测定试剂盒为美国Pierce公司产品。化学发光检测系统ECL KIT由GE Healthcare公司生产。Cell cycle staining solution为联科生物公司产品。流式细胞仪为BD公司产品,直线加速器为西门子公司产品,型号Mevatron KD-2。
1.3 流式细胞仪检测细胞周期 在6Gy放疗后0、6、12及24h分别收集约1×106个细胞,1 000r/min离心5min,弃去上清液,洗涤2次,加入-20℃70%冰乙醇2ml混匀固定,-20℃放置48h以上。检测时,离心后弃乙醇,PBS洗涤2次,每106细胞中加入0.5ml PI染液,室温避光染色30min,流式细胞仪检测,Modifit Lt软件进行细胞周期分析。
1.4 West blot检测SKP2及p27kip1蛋白表达 在放疗(2Gy或6Gy)后0、0.5、1.5、2、4h收集CNE2细胞,提取细胞总蛋白并测定蛋白浓度,各组取60μg蛋白上样,10%聚丙烯酰胺凝胶电泳分离后转膜,室温封闭2h后,分别用SKP2、p27kip1及GAPDH抗体室温孵育2h(均为1∶1 000稀释),HRP标记的二抗室温孵育1h,ECL避光显影定影,结果采用Quantity One软件进行半定量分析。1.5 统计学处理 采用SPSS13.0统计软件,计量资料多组间比较采用方差分析,多组间率的比较采用χ2检验,相关关系分析采用线性相关分析。
2 结果
2.1 CNE2细胞在6Gy放疗后细胞周期变化 CNE2细胞在6Gy放疗后出现G1期细胞比例下降,而S、G2/ M期细胞比例升高。放疗前和放疗后6、12、24h的G1、S和G2/M期细胞比例分别为73.46%、14.23%、12.31%;61.83%、20.11%、18.07%;62.20%、22.59%、15.20%和52.23%、27.16%、20.61%,组间比较均有统计学差异(均P<0.05),见图1。
2.2 CNE2细胞放疗后SKP2和p27kip1表达的变化
2.2.1 低剂量放疗后SKP2和p27kip1表达的变化 低剂量(2Gy)放疗后0.5~1.5h出现SKP2表达短暂下降,伴p27kip1表达相应增高,放疗后4h出现SKP2表达升高伴p27kip1表达下调。放疗前后不同时间点SKP2和p27kip1表达存在差异,且两者呈负相关(r=-0.9478,P<0.05)。
2.2.2 高剂量放疗后SKP2和p27kip1表达的变化 高剂量(6Gy)放疗后1.5h内出现SKP2表达升高,而2~4h后SKP2表达下降;而p27kip1在放疗后0.5h出现短暂下降,1.5~4h后表达上调。放疗后不同时间点SKP2和p27kip1表达也存在差异,但两者之间无明确相关关系(r=-0.5863,P>0.05),见图2,图内数据为半定量结果。
3 讨论
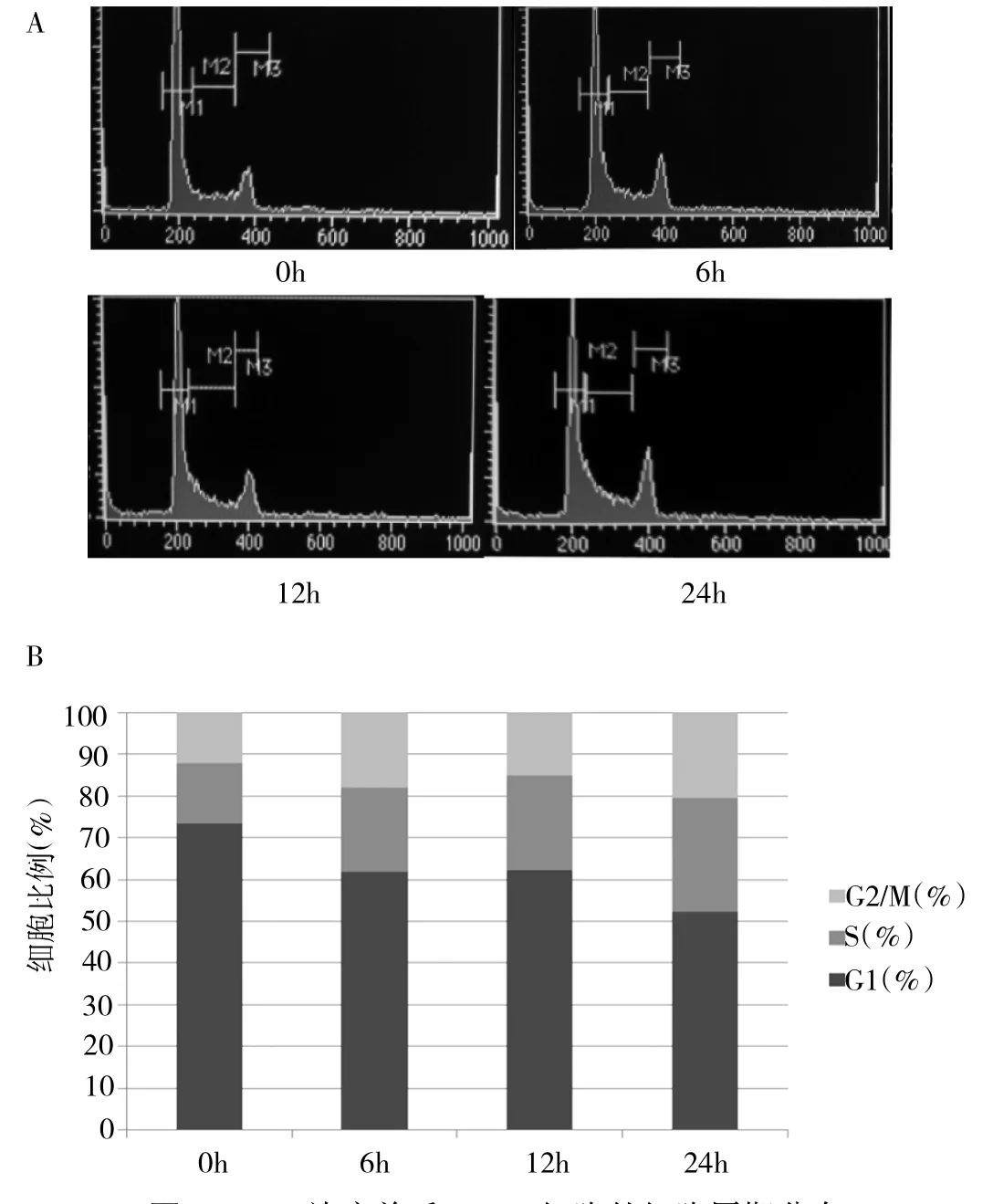
图1 6Gy放疗前后CNE2细胞的细胞周期分布
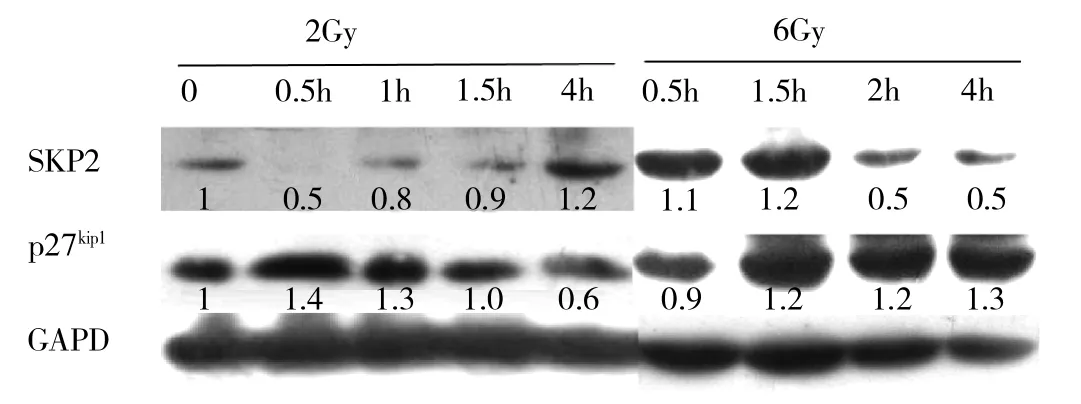
图2 CNE2细胞放疗后SKP2及p27kip1表达变化
在东南亚,每年鼻咽癌的发病率约为10~15/100 000人,而其中非角化性低分化或未分化癌约占总数的95%[7-8]。放疗是鼻咽癌的基本治疗手段,但对中晚期及进展期患者疗效却不甚理想,且放疗后往往出现多种不良反应,影响患者的生活质量。因此,探讨新的治疗靶点有可能为鼻咽癌患者的治疗带来新的希望。
SKP2是SKP2-SCF复合体的基质识别亚单位,因其能与细胞周期蛋白cyclin A作用而被Beach等[9]于1995年首先发现。SKP2-SCF复合体可以通过诱导泛素化及依赖于蛋白酶体对p27及其他底物的降解而发挥作用[6]。研究显示SKP2具有多种细胞调节功能,包括调控细胞周期进展、衰老、影响DNA修复、放射敏感性、肿瘤细胞转移等[1-5]。首先,它在泛素介导的对细胞周期蛋白依赖性激酶(cyclin-dependent kinases,CDK)抑制剂p27kip1的降解中起作用,通过影响p27的稳定性从而最终影响细胞周期进展。细胞周期调节在DNA损伤修复、放射敏感性中具有重要作用,而SKP2是调节细胞周期发展的关键因子之一[2,10]。其次,SKP2还和细胞衰老相关。尽管单纯的SKP2失活并不能诱导细胞衰老,但SKP2缺失伴有异常的促肿瘤信号或肿瘤抑制基因灭活时确实能引起强有力的抑制肿瘤的衰老应答,其部分通过对p27kip1的表达调控实现[6]。另外,SKP2表达可能还与放射敏感性相关,研究显示SKP2诱导表达可以促进食管癌EC9706细胞的放射抵抗性,而SKP2基因敲除则可以增强肿瘤放射敏感性[11]。最新研究报道,SKP2还具有致癌活性,通过诱导具有抗增殖活性和肿瘤抑制功能的蛋白的降解(如p27kip1等),从而促进肿瘤发生形成[3]。许多人类肿瘤标本中SKP2的过表达往往与不良预后相关,且其与p27kip1表达水平呈负相关[2]。鼻咽癌中SKP2表达升高亦与不良预后相关[12-13],但目前国内外尚无鼻咽癌细胞株放疗后SKP2表达变化的相关报道。
p27kip1是调节G1/S转化的CDK抑制剂,作为肿瘤抑制因子,是SKP2主要的生理性和病理性作用底物。p27kip1表达升高可以导致G1期细胞周期阻滞,而表达下调则可以促进G1/S转化,促进细胞周期进展。p27kip1主要通过翻译后修饰调节,由SCF复合体介导的泛素-蛋白酶系统降解。有研究报道在放射诱导的DNA损伤中,p27kip1蛋白水平短暂升高,随之发生G1期细胞周期阻滞从而利于DNA损伤的修复[14]。
本研究中,CNE2细胞在6Gy放疗后G1期细胞比例下降,而S期和G2/M期细胞比例升高,出现细胞周期阻滞。说明细胞周期调节在鼻咽癌细胞放疗后应答中起重要作用。研究报道DNA损伤后通过激活ATM、ATR激酶使其下游效应器蛋白磷酸化,激活细胞周期检查点(G1/S、intra-S、G2/M等),引起细胞周期阻滞,并启动DNA损伤修复或诱导细胞凋亡,从而维持基因稳定性。在肿瘤干细胞中,检查点途径是放射抵抗的主要机制之一,对于放射抵抗的胶质瘤干细胞,通过抑制检查点途径可以逆转其放射抵抗性[10]。
本研究结果提示低剂量放疗后0.5~1.5h出现SKP2表达短暂下降伴p27kip1表达相应增高,放疗后4h出现SKP2表达升高伴p27kip1表达下调,两者之间存在负相关。因CDK抑制剂p27kip1的表达高低与细胞周期进展密切相关,而SKP2可以通过泛素-蛋白酶体系统调节p27kip1的降解从而影响p27kip1的稳定性,最终影响细胞周期进展;反之,SKP2失活可以上调p27kip1表达从而引起细胞周期阻滞[2]。综合既往的研究结果,笔者推测SKP2和p27kip1参与放疗后鼻咽癌CNE2细胞的损伤应答,且p27kip1的表达变化可能受SKP2调控。
本研究还显示在高剂量放疗后SKP2和p27kip1表达亦存在变化,但与低剂量时不同,两者表达无明确相关关系,其在变化的时间点与低剂量时亦有差别。说明高剂量放疗引起的DNA损伤应答途径可能不同于低剂量照射,具体的损伤应答途径尚需进一步研究明确。
综上所述,本研究结果显示鼻咽癌CNE2细胞在放疗后出现G2/M期细胞周期阻滞,而SKP2和p27kip1参与其放疗后应答反应,且低剂量放疗时,p27kip1表达可能受SKP2调控。SKP2对不同剂量放疗的具体应答机制及其与放射诱导DNA损伤修复、细胞衰老等的关系尚需进一步研究明确。
[1]Barre B,Perkins N D.The Skp2 promoter integrates signaling through the NF-kappaB,p53,and Akt/GSK3beta pathways to regulate autophagy and apoptosis[J].Mol Cell,2010,38(4):524-538.
[2]Chan C H,Lee S W,Wang J,et al.Regulation of Skp2 expression and activity and its role in cancer progression[J].Scientific-WorldJournal,2010,10(1):1001-1015.
[3]Wang S,Raven J F,Koromilas A E.STAT1 represses Skp2 gene transcription to promote p27kip1stabilization in Ras-transformed cells[J].Mol Cancer Res,2010,8(5):798-805.
[4]Liu S G,Wang B S,Jiang Y Y,et al.Atypical protein kinase Ciota (PKCiota)promotes metastasis of esophageal squamous cell carcinoma by enhancing resistance to Anoikis via PKCiota-SKP2-AKT pathway[J].Mol Cancer Res,2011,9(4):390-402.
[5]Hung W C,Tseng W L,Shiea J,et al.Skp2 overexpression increases the expression of MMP-2 and MMP-9 and invasion of lung cancer cells[J].Cancer Lett,2010,288(2):156-161.
[6]Lin H K,Chen Z,Wang G,et al.Skp2 targeting suppresses tumorigenesis by Arf-p53-independent cellular senescence[J].Nature,2010,464(7287):374-379.
[7]Chan A T,Teo P M,Johnson P J.Nasopharyngeal carcinoma[J].Ann Oncol,2002,13(7):1007-1015.
[8]Sun J M,Ahn M J,Park M J,et al.Expression of excision repair cross-complementation group 1 as predictive marker for nasopharyngeal cancer treated with concurrent chemoradiotherapy [J].Int J Radiat Oncol Biol Phys,2011,80(3):655-660.
[9]Zhang H,Kobayashi R,Galaktionov K,et al.p19Skp1 and p45-Skp2 are essential elements of the cyclin A-CDK2 S phase kinase[J].Cell,1995,82(6):915-925.
[10]Bolderson E,Richard D J,Zhou B B,et al.Recent advances in cancer therapy targeting proteins involved in DNA doublestrandbreakrepair[J].ClinCancerRes,2009,15(20):6314-6320.
[11]Wang X C,Tian L L,Tian J,et al.Overexpression of SKP2 promotes the radiation resistance of esophageal squamous cellcarcinoma[J].Radiat Res,2012,177(1):52-58.
[12]Xu H M,Liang Y,Chen Q,et al.Correlation of Skp2 overexpression to prognosis of patients with nasopharyngeal carcinoma from South China[J].Chin J Cancer,2011,30(3):204-212.
[13]Fang F M,Chien C Y,Li C F,et al.Effect of S-phase kinase-associated protein 2 expression on distant metastasis and survival in nasopharyngeal carcinoma patients[J].Int J Radiat Oncol Biol Phys,2009,73(1):202-207.
[14]Iovine B,Iannella M L,Bevilacqua M A.Damage-specific DNA binding protein 1 (DDB1)is involved in ubiquitin-mediated proteolysis of p27kip1in response to UV irradiation[J].Biochimie, 2011,93(5):867-875.
SKP2 and p27kip1are involved in cellular response to radiation in human nasopharyngeal carcinoma cell line CNE-2
SKP2 p27kip1Nasopharyngeal carcinoma Radiation Cell cycle
2012-12-17)
(本文编辑:胥昀)
浙江省医药卫生科技计划项目(2009A221)
310016 杭州,浙江大学医学院附属邵逸夫医院放疗科(杨伟芳、孙晓南,杨伟芳系在职硕士研究生,现在温州医学院附属台州医院放疗科工作);温州医学院附属台州医院放疗科(丁维军)
孙晓南,E-mail:sunxiaonan@hotmail.com
【 Abstract】Objective To investigate the expression of SKP2 and p27kip1in the cellular response to radiation in human nasopharyngeal carcinoma cells CNE-2. Methods The expressions of SKP2 and p27kip1in human nasopharyngeal carcinoma CNE-2 cells were detected by Western blot before and after ionizing radiation.Flow cytometry was used for cell cycle Analysis.Results The CNE2 cells displayed a G2/M cell-cycle arrest after exposure to radiation.Western blot analysis showed a transient increasd expression of p27kip1and decreased expression of Skp2 at 0.5~1.5h after exposure to low doses ionizing radiation(2Gy); meanwhile 2~4h after exposure to low dose radiation the expression of Skp2 was up-regulated and p27kip1down-regulated.However,the expressions pattern of SKP2 and p27kip1were reversed to above observation after exposure to high doses ionizing radiation(6Gy).Conclusion The results suggest that SKP2 may contribute to the regulation of p27kip1and may be a key factor in regulating the cell cycle in response to radiation-induced DNA damage.
