壳聚糖对人子宫内膜癌细胞增殖及细胞周期的影响
2013-04-17张晓梅顾方乐董乃俊王大新
张晓梅,潘 宇,魏 勉,顾方乐,吕 芳,孙 燕,董乃俊,王大新
(江苏省苏北人民医院,江苏 扬州 225001)
壳聚糖是由虾、蟹壳提取的高分子化合物几丁质经脱N-乙酰后衍生而成,具有良好的生物相容性和生物学活性,是一种新型的医用生物材料[1-2]。本试验旨在确定壳聚糖溶液在体外环境下对人子宫内膜细胞的影响,为壳聚糖作为节育器材料提供试验依据。
1 材料与方法
1.1 材料
RPMI-1640型培养基(Sigma公司);胰蛋白酶(Difco公司);FBS(Hyclone 公司);MTT(Sigma 公司)。壳聚糖(剂型为干粉,济南海得贝海洋生物工程有限公司,商品名为脱乙酰医药级壳聚糖,生产批号为鲁卫食证字<2007>第370000-000052号)。人子宫内膜癌细胞Ishikawa细胞(上海复祥生物科技有限公司)Cell proliferation ELISA Kit(Roche),细胞周期与细胞凋亡检测试剂盒(碧云天公司)。
1.2 方法
细胞培养:在37℃,5%CO2条件下,用含10%胎牛血清(FBS)的RPMI-1640培养Ishikawa细胞,每2 d更换新鲜培养基。
壳聚糖溶液配制:取壳聚糖干粉2.0 g,加入蒸馏水100 mL,再加入冰醋酸1 mL,磁力搅拌24 h,待壳聚糖完全溶解后高速离心(10 000 r/min)20 min,取上清液,得质量浓度为 20 μg/μL 的壳聚糖溶液。
MTT检测细胞增殖:收集处于对数生长期的Ishikawa细胞,用培养基制成细胞悬液,接种于96孔板,1×104细胞/孔。24 h后加入质量浓度梯度的壳聚糖溶液,同时加入20%的FBS和5 μg/mL的阿霉素(DOX)溶液分别作为阳性对照和阴性对照,刺激48 h后加入 20 μL 的 MTT(5 g/L),继续培养 4 h,吸弃 MTT 溶液,每孔加入150 μL的 DMSO,震荡 10 min,使结晶物充分溶解,570 nm波长处,检测光吸光度。
BrdU检测DNA合成速率:收集处于对数生长期的Ishikawa细胞,用培养基制成细胞悬液,接种于96孔板,1×104个细胞/孔。24 h后加入质量浓度梯度的壳聚糖溶液,同时加入5 μg/mL的阿霉素作为阴性对照,刺激48 h后加入10 μmol/L的BrdU,孵育8 h后用Roche ELISA Kit检测BrdU吸光度。
流式细胞仪检测细胞周期:收集处于对数生长期的Ishikawa细胞,用培养基制成细胞悬液,接种于96孔板,1×104个细胞/孔。24 h后加入质量浓度梯度的壳聚糖溶液,同时加入5 μg/mL的DOX作为阴性对照,刺激48 h后收集细胞,70%乙醇4℃固定过夜,PI染色后上机检测。
2 结果
2.1 壳聚糖对Ishikawa细胞增殖的影响
为了检测不同质量浓度的壳聚糖对Ishikawa细胞生长的影响,分别用 0,0.01,0.1,1,10,50,100 μg /mL 的壳聚糖溶液刺激Ishikawa细胞 48 h,同时以 20%FBS和 5 μg/mL的 DOX处理 48 h作为阳性和阴性对照,用MTT检测细胞增殖情况。从图1可以看出,壳聚糖质量浓度低于 100 μg/mL时,对 Ishikawa细胞的增殖几乎没有明显影响(P>0.05);而壳聚糖质量浓度为 100 μg/mL时与对照组比较,Ishikawa细胞增殖能力显著增加(P<0.05),同时阳性对照组20%FBS细胞增殖能力也显著增加(P<0.05),而DOX处理组细胞增殖能力极显著降低(P<0.01)。
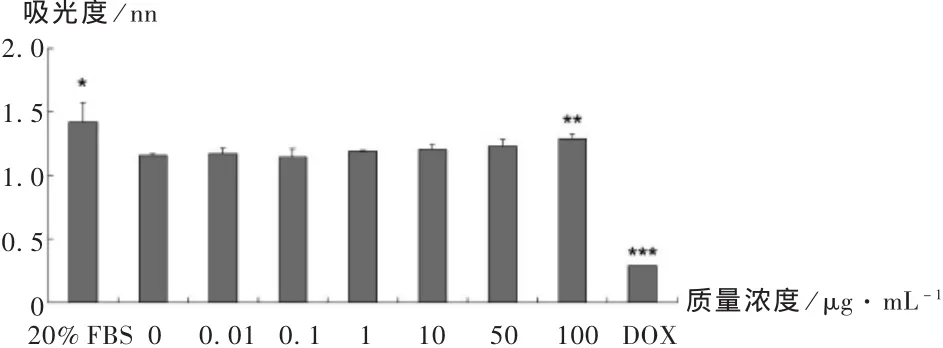
图1 不同质量浓度壳聚糖对Ishikawa细胞增值的影响
2.2 壳聚糖对Ishikawa细胞DNA合成速率的影响
为了检测不同质量浓度的壳聚糖对Ishikawa细胞DNA合成速率的影响,分别用 0,0.01,0.1,1,10,50,100 μg /mL 的壳聚糖溶液处理Ishikawa细胞48 h,同时用5 μg/mL的阿霉素处理48 h作为阴性对照,加入 1 μmol/L的 BrdU孵育 8 h,用 Roche ELISA Kit检测。从图2可以看出,低质量浓度的壳聚糖(不大于10 μg/mL)时,与对照组比较,试验组Ishikawa细胞的DNA合成速率没有显著性变化(P >0.05);而壳聚糖质量浓度达到 100 μg/mL 时,对细胞 DNA的合成速率有显著的促进作用(P<0.05)。同时,DOX处理组 DNA合成速率显著降低(P<0.01)。
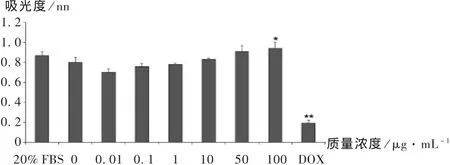
图2 不同质量浓度壳聚糖对Ishikawa细胞DNA合成速率的影响
2.3 壳聚糖对Ishikawa细胞周期的影响
为了检测不同质量浓度的壳聚糖对Ishikawa细胞周期的影响,分别用 0,0.1,1,10 μg/mL 的壳聚糖溶液刺激 Ishikawa 细胞48 h,同时用5 μg/mL的阿霉素刺激48 h作为阴性对照,收集的细胞用70%的乙醇于4℃固定过夜,随后PI染色,用流式细胞仪检测各组细胞的细胞周期分布。从表1和图3可以看出,≤10 μg/mL质量浓度壳聚糖对Ishikawa细胞的细胞周期几乎没有影响(P > 0.05),即 0.1,1,10 μg/mL 质量浓度壳聚糖处理组的细胞G1期,S期以及G2期与对照组比较无显著性变化。而DOX处理组细胞无S期,同时G1期,G2期显著延长,与对照组比较有显著性差异(P <0.05)。
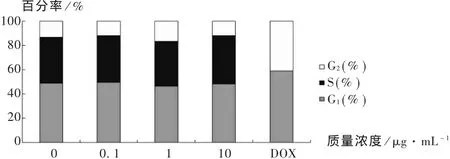
图3 不同质量浓度壳聚糖对Ishikawa细胞周期的影响

表1 不同质量浓度壳聚糖对Ishikawa细胞周期的影响(百分率/%)
3 讨论
壳聚糖是利用虾蟹外壳废弃物质制成的天然高分子化合物,具有良好的生物相容性,可在人体内完全吸收,无毒副作用,具有广阔的临床应用前景[3-4]。体外试验和动物试验表明,壳聚糖具有选择性抑制成纤维细胞、平滑肌细胞增殖和促进表皮细胞、内皮细胞的生长[5-7],但对人子宫内膜细胞的影响尚未见文献报道。
在本研究中,首先通过MTT比色法检测了壳聚糖对Ishikawa细胞毒性的影响,发现仅当壳聚糖溶液质量浓度达到100 μg/mL时才能轻微地促进Ishikawa细胞的生长,而当壳聚糖质量浓度低于100 μg/mL时,对细胞的生长无明显的影响。同时,用BrdU掺入法来检测壳聚糖溶液对Ishikawa细胞DNA合成的影响,试验表明,壳聚糖溶液质量浓度高于50 μg/mL后,Ishikawa细胞DNA合成速率有轻微增加,但低于50 μg/mL时对DNA合成速率则无明显影响。MTT和BrdU试验结果中,壳聚糖影响Ishikawa细胞的最低质量浓度有所不同,其原因可能在于MTT比色法是从细胞水平来进行评价,而BrdU掺入法则是从分子水平来进行评价,故两种方法的灵敏度不同。综合考虑,选择不影响Ishikawa细胞生长的最低壳聚糖溶液质量浓度为10 μg/mL。最后,又用不同质量浓度的壳聚糖溶液处理Ishikawa细胞后,PI(碘化丙啶)染色,细胞流式仪检测细胞周期分布,其结果与前面结果一致,即当壳聚糖溶液质量浓度低于10 μg/mL时,对Ishikawa细胞周期没有明显影响。
综上所述,低浓度的壳聚糖溶液(≤10 μg/mL)对人子宫内膜癌细胞Ishikawa的生长、增殖、细胞周期都没有明显影响,这一特性使得壳聚糖可以作为宫内节育器的支架。
[1]于 飞,奚延斐,张姝江,等.具有垂直孔道的壳聚糖乳酸盐海绵的制备及体外释药模型的拟合分析[J].高等学校化学学报,2012,33(4):843-849.
[2]崔惠素,石 巍.壳聚糖生物性能及用于细菌性阴道病的探索与研究[J].中国医疗器械杂志,2012,36(2):96-98,113.
[3]陈艳玲.萘普生壳聚糖凝胶的处方优选[J].齐齐哈尔医学院学报,2012,33(1):65-66.
[4]惠光艳,吴广升,关继东,等.壳聚糖温敏凝胶与富含血小板血浆共混后的微观结构[J].实用医药杂志,2012,29(1):58-60.
[5]何 秉,程明荣,陈厚祥,等.半乳糖基壳聚糖5氟尿嘧啶纳米粒的制备及其抑制小鼠结肠癌的实验研究[J].中国临床医学,2011,18(6):738-741.
[6]葛月宾,李孟顺,梅之南.大豆苷元-壳聚糖微球对去卵巢小鼠骨质疏松的药效研究[J].时珍国医国药,2011,22(12):2 963-2 965.
[7]邢桂荣,王敬湘.壳聚糖在医药领域的研究进展[J].中国药业,2003,12(8):74-75.
