梅毒螺旋体重组抗原TpN47的纯化工艺研究*
2013-04-17黄德新骆晓栋
章 刚,黄德新,骆晓栋
(深圳大学生化工程技术研究中心,广东 深圳 518057)
梅毒是临床上常见的性传播疾病,迄今为止尚未分离出具有保护性免疫力的抗体,也无有效的疫苗,因此梅毒螺旋体相关抗原的制备,对于疾病的早期诊断和治疗,防止血液传播等显得尤为重要[1]。用基因工程方法表达的重组抗原易于生产、纯化,可实现对生产条件的标准化控制。TpN47是应用聚合酶链式反应法从梅毒螺旋体全基因组中扩增膜蛋白的一个片段,克隆到载体pET-HT-JKM中,在BL21(DE3)plysS菌中诱导表达的蛋白,相对分子质量约为47×103,理论等电点为5.81。该蛋白以包涵体的形式存在于表达菌体中,N端含有六联组氨酸标记,因此可先将包涵体溶解于含有高浓度变性剂的缓冲液中,再进行固定化金属亲和层析(IMAC)[2]分离纯化该蛋白。蛋白质一般都是在相对温和的天然条件下行使其功能,用于建立双抗原夹心试剂的抗原蛋白必须首先能溶于适当的缓冲液中。因此,变性条件下层析纯化的蛋白质必然涉及到蛋白质的复性问题,以解决其溶解性。实际应用中,可以采用两种方式进行复性,一种是在变性条件下洗脱结合蛋白,然后进行透析或稀释复性,另一种是蛋白结合在柱上之后,用相对温和的溶液环境顶替变性溶液环境,待蛋白复性后再进行洗脱操作[3-4]。
1 材料与仪器
Urea,NaCl,NiSO4,Imidazol 均 为 国 产 分 析 纯 试 剂;Protein Molecular Weight Marker购自 Amersham;Tris,β-ME 及 SDSPAGE相关试剂均购自上海生工生物工程技术服务有限公司。电泳仪(Bio-Rad公司);层析系统(安玛西亚公司AKTA Explorer),层析介质为Chelating Sepharose Fastflow;离心机为Hitach高速冷冻离心机 CR22F;超声破碎仪(SONICS&MATERIALS INC.)。收集的TpN47表达菌体经超声破菌并离心分离后,得到本研究所需的包涵体。
2 方法与结果
2.1 缓冲液的配制
平 衡 缓 冲 液 A:8 M 尿 素 ,0.3 M NaCl,50 mM Tris-HCl,pH=8.5;复性缓冲液 B:2 M 尿素,0.3 M NaCl,50 mM Tris-HCl,pH=8.5;去杂缓冲液 C:2 M 尿素,0.3 M NaCl,50 mM Tris-HCl,0.04 M 咪唑,pH=8.5;洗脱缓冲液 D:2 M 尿素,0.3 M NaCl,50 mM Tris-HCl,0.25 M 咪唑,pH=8.5。
2.2 层析样品液的制备
以30∶1(V/W)的比例用平衡缓冲液A 150 mL悬起5 g包涵体,并补加10 mM β-ME于混悬液中,调溶液pH至8.5,室温下磁力搅拌作用240 min后,19 000 r/min离心15 min,所得上清液即为层析样品液。
2.3 TpN47 的纯化
层析柱XK16/20,层析介质为Chelating Sepharose FF,取25 mL按要求进行处理。将已制备的层析样品液分作2份,其中1份体积为100 mL,另1份为50 mL。层析过程检测波长为280 nm。填料装柱后依次用10个柱体积纯水、0.5个柱体积的0.1 M NiSO4、3个柱体积纯水流过层析柱,接着用5个柱体积平衡缓冲液A平衡柱子待用。分别对2份层析样品液进行如下层析操作:上样,以平衡缓冲液冲洗2个柱体积,用2个柱体积复性缓冲液平衡层析柱,使变性蛋白柱上复性,接着用4个柱体积去杂缓冲液除去杂质,最后用3个柱体积洗脱缓冲液洗脱,紧接着用平衡缓冲液A冲洗柱子,再用洗脱缓冲液D冲洗柱子。收集以上各环节样品进行SDS-PAGE的分析。
2.4 层析图谱
100 mL层析样品液的层析图谱及SDS-PAGE分别见图1及图2,50 mL层析样品液的层析图谱及SDS-PAGE分别见图3及图4。
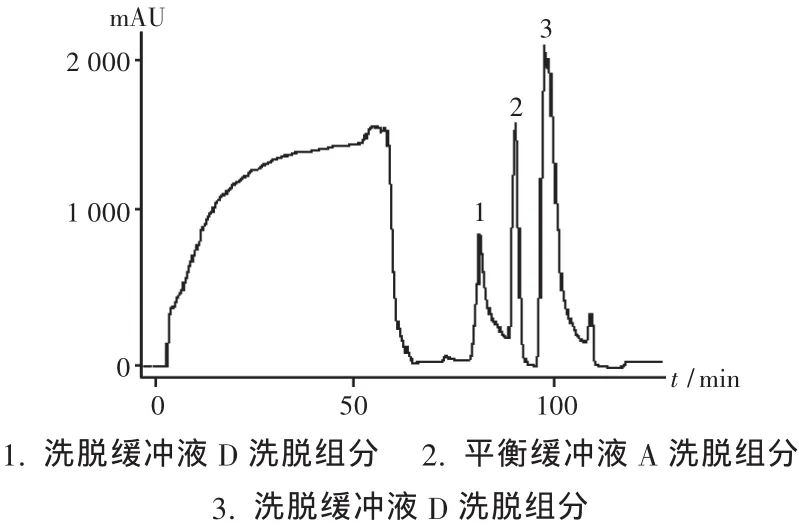
图1 IMAC层析图谱(100 mL上样量)
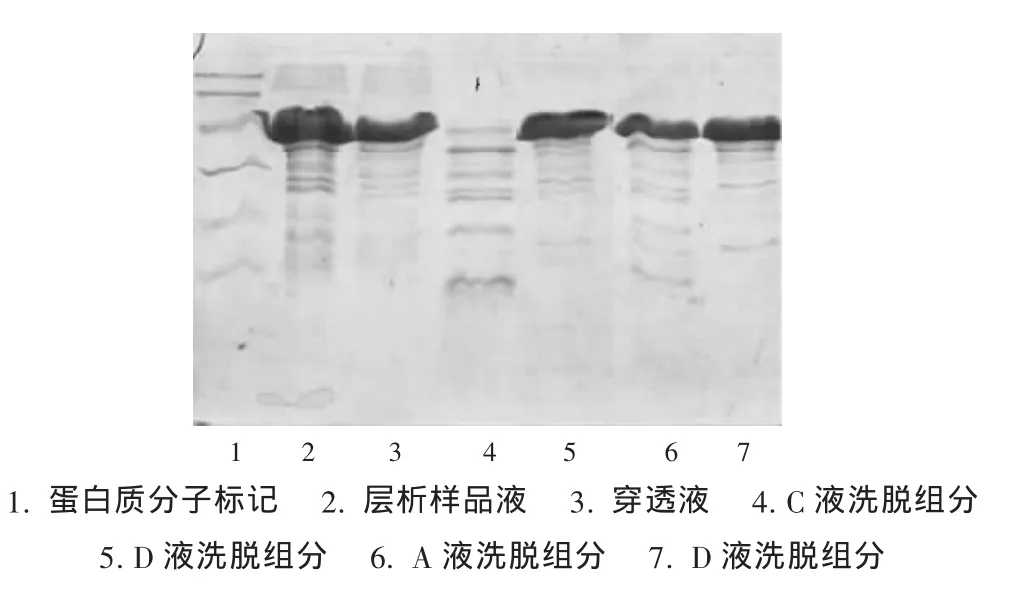
图2 IMAC层析(100 mL上样量)组分的SDS-PAGE分析
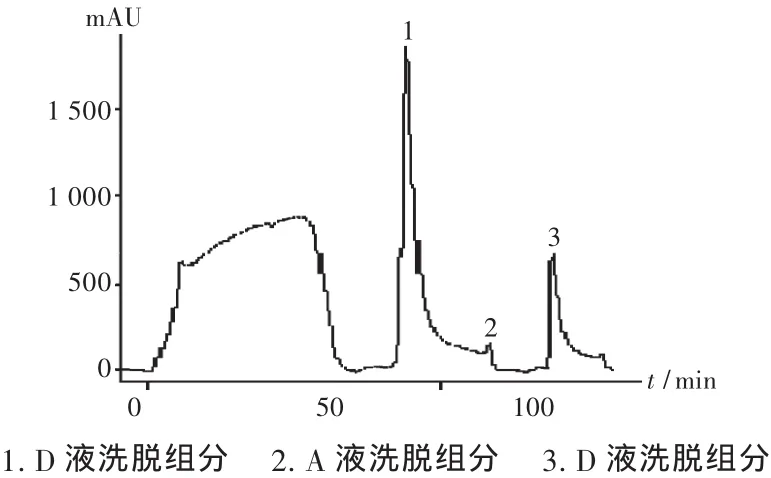
图3 IMAC层析图谱(50 mL上样量)
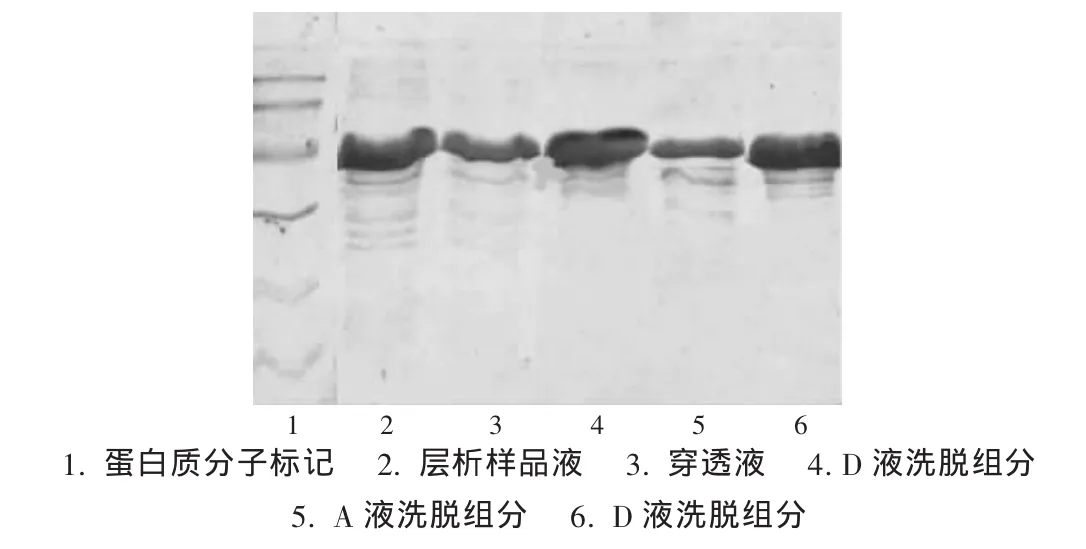
图4 IMAC层析(50 mL上样量)组分SDS-PAGE分析
3 讨论
蛋白质复性是应用基因重组技术在菌体中生产蛋白质的瓶颈。蛋白质复性是一个过程,存在中间阶段,此阶段的各种相互作用决定了蛋白质能否复性。蛋白质复性要求有一定的条件,如pH、温度、离子强度、蛋白质浓度等。另外,多种添加剂能促进蛋白质复性,其中包括表面活性剂、低浓度变性剂、分子伴侣蛋白和各种氧化还原剂等。由于纯化目的是得到较高纯度的蛋白,添加剂的使用可能有助于蛋白质复性,但在最终产品中必须去除。为了不引入新的杂质,本研究根据以往经验采用柱上复性的方法,即蛋白结合在柱上之后,用相对温和的溶液环境顶替变性溶液环境,待蛋白质复性后再进行洗脱,取得了良好的结果。
常规层析操作的完整流程是平衡、上样、淋洗、洗脱、再生,然后可进入下一个操作循环。对于IMAC,在除杂操作之后,250 mM的咪唑缓冲液足以洗脱特异性结合蛋白,通常不需要额外的再生操作,只是在经过数个操作循环之后,柱载量明显下降时才进行彻底的再生操作,即用EDTA络合缓冲液除去基质结合的金属离子,彻底清洗基质后,再重新结合上金属离子。本试验层析纯化出现了异常现象,由图1可知,在250 mM的咪唑缓冲液洗脱操作结束后,用平衡缓冲液A平衡柱子的过程中出现了一个大的平衡缓冲液洗脱峰(2),这是常规层析操作中少有的现象。SDSPAGE分析平衡缓冲液A平衡柱子过程中出现的洗脱峰(2)表明其主要成分为目标蛋白。上样完毕后缓冲液A的淋洗没有出现洗脱峰,而在洗脱液D洗脱特异性结合蛋白后紧接着再用A液洗柱出现较大的洗脱峰(2),说明此时被洗脱的结合蛋白是在洗脱液D洗脱时由于某种原因滞留在层析柱中,而且这种滞留蛋白不是与介质发生该层析过程所应有的特异性结合,而是在金属螯合以外作用力之下吸附在柱上。滞留蛋白产生的原因可能是洗脱液D条件下洗脱蛋白的局部过浓导致部分蛋白以固体形式析出,也有可能是柱上复性过程中产生了不溶性产物,具体成因尚待进一步研究。当缓冲液A流经柱子时,在缓冲液A中高浓度尿素作用下析出蛋白又重新溶解并解吸附,由于缓冲液A中没有咪唑等顶替剂,重新溶解的蛋白其中一部分又能与层析介质上的金属离子结合,从而再次结合在柱上。另一部分蛋白由于受蛋白溶解动力学以及与金属离子的结合反应动力学限制,不能与介质有效结合因而流出柱子形成吸收峰。流出柱子的蛋白量的多少取决于柱中滞留蛋白的多少,而这在一定范围内与上样量呈正相关,这一点在减少上样量后得到了初步验证。基于以上分析,在出现异常现象,即在洗脱液D洗脱特异性结合蛋白后紧接着再用A液洗柱出现较大的洗脱峰时,改变常规操作,用洗脱液D洗脱液再次洗脱,可得到较为可观的目标组分,从而在不增加上样次数的情况下提高了目标产物的收率。
本研究结果在其他蛋白质变性条件下金属螯合亲和层析纯化中得到了较好的应用,对于变性条件下其他吸附性色谱纯化蛋白的研究也可能具有一定的参考价值。
[1]卢海蓉,王晓红,陈少娟,等.梅毒螺旋体重组抗原的表达及在梅毒血清学诊断中的应用[J].中国生物工程杂志,2009,29(6):41-45.
[2]Porath.Amino acid side chain interaction with chelate-ligand crosslinked dextran,agrose and TSK gel.A minireview of recent work[J].Mol Recogn,1990,3:123-127.
[3]谷振宇,苏志国.蛋白质的层析折叠复性[J].化工学报,2000,51(S1):325-329.
[4]王 颖,董晓燕,孙 彦.蛋白质复性技术研究进展[J].生物工程进展,2002,22(2):61-65.
