颅脑损伤后脑组织中水通道蛋白4表达的变化
2013-04-17潘红松汤崇辉傅小君许信龙魏晓捷方战舰
潘红松 汤崇辉 傅小君 许信龙 魏晓捷 方战舰
颅脑损伤后脑组织中水通道蛋白4表达的变化
潘红松 汤崇辉 傅小君 许信龙 魏晓捷 方战舰
目的 研究颅脑损伤后水通道蛋白4(AQP-4)在脑组织中表达的变化及其临床意义。 方法 对27例颅脑损伤患者行开颅手术,将术中取得的挫伤水肿脑组织(损伤组)和颞极减压获得的相对正常脑组织(对照组)进行AQP-4的免疫组化和real-time PCR检测。结果 损伤组各时点挫伤水肿脑组织AQP-4的表达量均明显高于对照组(均P<0.05);损伤24h后周围水肿脑组织中的AQP-4表达量显著升高。 结论 颅脑损伤后脑水肿的形成和发展与AQP-4的异常表达密切相关。
颅脑损伤 脑水肿 水通道蛋白4
脑水肿是颅脑创伤后最常见也是最严重的继发性损伤,尽管以往有许多此类研究,但人们对其发生机制尚不清楚[1]。关于水通道蛋白4(aquaporin-4,AQP-4)在外伤性脑水肿中的作用,以往亦有许多研究,但结论并不一致,且大部分研究是以动物为研究对象,对人体的研究很少。本研究以急性颅脑损伤患者手术标本为研究对象,检测并比较挫伤灶周围水肿脑组织和颞极减压获得的正常脑组织中AQP-4的表达量,分析AQP-4与急性颅脑损伤后脑水肿的关系,探索其在脑水肿形成过程中的作用和规律,为临床治疗脑水肿提供理论依据。
1 对象和方法
1.1 对象 选择慈溪市人民医院2010-01—2010-12因急性颅脑损伤住院手术治疗的27例患者,其中男17例,女10例;年龄17~65岁,平均(38.6±11.5)岁;致伤原因为车祸伤20例,跌坠伤5例,打击伤2例;术前GCS评分3~8分14例,9~12分9例,13~15分4例;受伤至手术时间<6h9例,6~24h10例,>24h8例。将开颅手术时切除的挫伤水肿的脑组织作为损伤组,颞极减压时切除的相对正常的脑组织作为对照组。本研究方案得到医院医学伦理委员会的批准,治疗措施均得到患者家属的知情同意。
1.2 检测仪器及材料 AQP-4一抗、兔三步法二抗均为美国SANTA CRUZ公司产品,由北京中杉金桥生物技术有限公司提供;反转录试剂盒(TAKARA)、定量试剂盒(TAKARA)由宝生物工程有限公司提供;定量PCR仪器ABI7500为美国应用生物系统公司生产。
1.3 标本采集 所有患者均行标准大骨瓣开颅术,颅骨钻孔,铣刀铣开骨瓣,切开硬脑膜,清除血肿和挫伤脑组织,将取下的挫伤水肿的脑组织作为损伤组标本,同一患者颞极减压获得的相对正常脑组织作为对照组标本。每例标本均取两份,一份放入4%的多聚甲醛溶液中固定24h后制作成蜡块,用于免疫组化检测;另一份保存于液氮罐中,用于real-time PCR检测。
1.4 免疫组化检测 石蜡切片二甲苯脱蜡,梯度乙醇水化。抗原修复后3%H2O2阻断内源性过氧化物酶10min。滴加1︰60的AQP-4一抗4℃过夜,滴加山羊抗兔IgG抗体-HRP多聚体,37℃孵育40 min。二氨基联苯胺显色液显色1~3 min,显微镜下控制反应。Harris苏木素液复染细胞核1min。细胞膜呈黄色或黄棕色,细胞核呈蓝色为阳性。每个石蜡块任意选一张免疫组化染色切片,每张切片在挫伤与水肿带交界区随机选取3个高倍视野(×200),并拍照,用Image-ProPlus5.0专业图像分析软件进行图像分析,测量免疫组化染色的平均光密度值(OD值)。OD值越大,AQP-4表达量越大。
1.5 real-time PCR检测 Trirol试剂提取RNA,计算RNA含量及鉴定纯度。然后逆转录为cDNA,再用特异性引物扩增目的基因。引物由上海辉睿生物科技有限公司设计合成(表1)。real-time PCR反应条件:预变性94℃5min,94℃变性15s,退火温度下退火20s,60℃延伸45s,循环扩增40次,60℃检测荧光值。反应结束后,由电脑自动得出荧光反应曲线,输出各测量标本AQP-4和GAPDH的阈循环(threshold cycle,CT)值,以GAPDH为参照,计算方法为:△CT=CT(目的基因)-CT(参照基因GAPDH),△△CT=△CT(损伤组)-△Ct(对照组),2-△△CT表示目的基因RNA的相对量。
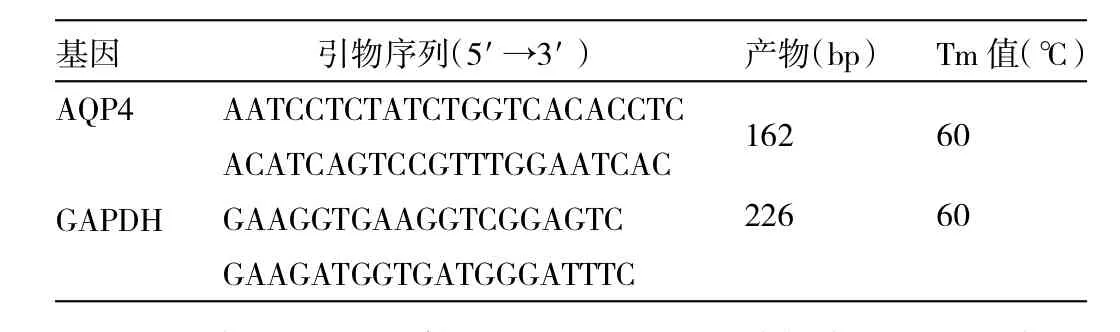
表1 目的基因的引物序列及反应条件
1.6 统计学处理 使用SPSS17.0统计软件,所有计量资料用表示,组间比较采用t检验,组内不同时点的比较采用方差分析。
2 结果
2.1 免疫组化检测 对照组脑组织细胞排列整齐。损伤组可见损伤中心细胞坏死,血管破裂出血,血管周围呈空泡样改变,神经细胞形态不整,排列紊乱,局部有大量小胶质细胞浸润,周围细胞水肿明显,深部白质亦有出血、水肿表现。AQP-4主要分布于软脑膜、与血管接触的星形胶质细胞足突膜及脑室系统的室管膜上(图1、2),损伤组挫伤周围水肿脑组织中AQP-4的OD值均高于同一时点的对照组(P<0.05),并且随着时间的延长,AQP-4的表达量也增加(P<0.01),而对照组各点AQP-4的表达量无统计学差异(P>0.05),详见表2。
2.2 real-time PCR检测 两组脑组织中均检测到AQP-4 mRNA的表达。对照组各时点AQP-4 mRNA的表达量无统计学差异(P>0.05)。在同一时点,损伤组挫伤周围水肿脑组织中AQP-4 mRNA的表达量均高于对照组(P<0.01),并且随着损伤时间的延长,AQP-4mRNA的表达量也增加(P<0.01),详见表3。
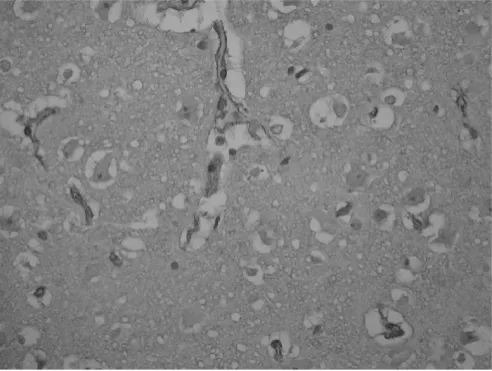
图1 损伤组AQP-4免疫组化染色(×200)

图2 对照组AQP-4免疫组化染色(×200)

表2 两组标本AQP-4表达量的变化及比较

表3 两组标本中AQP-4 mRNA表达量的变化及比较
3 讨论
脑水肿是颅脑创伤后最常见也是最严重的继发性损伤,其病理改变是过多的水分积聚在脑细胞内或细胞外间隙,引起脑体积增大、重量增加、颅内压增高、脑疝甚至死亡。但目前对脑水肿的治疗仅限于高渗性脱水和外科手术治疗[2]。AQPs是近二十年来新发现的一个膜通道蛋白家族。迄今为止,已从哺乳动物组织中克隆出了13种水通道蛋白,它们广泛分布于机体不同组织器官中,在介导水跨细胞膜的流动中起关键作用[3]。其中AQP-4在脑内分布广泛,与脑水肿关系密切。参与出血性、缺血性脑水肿的形成,并在脑水肿形成过程中起关键性作用[4]。AQP-4是脑胶质细胞缝隙连接的组成部分[5],与脑的血液灌注及水肿的形成和消退有着密切的关系,对调节体内水的代谢和维持中枢神经系统水代谢的平衡有重要的意义。AQP-4广泛存在于星形胶质细胞和室管膜细胞,遍及全脑和脊髓,尤其是在紧贴脑脊液、脑室系统的软脑膜和室管膜表面[6]。
Sun等[7]发现自由落体致大鼠脑损伤24h后,损伤区脑水肿程度最显著,AQP-4的表达在损伤区肿胀的星形胶质细胞上明显上调,在周边临近区下调,在远处无明显变化,因此认为AQP-4的上调可能是引起损伤区脑水肿的主要途径和原因,AQP-4促进了脑水肿的形成。
虽然目前的实验研究已较深入,但大多仅限于动物实验,较少对临床颅脑外伤标本进行AQP-4的检测,了解其变化规律。根据CT影像学资料,急性颅脑损伤后,在挫伤脑组织周围会形成一低密度的水肿带,且随着出血时间延长,水肿范围逐渐扩大,最终导致脑组织受压形成高颅内压甚至脑疝,造成二次损伤。本研究结果显示:在颅脑损伤后各个时点挫伤周围水肿脑组织中AQP-4的表达量均显著高于对照组的正常组织。并且随着损伤时间的延长,AQP-4的表达量也增加,说明AQP-4的异常表达伴随着脑水肿而存在。已有研究发现,颅脑损伤后脑组织含水量增加,AQP-4表达量增高,血-脑屏障通透性增加,三者的变化趋势一致。而且AQP-4表达量的变化与血-脑屏障通透性增加呈正相关,这表明三者之间关系密切。颅脑损伤后AQP-4表达量上调可能引起血-脑屏障通透性增加,两者的变化又导致脑组织含水量的增加[8]。
综上所述,急性颅脑损伤后脑水肿的发生、发展与AQP-4的表达、血-脑屏障的通透性关系密切。AQP-4是水分子转移的直接通路或载体,是胶质细胞与脑脊液以及血管之间的水调节和运输的重要结构基础,以AQP-4作为治疗的靶向,可能有助于临床上防止脑水肿的发生。Kleindienst等[9]用蛋白激酶C的激活剂调节AQP-4的表达并获得成功。也有研究表明地塞米松在大鼠脑出血模型中下调了AQP-4的表达,从而降低了脑水肿的程度[10]。
脑水肿的形成是一种多机制、多因素参与的病理过程,AQP-4可能仅为其中重要的一个环节,其过程并未被完全阐明。目前对AQP-4与颅脑损伤后脑水肿关系的研究才刚刚起步,还需要有更多的基础和临床研究来证实。本研究以临床患者的手术标本为研究对象,直接从临床水平探讨AQP-4与急性颅脑损伤脑水肿的关系,这对于急性颅脑损伤脑水肿的防治具有重要的临床意义。
[1]Bor-Seng-Shu E,de Lima Oliveira M,Teixeira M J.Traumatic brain injury and metabolish[J].Neurosurg,2010,112(6):1351-1353.
[2]刘伟国,杨小锋.神经损伤的临床与基础[M].杭州:浙江大学出版社, 2008:48-52.
[3]Magni F,Sarto C,Ticozzi D,et al.Proteomic knowledge of human aquaporins[J].Proteomics,2006,6(20):5637-5686.
[4]Bienert G P,Moller A L,Kristiansen K A,et al.Specific aquaporins facilitate the diffusion of hydrogen peroxide across membranes [J].Biol Chem,2007,282(2):1183-1192.
[5]Hiroaki Y,Tani K,Kamegawa A.Implications of the aquaporin-4 structure on array formation and cell adhesion[J].Mol Biol,2006, 355:628-639.
[6]Bungeroth M,Schiffbauer H,Schabitz W,et al.The role of aquaporin-4 polymorphisms in the development of brain edema after middle cerebral artery occlusion[J].Stroke,2008,39(4):1333-1335.
[7]Sun M C,Honey C R,Berk C,et al.Regulation of aquaporin-4 in a traumatic brain injury model in rats[J].Neurosurg,2003,98(3): 565-574.
[8]崔向宁,尹岭,王玉来,等.水通道蛋白4在大鼠创伤性脑水肿中的作用机制[J].中国康复理论与实践,2005,11(9):719-721.
[9]Kleindienst A,Fazzina G,Amorini A M,eI al.Modulation of AQP-4 expression by the protein kinase C activator phorbol myristale acetate decreases ischemiainduced brain edema[J].Acta Neurochir Suppl,2006,96:393-397.
[10]Gu Y T,Zhang H,Xue Y X.Dexamethasone treatment modulates aquaporin-4 expression after intracerebral hemorrage in rats [J].Neuroaci Lett,2007,413(2):126-131.
Changes of aquaporin-4 expression in cerebral tissue after traumatic brain injury
Objective To assess the changes of aquaporin-4(AQP-4)expression in cerebral tissue after traumatic brain injury.Methods The cerebral tissue samples were obtained from 27 patients with traumatic brain injury during the operation,including contusive and edematous brain tissue(injury group)and the normal brain tissue in temporal pole after surgical depressurization(control group).The expressions of AQP-4 protein and mRNA in cerebral tissue samples were detected by immunohistochemieal technique and real-time PCR. Results The expression levels of AQP-4 protein and mRNA in the injury group were significantly higher than those in the control group(P<0.05),particularly in the edematous tissues on 24h after traumatic injury. Conclusion The results suggest that the up-regulated expression of AQP-4 in the edematous brain tissues around the contusion may be involved in the formation and development of cerebral edema after traumatic brain injury.
Brain injury,traumatic Cerebral edema Aquaporin-4


2013-01-18)
(本文编辑:沈叔洪)
宁波市自然科学基金资助项目(2010A610065);浙江省卫生适宜技术成果转化计划(2011ZHA009)
315300 慈溪市人民医院神经外科
汤崇辉,E-mail:tangegg@163.com
