乳腺癌患者血清中TBX3的表达及其与临床病理特征的关系
2013-04-17丁金旺罗定存叶柳青邓甬川王克义张卧潘钢周美琪秦卫民蔡菊芳
丁金旺 罗定存 叶柳青 邓甬川 王克义 张卧 潘钢 周美琪 秦卫民蔡菊芳
乳腺癌患者血清中TBX3的表达及其与临床病理特征的关系
丁金旺 罗定存 叶柳青 邓甬川 王克义 张卧 潘钢 周美琪 秦卫民蔡菊芳
目的 探讨乳腺癌患者血清中TBX3的表达水平,探讨其与临床病理特征的关系。 方法 采用ELISA法检测142例乳腺癌患者、70例乳腺良性疾病患者和80例健康女性血清中TBX3的表达水平,并比较3者之间的差异,分析血清TBX3与乳腺癌患者年龄、月经状态、组织学分级、腋窝淋巴结及远处脏器转移、TNM分期以及雌激素受体(ER)、孕激素受体(PR)、人表皮生长因子受体2(Her-2)、细胞核增殖抗原(Ki-67)之间的相关性。结果 142例乳腺癌患者血清TBX3水平为2.13(1.01-6.15)ng/ml,显著高于健康对照组[1.60(0.99-2.18)ng/ml]及良性对照组[1.58(0.71-3.18)ng/ml],差异均有统计学意义(P<0.05或0.01)。血清TBX3表达水平与乳腺癌患者年龄、月经无关,但随着乳腺癌组织学级别增加、TNM分期进展、出现腋窝淋巴结及远处脏器转移而显著升高。此外,ER阳性及Her-2过表达者血清TBX3表达水平较ER阴性及Her-2低表达者明显升高,差异均有统计学意义(均P<0.05)。Ki-67≥14%者与Ki-67<14%者、PR阳性者与PR阴性者之间血清TBX3表达水平的差异均无统计学意义(均P>0.05)。 结论血清TBX3在乳腺癌患者血清中高表达,且与乳腺癌组织学分级、TNM分期、腋窝淋巴结及远处脏器转移、ER及Her-2密切相关,提示血清TBX3可能可以作为乳腺癌临床诊断、预后判断及随访监测的分子标记物。
乳腺癌 血清 TBX3 酶联免疫吸附试验 分子标记物
乳腺癌是全球女性最常见的恶性肿瘤,近年来其发病率持续上升并呈年轻化,严重危害着广大妇女的健康。乳腺癌受多种异常基因调控,特别是与原癌基因的激活和抑癌基因失活密切相关。随着分子生物学技术的发展,在已确认的与乳腺癌发生、发展相关的诸多基因中,如p53、人表皮生长因子受体2(Her-2)等基因,人们又发现了一些新的基因,如TBX3。随着研究的深入,TBX3已成为近年来乳腺癌研究领域的热点。有研究证实,乳腺癌组织和细胞中存在TBX3高表达[1-2],提示TBX3可能与乳腺的发生、发展有关。笔者采用酶联免疫吸附试验(ELISA)法检测并比较乳腺良、恶性疾病患者和健康女性血清中TBX3的表达水平,分析其与乳腺癌临床病理特征的关系,以探讨TBX3在乳腺癌发生、发展中的作用及临床应用价值。
1 资料和方法
1.1 一般资料 收集2010-09—2012-03杭州市第一人民医院及浙江大学医学院附属第二医院的212例乳腺疾病患者资料(杭州市第一人民医院127例,浙江大学医学院附属第二医院85例),包括年龄、月经状态、病理类型、组织学分级、腋窝淋巴结及远处转移情况、临床分期、雌激素受体(ER)、孕激素受体(PR)、Her-2及细胞核增殖抗原(Ki-67)表达状况等。患者均为女性,按组织病理学结果分两组,即乳腺癌组与良性对照组。乳腺癌组142例,年龄30~80(50.98±9.57)岁;55.63%的患者未绝经。根据美国AJCC第7版乳腺癌TNM分期标准[3],0期2例,Ⅰ期15例,Ⅱ期41例,Ⅲ期20例,Ⅳ期64例;病理类型包括浸润性导管癌130例,浸润性小叶癌4例,导管内癌2例,黏液癌2例,髓样癌2例,神经内分泌癌1例,化生性癌1例。良性对照组70例,年龄28~69(46.46±9.58)岁;包括乳腺纤维腺瘤42例,乳腺增生性病变13例,导管内乳头状瘤11例,分叶状肿瘤2例,乳管扩张症2例。另择同期杭州市第一人民医院行健康体检的80例女性作为健康对照组,年龄22~81(42.05±14.69)岁。排除各种良、恶性肿瘤,且无先天性疾病史。均得到患者知情同意。
1.2 方法
1.2.1 血清标本收集与保存 采集患者术前或化疗前空腹静脉血4ml于血清分离管内,室温完全凝固,3 000r/min离心10min后分离血清,置于-70℃超低温冰箱保存备用。健康对照组的血清标本采用同样方法。
1.2.2 血清TBX3检测 采用双抗体夹心-ELISA法定量检测上述各组血清TBX3的表达水平,试剂盒购自武汉优尔生科技股份有限公司(产品编号:E97858Hu)。本研究采取盲法、复孔检测,操作步骤严格按照试剂盒说明书进行。
1.2.3 乳腺癌组织ER、PR、Ki-67阳性及Her-2过表达判断标准 本研究采用S-P法检测ER、PR、Ki-67及Her-2表达情况,ER、PR蛋白的表达以细胞核内出现棕黄色颗粒为阳性染色,根据半定量法将结果分为“-”和“+~+++”4个级别,其中将“+”以上定义为阳性。Ki-67阳性细胞为核境界清晰的棕褐色颗粒沉着细胞,以切片中阳性细胞比例≥14%定义为阳性。Her-2蛋白的表达以细胞膜出现棕黄色颗粒为阳性染色,采用半定量法,结果分为“-”和“+~+++”4个级别,其中将“+++”定义为Her-2过表达,“+”及“-”定义为Her-2低表达,“++”进一步行免疫荧光原位杂交法(FISH)检测,以Her-2基因/17号染色体比值>2.2确定为过表达,否则为低表达。1.3 统计学处理 应用SPSS 18.0统计软件。计量资料呈偏态分布,以M(QR)表示,组间比较采用Wilcoxon秩和检验。
2 结果
2.1 3组血清TBX3的表达水平的比较 见表1。

表1 3组血清TBX3的表达水平的比较
由表1可见,乳腺癌组血清TBX3的表达水平明显高于健康对照组及良性对照组,差异均有统计学意义(P<0.05或0.01),但在健康对照组与良性对照之间血清TBX3表达水平的差异无统计学意义(P>0.05)。
2.2 乳腺癌患者血清TBX3表达水平与临床病理特征的关系 见表2。
由表2可见,血清TBX3的表达在年龄≤50岁者与>50岁者、绝经前与绝经后的乳腺癌患者中差异均无统计学意义(均P>0.05)。与组织学1+2级患者相比,组织学3级的乳腺癌患者血清TBX3表达水平显著增高,有腋窝淋巴结转移及远处转移者血清TBX3表达水平显著高于无腋窝淋巴结转移及远处转移者,Ⅲ+Ⅳ期患者血清TBX3表达水平显著高于0+Ⅰ+Ⅱ期患者,差异均有统计学意义(P<0.05或0.01)。以上结果表明,血清TBX3的表达与乳腺癌患者的年龄、月经状态无关,但与组织学分级、腋窝淋巴结转移、远处转移及TNM分期密切相关。
2.3 血清TBX3与乳腺癌常见分子标记物之间的关系 见表3。
由表3可见,142例乳腺癌患者ER、PR阳性率分别为69.01%(98/142)、67.61%(96/142),Her-2过表达率为33.10%(47/142)。142例乳腺癌患者中有94例进行了Ki-67的检测,结果Ki-67≥14%者占62.77%(59/ 94)。ER阳性及Her-2过表达者血清TBX3表达水平较ER阴性及Her-2低表达者明显升高,差异均有统计学意义(均P<0.05)。Ki-67≥14%者血清TBX3表达水平虽然高于Ki-67<14%者,但差异无统计学意义(P>0.05)。PR阳性者与PR阴性者血清TBX3的表达差异无统计学意义(P>0.05)。
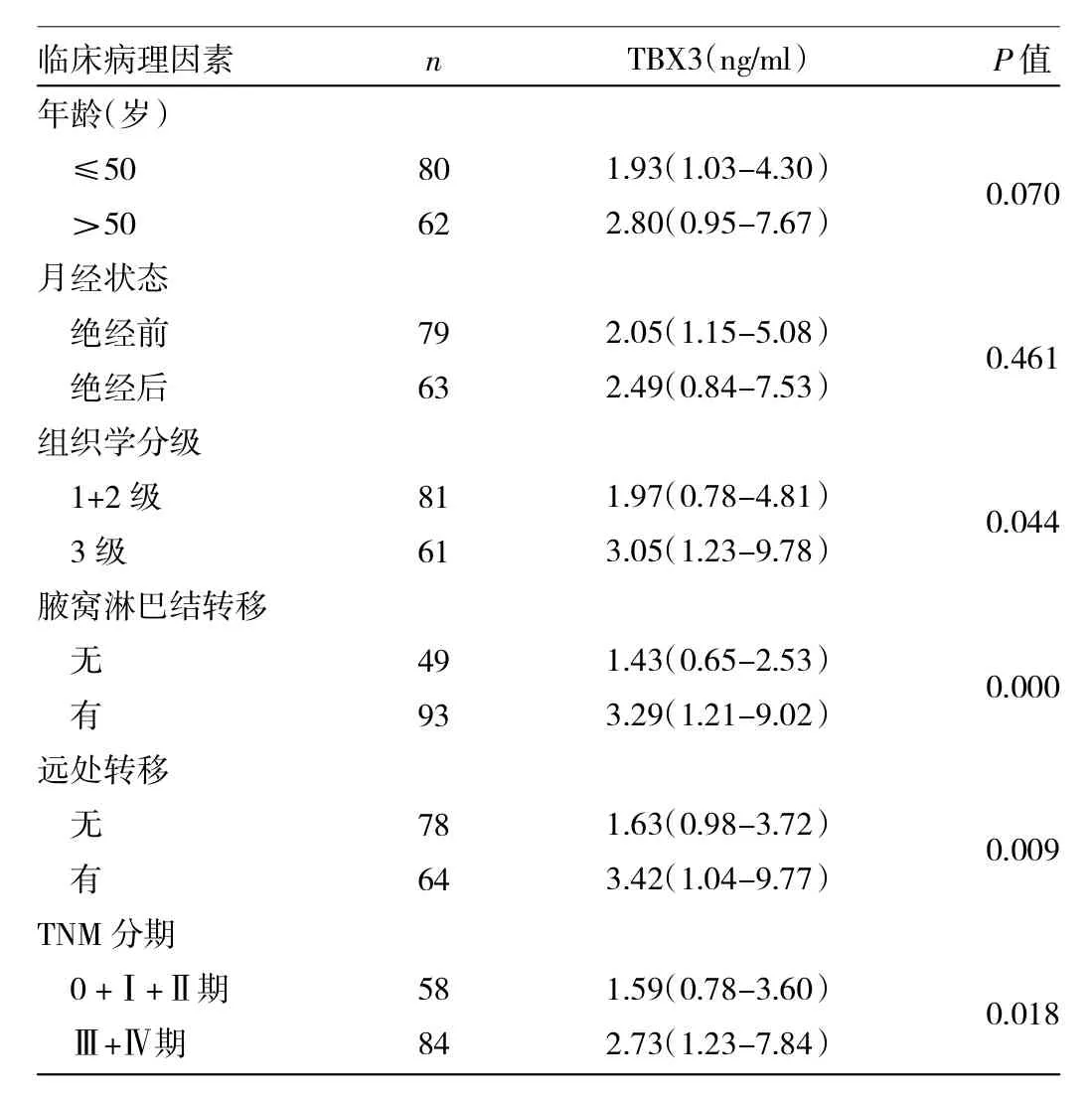
表2 乳腺癌患者血清TBX3的表达水平与临床病理特征的关系
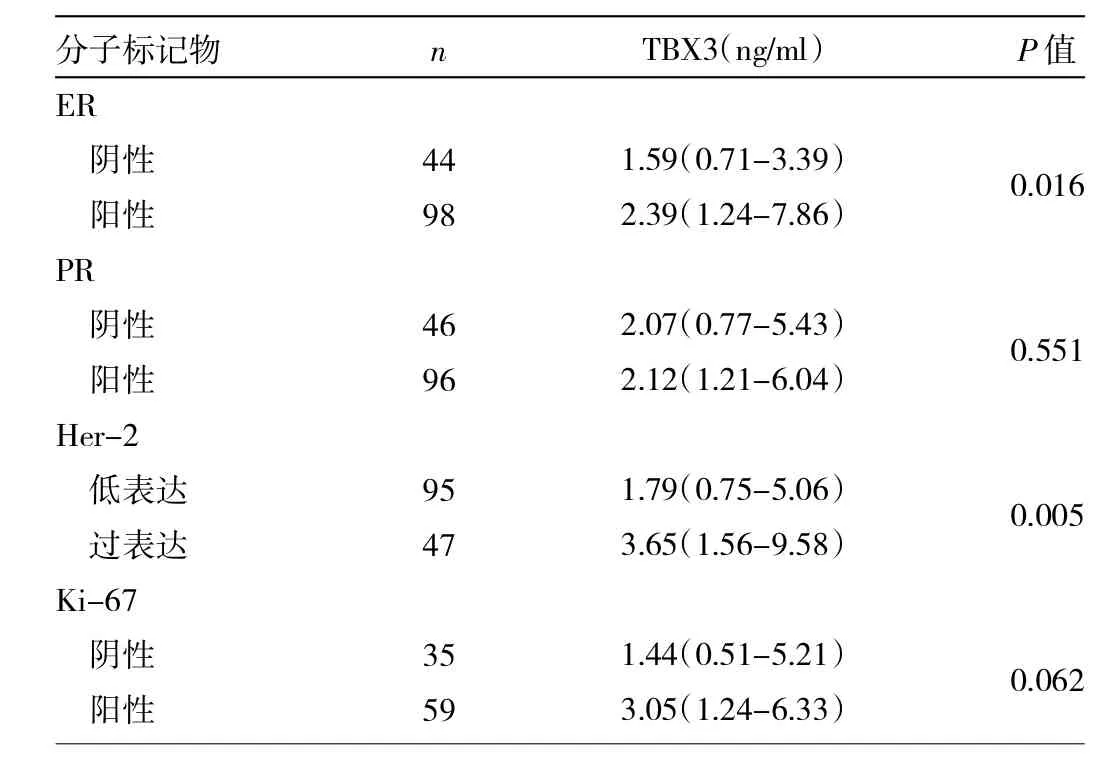
表3 血清TBX3与乳腺癌常见分子标记物之间的关系
3 讨论
TBX3基因是调控发育的转录因子基因家族成员之一,通过其表达产物TBX3蛋白调控哺乳动物的组织发育和细胞增殖。有研究表明,TBX3通过p19ARF(人p14ARF)/MdM2/p53和p21WAF1/CIP1等信号途径抑制抑癌基因p53及p21的转录和表达。因此,TBX3持续表达或高表达时细胞将绕过衰老途径而出现永生化和癌变,最终导致恶性肿瘤的发生。
现已明确,TBX3基因的缺失或突变是导致人类尺骨-乳腺综合征(ulnar-mammary syndrome,UMS)的主要原因[1],UMS是一种严重的常染色体显性遗传性疾病,乳腺发育障碍(包括发育不全和不发育)是该综合征的重要特征,提示TBX3基因参与乳腺的正常发育。Platonova等[4]发现TBX3是调节乳腺细胞生长的转录因子,其表达水平调控着乳腺细胞增殖的程度。近年来的研究进一步显示,TBX3在乳腺癌组织和细胞中均呈高表达,而大量表达的TBX3可以从乳腺癌组织和细胞中释放入血并引起血TBX3水平升高[1-2]。本研究采用ELISA法检测212例乳腺疾病患者和80例健康女性的血清TBX3水平,结果表明乳腺癌患者血清TBX3表达水平显著高于良性对照组及健康对照组,而健康对照组与良性对照之间血清TBX3表达水平的差异无统计学意义(P>0.05),和既往研究结果类似[5-6]。这不仅从血清学角度验证了TBX3在乳腺癌的发生和演进过程中可能发挥着重要作用,而且说明血清TBX3的检测或可成为临床鉴别乳腺良、恶性疾病的一个新的诊断方法。
有文献报道,随着乳腺癌进展,TBX3在癌组织中的表达明显增强[7]。陈忠华等[8]在TBX3与乳腺癌转移的相关性研究中发现,有转移的癌组织TBX3表达水平明显强于非转移的癌组织(P<0.05)。而叶英海等[9]研究则显示,有淋巴结转移乳腺癌组织中TBX3的阳性率为86.21%(25/29),明显高于无淋巴结转移的阳性率58.33%(14/ 24)(P<0.05)。本研究中乳腺癌患者伴有腋窝淋巴结转移及远处转移者血清TBX3表达水平显著高于无腋窝淋巴结转移及远处转移者(P<0.01),这说明血清TBX3和组织学TBX3一样,其表达水平随着淋巴结转移及远处转移而不断升高。最近一些研究阐明了TBX3在乳腺癌转移中的机制,持续高表达的TBX3抑制钙黏蛋白的表达,致使肿瘤细胞黏附性下降,细胞易于迁移和浸润,从而出现转移[2,10]。此外,笔者通过分析血清TBX3水平与TNM分期及组织分级的关系还发现,组织学3级、Ⅲ+Ⅳ期的乳腺癌患者血清TBX3水平较组织学1+2级、TNM分期0+Ⅰ+Ⅱ期患者显著增高,这提示血清TBX3的表达水平与组织学分级、TNM分期也存在密切关系。而淋巴结(远处)转移、TNM分期及组织学分级等临床病理因素均是判断乳腺癌预后的重要依据,因此,笔者推断血清TBX3表达水平不仅可以反映疾进展情况,还可以作为乳腺癌预后判断及随访监测的重要指标之一。
激素受体(ER、PR)和Her-2是目前临床上判断乳腺癌预后及指导治疗方案最重要的分子标记物。本研究中,ER、PR阳性率分别为69.01%、67.61%,Her-2过表达率为33.10%,与Althuis等[11]和Fiegl等[12]的研究结果基本一致。有研究报道,TBX3的表达与激素受体及Her-2的状态有关[9]。Fan等[13]对已知ER状态的27例乳腺癌细胞株研究后发现,ER阳性的癌细胞TBX3的过表达比例及表达水平均高于ER阴性者。国内叶英海等[9]研究发现,ER或Her-2阳性的乳腺癌组织中TBX3的阳性率明显高于ER阴性者及Her-2阴性者(84.38%、57.14%,93.75%、64.86%)。而刘志祥[6]则认为TBX3的表达水平与Her-2过表达正相关,但与ER阳性表达负相关。本研究结果显示,ER阳性及Her-2过表达者血清TBX3表达水平较ER阴性及Her-2低表达者明显升高,差异有统计学意义(P<0.05),与上述文献报道一致。Ki-67是乳腺癌细胞表达的一种核抗原,在乳腺癌诊断及判断预后方面也具有重要意义[14],因此,2011年的St.Gallen会议将Ki-67指数作为乳腺癌分子分型的指标之一[15]。本研究94例患者中,Ki-67阳性者为59例,阴性者为35例,血清TBX3水平在两组间虽然未见统计学差异,但仍可见血清TBX3在Ki-67阳性组的表达高于阴性组的趋势,可能与本组病例数不足有关,仍需进一步扩大样本量进行深入研究。
[1]Yarosh W,Barrientos T,Esmailpour T,et al.TBX3 is overexpressed in breast cancer and represses p14 ARF by interacting with histone deacetylases[J].Cancer Res,2008,68(3):693-699.
[2]Mowla S,Pinnock R,Leaner V D,et al.PMA-induced up-regulation of TBX3 is mediated by AP-1 and contributes to breast cancer cell migration[J].Biochem J,2011,433(1):145-153.
[3]Edge S B,Byrd D R,Compton C C,et al.AJCC cancer staging manual[M].7th.New York:Springer,2010:347-376.
[4]Platonova N,Scotti M,Babich P,et al.TBX3,the gene mutated in ulnar-mammary syndrome,promotes growth of mammary epithelial cells via repression of p19ARF,independently of p53[J]. Cell Tissue Res,2007,328(2):301-316.
[5]Lomnytska M,Dubrovska A,Hellman U,et al.Increased expression of cSHMT,Tbx3 and utrophin in plasma of ovarian and breast cancer patients[J].Int J Cancer,2006,118(2):412-421.
[6]刘志祥.Tbx3在乳腺癌患者血清中的表达差异及其临床意义[D].天津:天津医科大学,2008:14-39.
[7]邓军,刘友生,黄涛生,等.人乳腺癌组织中Tbx3基因表达变化及其意义[J].解放军医学杂志,2005,6(30):512-514.
[8]陈忠华,吕光明,季天海.TBX3基因mRNA在乳腺癌中表达的检测及其意义[J].南方医科大学学报,2009,29(1):87-89.
[9]叶海英,陈琦凡,叶正亮,等.Tbx3基因在乳腺癌组织中的表达和临床意义[J].中国医师进修杂志,2010,33(14):1-3.
[10]Rodriguez M,Aladowicz E,Lanfrancone L,et al.Tbx3 represses E-cadherin expression and enhances melanoma invasiveness [J].Cancer Res,2008,68(19):7872-7881.
[11]Althuis M D,Fergenbaum J H,Garcia-Closas M,et al.Etiology of hormone receptor-defined breast cancer:a systematic review of the literature[J].Cancer Epidemiol Biomarkers Prev,2004,13 (10):1558-1568.
[12]Fiegl H,Millinger S,Goebel G,et al.Breast cancer DNA methylation profiles in cancer cells and tumor stroma:association with HER-2/neu statusin primarybreast cancer[J].Cancer Res,2006, 66(1):29-33.
[13]Fan W,Huang X,Chen C,et al.TBX3 and its isoform TBX3+2a are functionally distinctive in inhibition of senescence and are overexpressed in a subset of breast cancer cell lines[J].Cancer Res,2004,64(15):5132-5139.
[14]Yerushalmi R,Woods R,Ravdin P M,et al.Ki-67 in breast cancer: prognostic and predictive potential[J].Lancet Oncol,2010,11(2): 174-183.
[15]Goldhirsch A,Wood W C,Coates A S,et al.Strategies for subtypes--dealing with the diversity of breast cancer:highlights of the St.Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2011[J].Ann Oncol,2011,22(8): 1736-1747.
Serum TBX3 levels in patients with breast cancer and its relationship with clinicopathological characteristics
Objective To investigate serum T-box 3 (TBX3)levels in patients with breast cancer and its relationship with clinical and pathological characteristics.Methods Serum TBX3 levels were determined by Enzyme linked immunosorbent assay (ELISA)in 142 patients with breast cancer,70 patients with benign breast lesions and 80 healthy subjects.The correlations of serum TBX3 level with age,menstruation status,histological grade,axillary lymph node and distance metastasis,TNM staging and ER,PR,Ki-67,Her-2 levels were analyzed. Results The concentration of serum TBX3 was 2.13(1.01-6.15)ng/ml in patients with breast cancer and significantly higher than those in healthy subjects[1.60(0.99-2.18)ng/ml,P<0.01]and patients with benign breast lesions [1.58(0.71-3.18)ng/ml,P<0.05].Serum TBX3 levels in breast cancer patients were positively correlated with the histological grading,TNM staging,axillary lymph node and distance metastasis,but not correlated with the menstruation status and age of patients.Furthermore,serum TBX3 in ER positive and Her-2 over-expressed patients were significantly higher than those in ER negative and Her-2 low-expressed ones(P<0.05),while there was no significant difference in serum Tbx3 between the PR positive and PR negative,Ki-67 positive and Ki-67 negative patients(P>0.05). Conclusion Serum TBX3 is over-expressed in breast cancer,which is significantly correlated with histological grade,axillary lymph node and distance metastasis,TNM staging,ER and Her-2 status,indicating that it may serve as a biomarker for breast cancer and have potential clinical applications.
Breast cancerSerum T-box 3(TBX3) Enzyme linked immunosorbent assay(ELISA)Biomarker

2012-11-01)
(本文编辑:严玮雯)
杭州市科技发展计划项目(20100633B05)
310006 杭州市第一人民医院肿瘤外科(丁金旺、罗定存、张卧、潘钢、秦卫民),中心实验室(王克义),体检中心(蔡菊芳);浙江大学医学院附属第二医院肿瘤外科(邓甬川、周美琪);浙江省肿瘤医院检验科(叶柳青)
罗定存,E-mail:ldc65@163.com
