类风湿关节炎患者血清骨形态发生蛋白6和铁调素与贫血的关系
2013-04-17邬秀娣张振陈勇谢斌华干敏芝黄娴倩刘磊
邬秀娣 张振 陈勇 谢斌华 干敏芝 黄娴倩 刘磊
类风湿关节炎患者血清骨形态发生蛋白6和铁调素与贫血的关系
邬秀娣 张振 陈勇 谢斌华 干敏芝 黄娴倩 刘磊
目的 探讨类风湿关节炎(RA)患者骨形态发生蛋白6(BMP-6)和铁调素(Hepc)与贫血的关系。 方法 采用酶联免疫吸附法测定99例RA患者、19例系统性红斑狼疮(SLE)患者、40例健康志愿者的血清BMP-6、Hepc水平,同时检测RA患者的红细胞计数(RBC)、血红蛋白水平(HGB)、白细胞介素6(IL-6)、血清铁(SI)、血清可溶性转铁蛋白受体(sTfR)、铁蛋白(SF),分析比较RA组与SLE组和健康对照组、RA患者贫血组与非贫血组、慢性病性贫血(ACD)与慢性病伴缺铁性贫血(IDA+ACD)组间及不同疾病活动度组间BMP-6、Hepc和其他贫血相关指标,以及RA患者血清BMP-6和Hepc水平与其他因素间的相关性。结果 RA患者贫血发生率为59.6%,其中ACD占52.5%,IDA+ACD占47.5%。血清BMP-6和Hepc水平在RA患者中明显升高,与SLE组、健康对照组的差异均有统计学意义(均P<0.05)。RA贫血组的IL-6水平及类风湿关节炎疾病活动性评分(DAS28)较非贫血组均明显升高,差异有统计学意义(P<0.05),而两者SI、SF、BMP-6和Hepc水平的差异均无统计学意义(均P>0.05);RA伴ACD患者的血清SF、Hepc、BMP-6水平及DAS28评分均明显高于RA伴IDA+ACD组,差异均有统计学意义(均P<0.05)。DAS28>5.1的RA疾病高度活动组血清BMP-6及Hepc较DAS28评分≤5.1的疾病非高度活动组明显升高,而HGB水平明显降低,差异均有统计学意义(均P<0.05)。RA患者的血清BMP-6与Hepc水平呈正相关(P<0.01),且两者均与IL-6、DAS28呈正相关(P<0.05),BMP-6还与SI呈正相关(P<0.05)。 结论 RA患者贫血类型以ACD为主,其血清BMP-6和Hepc水平均明显升高,在伴ACD或疾病高度活动的RA患者中升高尤其明显,且互相关系密切,说明BMP-6和Hepc水平异常正是诱导RA患者发生ACD的主要因素之一,两者可能可以作为RA患者ACD治疗的靶点,其在RA中的作用机制值得进一步研究探索。
类风湿关节炎 铁调素 骨形态发生蛋白6 贫血
类风湿关节炎(rheumatoid arthritis,RA)是一种常见的全身性慢性炎症性疾病,贫血为RA患者中最常见的关节外症状之一,发生率在30%~60%。RA患者合并严重的贫血时可加重全身症状及关节功能障碍,从而影响预后。目前,已有许多研究都提示RA贫血的发病机制可能不同于普通贫血[1]。铁调素(hepcidin,Hepc)是2000年发现的铁代谢调节因子,与贫血关系十分密切[2];骨形态发生蛋白-6(bone morphogenetic protein-6,BMP-6)是转化生长因子β(TGF-β)超家族的一员[3],有研究提示其通过对Hepc的调节作用参与了铁代谢[4]。笔者为进一步探讨BMP-6及Hepc在RA贫血发病机制中的作用,开展横断面探索性研究,现报道如下。
1 资料和方法
1.1 一般资料 选择2011-10—2013-03在我科住院、有完整资料的患者,其中RA患者(RA组)99例,男18例,女81例,年龄32~71岁,平均(55.82±14.52)岁;均符合2010年美国风湿病学会/欧洲抗风湿联盟(ACR/ EULAR)修订的RA分类标准[5]。系统性红斑狼疮患者(SLE组)19例,其中男2例,女17例,年龄28~65岁,平均(45.63±13.38)岁;诊断均符合1997年ACR修订的分类标准[6]。选择同期在我院体检中心体检的健康志愿者40例作为健康对照组,男8例,女32例,年龄30~65岁,平均(53.45±11.73)岁。排除标准:合并除RA和SLE及其继发疾病外的其他慢性系统疾病及急、慢性感染;恶性肿瘤;严重肝、肾功能异常(血清总胆红素、丙氨酸转氨酶、天冬氨酸转氨酶>2倍参考值上限,血清肌酐、尿素氮>1.5倍参考值上限);半年内有明确出血史、手术史或分娩史;妊娠3个月内;有补充铁剂治疗或生物制剂治疗史。健康对照组参照个人档案及其他检查结果,排除已患有急、慢性疾病者。本研究得到本院医学伦理委员会批准,所有参与者均知情并同意其血液用于临床研究。3组性别、年龄的差异均无统计学意义(均P>0.05)。
1.2 方法 所有标本为空腹12h以上后于次日清晨7: 00~9:00抽取外周静脉血15ml,其中5ml立即用于检测血沉(ESR)、血常规[含红细胞计数(RBC)和血红蛋白含量(HGB)],另10ml予2 000r/min离心10min后,取血清,检测C反应蛋白(CRP)及血清铁蛋白(SF)。剩余血清置于-80℃冰箱中保存,待统一融解后用于检测血清BMP-6、Hepc、白细胞介素6(IL-6)、血清铁(SI)及血清可溶性转铁蛋白受体(sTfR)5项。ESR检测采用魏氏法,血常规及CRP、SF的检测分别使用Beckman-Coulter公司生产的全自动血球计数仪和Array360特定蛋白分析仪;SI采用购自Blue-Gene公司的试剂盒检测;Hepc、IL-6使用购自Green-Gene公司的试剂盒,BMP-6及sTfR采用购自R&D System公司的试剂盒,该4项检测均采用双抗体一步夹心法酶联免疫吸附试验,按照说明书步骤操作,并绘制标准曲线。
1.3 监测指标 疾病活动性评估采用类风湿关节炎疾病活动性评分(DAS28),由关节肿胀数、压痛数、患者自我综合评分、ESR、CRP构成,DAS28评分≤5.1分认为疾病非高度活动,>5.1分认为高度活动。将男性HGB<120g/L、女性HGB<110g/L者定义为贫血。将贫血患者中sTfR/logSF指数<1.5者界定为单纯慢性病性贫血(ACD),sTfR/logSF≥1.5为慢性病伴缺铁混合性贫血(IDA+ACD)[7]。
1.4 统计学处理 采用SPSS17.0统计软件。计量资料呈非正态分布的以中位数(四分位数范围)表示,两两比较采用Mann-Whitney U检验,两个以上样本比较采用Kruskal-Wallis检验;正态分布的以表示,两独立样本比较采用t检验,两个以上独立样本比较采用方差分析,两两比较采用SNK检验;服从正态分布的双变量采用Pearson相关分析,否则采用Spearman秩相关分析。
2 结果
2.1 一般资料 RA组贫血患者为59例(59.6%),其中ACD 31例(52.5%),IDA+ACD 28例(47.5%);SLE组贫血7例,占36.8%;对照组贫血3例,占7.5%。
2.2 3组间实验室检测结果的比较 见表1。
由表1可见,与健康对照组比较,RA组血清Hepc、BMP-6及SI水平均明显升高,差异均有统计学意义(均P<0.01);与SLE组比较,RA组血清Hepc、BMP-6及SI水平也明显升高,差异有统计学意义(P<0.05);同时,RA组的HGB水平也低于健康对照组,差异有统计学意义(P<0.05),但与SLE组的差异无统计学意义(P>0.05);而SLE组、健康对照组RBC、SF的差异均无统计学意义(均P>0.05)。与健康对照组比较,SLE组SI水平明显升高,HGB水平则降低,差异有统计学意义(P<0.05),但Hepc、BMP-6、RBC及SF水平的差异均无统计学意义(均P>0.05)。

表1 3组间实验室检测结果的比较
2.3 RA患者中贫血组和非贫血组间各种贫血相关因子及DAS28指数、IL-6、BMP-6和Hepc水平的比较 本研究结果显示,贫血组的IL-6水平及DAS28评分分别为(164.56±126.25)pg/ml、(5.73±1.87)分,均明显高于非贫血组[(112.13±119.56)pg/ml、(4.52±1.68)分],差异有统计学意义(P<0.05);而两组年龄、病程和血清SI、SF、BMP-6及Hepc的差异均无统计学意义(均P>0.05)。
2.4 RA患者ACD组与ACD+IDA组实验结果的比较 见表2。

表2 RA贫血患者ACD组与ACD+IDA组实验结果的比较
由表2可见,ACD组的血清SF、Hepc、BMP-6水平及DAS28评分均明显高于IDA+ACD组,差异均有统计学意义(均P<0.05);而病程以及年龄、RBC、HGB、SI和IL-6在两组的差异均无统计学意义(均P>0.05)。
2.5 RA患者疾病非高度活动组与高度活动组间结果的比较 在RA患者中DAS28评分≤5.1的疾病非高度活动患者共45例,DAS28评分>5.1的疾病高度活动患者共54例,疾病高度活动组患者的血清SF、Hepc、BMP-6水平分别为(189.99±135.31)μg/L、(14.71±8.16)ng/ml、(0.56±0.30)ng/ml,明显高于疾病非高度活动组[(109.79±97.53)μg/L、(6.04±5.38)ng/ml、(0.27±0.16)ng/ml];疾病高度活动组HGB为(100.02±18.70)g/L,明显低于疾病非高度活动组[(114.87±14.05)g/L],差异均有统计学意义(均P<0.05),而年龄、RBC、SI及IL-6在两组间的差异均无统计学意义(均P>0.05)。
2.6 RA患者血清BMP-6及Hepc与其他贫血相关因素间的相关性分析结果 见表3。
由表3可见,RA患者的血清Hepc与BMP-6呈正相关(P<0.05);而Hepc与BMP-6均同时与IL-6、DAS28评分呈正相关(P<0.05)。此外,BMP-6与SI呈正相关(P<0.05)。但Hepc、BMP-6和年龄、RBC、HGB及SF均无相关性(均P>0.05)。
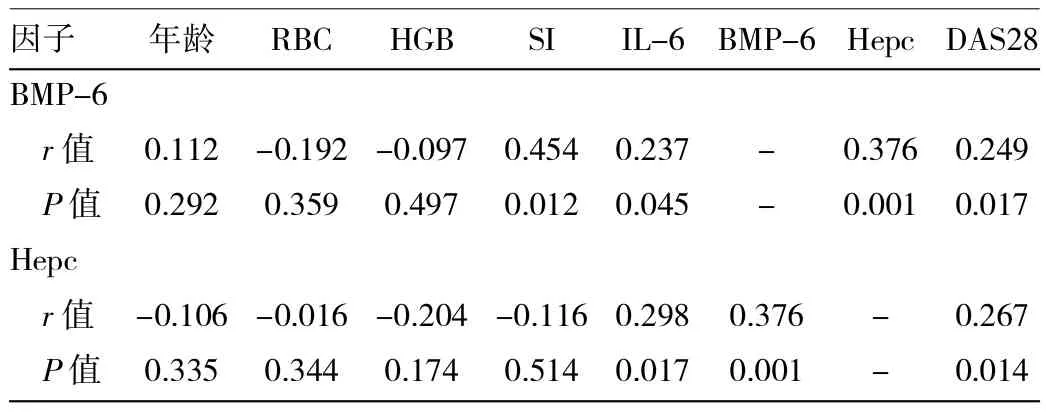
表3 RA患者BMP-6和Hepc与其他因素相关性分析结果
3 讨论
RA患者伴发贫血的原因很多,铁摄入不足、药物影响胃肠道引起的失血等原因均可引起IDA,但由于RA是一个慢性炎症性疾病,故普遍认为在RA患者中没有单纯IDA,更多的是ACD或ACD+IDA混合,其体内铁储存往往是正常或偏高的[8]。本研究结果表明,在RA患者中,贫血的发生率高达59.6%,不仅比正常人群高,也比SLE患者的贫血发生率高;同时,RA患者在HGB明显偏低的状态下,其SF水平与对照组无统计学差异,SI水平反而明显升高,均与Wahle等[9]结论一致,提示RA患者的铁储存并不缺乏,其贫血由炎症导致的比重更大。进一步比较RA患者中贫血与非贫血的患者可以发现,两组SI、SF均无统计学差异,这也说明RA患者的贫血并非由于铁缺乏导致。为更进一步分析,本研究采用sTfR/logSF指数将RA贫血患者分成两组进行比较。由于区分RA患者的ACD和ACD+IDA混合性贫血的诊断体系十分复杂,缺乏可靠的单一指标,Abdel等[7]认为在RA炎症性贫血时,其sTfR往往不高,而SF往往是正常或升高的,故设定sTfR/logSF指数<1.5为单纯ACD,而sTfR/logSF指数≥1.5为ACD+IDA混合性贫血,这单一指数鉴别方法也被很多研究者采用[10]。本研究也采用此指数区分RA贫血患者,发现单纯ACD患者占52.5%,ACD+IDA混合性贫血患者则为47.5%;ACD组的血清SF水平及DAS28评分均明显高于IDA+ ACD组,而RBC、HGB、SI在两组间无统计学差异。因此,在RA患者中,ACD是主要的贫血类型,缺铁并不是导致贫血的主要因素,推测疾病活动导致的相关炎症反应才是引起并加重贫血的主要因素。
Hepc是铁代谢的关键因子,在维持机体铁稳态中发挥着关键性作用,其受血清铁水平和细胞内铁储存状态的调节,当机体铁过多时将刺激Hepc生成,进而阻止肠道铁吸收,减少巨噬细胞释放细胞内储存铁,防止铁超载发生;而缺铁时将抑制Hepc生成,通过增加肠道铁吸收,促进细胞内储存铁释放,来弥补机体铁不足。铁和Hepc的这种反馈调节环路确保了机体铁稳定。因此,Hepc过多可导致铁利用障碍性贫血,而Hepc过少可导致肝或其他实质性脏器铁沉积[2]。近年来的研究发现Hepc水平还受炎症的调节[11],炎症可以刺激Hepc的生成,Nemeth等[12]和Lee等[13]研究发现,IL-6是炎症时刺激Hepc的升高的主要炎症因子;已有学者发现在RA患者中Hepc水平与IL-6水平呈正相关,提示IL-6的升高导致了Hepc的升高,从而引起或加重RA患者的贫血[14],说明在RA患者体内,Hepc不仅仅局限于受铁水平和贫血的调控,还受IL-6的调控,是IL-6的下游炎症因子之一。而BMP-6由骨髓间充质干细胞及造血干细胞生成[3],有研究认为BMP-6在骨代谢中发挥重要作用[15]。而Qi等[4]与Atndt等[16]研究发现,BMP-6与Hepc及铁代谢有关;Qi等发现小鼠血清铁蛋白水平的升高可以同时上调肝脏表达的BMP-6及Hepc水平,而Atndt等进一步证实BMP-6可以不依赖IL-6而强烈诱导Hepc合成。Andriopoulos等[17]的研究进一步表明,BMP-6不仅是IL-6上调Hepc的关键性信号因子,还直接参与了铁代谢,可以感应到机体内铁水平的变化,在SI水平下降时随之降低并下调Hepc生成,SI升高时上调Hepc的生成。但目前关于BMP-6及Hepc关系的研究很少,且多局限于动物实验和体外实验,在RA患者中的研究需要进一步的探索。本研究结果发现,RA患者的血清BMP-6与DAS28评分、SI、IL-6及Hepc均存在正相关,符合Andriopoulos的研究推论[17],推测IL-6和BMP-6、Hepc为同一个信号通路上的因子,共同参与了RA的炎症。
一般情况下,RA患者贫血高发,HGB明显降低,血清BMP-6及Hepc也应该降低,但本研究结果发现,RA患者血清Hepc、BMP-6水平明显高于SLE患者及健康对照组,提示BMP-6及Hepc在RA中存在异常的作用机制。进一步分析发现,RA患者中疾病高度活动组血清Hepc、BMP-6水平明显高于疾病非高度活动组,而HGB则降低;同时,RA伴贫血患者的IL-6水平及DAS28评分均明显升高,而血清BMP-6及Hepc与非贫血组间均无统计学差异。这些结果进一步提示,RA患者BMP-6及Hepc水平不受HGB的调控,而在疾病高度活动时,RA相关的炎症反应还上调了Hepc和BMP-6水平,同时加重了贫血。在RA合并贫血的患者中还发现单纯ACD组的Hepc、BMP-6水平均高于IDA+ACD组,但两组的HGB水平并无差异。这也说明,RA患者BMP-6和Hepc水平异常升高后在不缺铁的患者中可能促进了贫血的发生,其作用相当于缺铁导致的促贫血作用,进一步提示BMP-6及Hepc水平在RA中受到炎症的调控,不仅失去了对贫血的感应,还反过来促进了炎症性贫血,而根据Nemeth等[12]和Lee等[13]的研究结论,推测这些作用很可能正是通过IL-6介导的。大量研究已经证实了IL-6在RA发病机制中的重要作用,Hashizume等[18]也认为IL-6正是诱导RA患者中Hepc生成并进一步导致ACD的主要炎症因子。那么,根据这些结果,可以推测在RA患者疾病活动时,由于IL-6的刺激和诱导作用,血清BMP-6及Hepc均明显升高,这种明显的上调作用干扰了BMP-6及Hepc对贫血和铁代谢的正常感应及调节作用,直接导致了铁代谢紊乱及ACD的发生。因此在RA患者中,IL-6、BMP-6及Hepc作为同一条信号通路上的炎症因子,是诱导RA患者发生ACD的主要因素。为进一步证实BMP-6及Hepc在RA贫血发病机制中的作用,本研究还分析了RA患者血清BMP-6与Hepc之间及它们与其他贫血相关因素之间的相关性,结果发现RA患者的血清Hepc与BMP-6呈正相关,且两者均与IL-6、疾病活动性评价指标DAS28评分呈正相关,而与RBC、HGB及SF均不相关,也从另一个角度证实了笔者的推测,说明在RA患者中,BMP-6及Hepc作为铁代谢调节因子对贫血和铁水平的调控作用受到了炎症的干扰,而使其更多地是作为炎症因子发挥作用并导致了ACD的发生。
Koca等[19]研究发现RA患者的Hepc水平比SLE患者明显升高,SLE患者的Hepc水平无升高。本研究结果也发现SLE患者的Hepc水平与对照组无差异,与上述结论一致;同时,SLE患者的BMP-6水平也明显低于RA,与健康对照组无差异。因此,笔者推测BMP-6和Hepc的异常升高可能在RA患者中表现更明显,这可能与IL-6在RA中的作用有关,也可能正是RA患者贫血发生率高于SLE的原因所在。但由于SLE患者的BMP-6相关研究欠缺,且本研究中SLE患者样本量较小,故上述推论尚需进一步证实。
综上所述,RA患者的贫血发生率高,且缺铁并不明显,其贫血类型以ACD为主。RA患者的血清BMP-6和Hepc水平均明显升高,相互之间关系密切,且均与IL-6和疾病活动性呈正相关,推测在RA患者疾病活动时,由于IL-6的刺激和诱导作用,BMP-6及Hepc失去了对贫血和铁代谢的正常感应及调节作用,而是作为炎症因子导致了铁代谢紊乱和ACD的发生。IL-6、BMP-6及Hepc作为同一条信号通路上的炎症因子,是诱导RA患者发生ACD的主要因素。BMP-6和Hepc可能可以作为RA患者ACD治疗的靶点,其在RA中的作用机制值得进一步研究探索。
[1]Han C,Rahman M U,Doyle M K,et al.Association of anemia and physical disability among patients with rheumatoid arthritis[J].J Rheumatol,2007,34(11):2177-2182.
[2]Viattle L,Vaulont S.Hepcidin,the iron watcher[J].Biochimie,2009, 91(10):1223-1228.
[3]Vukicevic S,Grgurevic L.BMP-6 and mesenchymal stem cell differentiation[J].Cytokine Growth Factor Rew,2009,20(5-6):441-448.
[4]Qi Feng,Mary C M,Abdul W,et al.Ferritin upregulates hepatic expression of bone morphogenetic protein 6 and hepcidin in mice [J].Am J Physiol Gastrointest Liver Physiol,2012,302(12):G1397-1404.
[5]Aletaha D,Neogi T,Silman A J,et al.2010 Rheumatoid arthritis classification criteria:an American College of Rheumatology/European League Against Rheumatism collaborative initiative[J]. Arthritis Rheum,2010,62(9):2569-2581.
[6]Hochberg M C.Updating the American College of Rheumatology revised criteria for the classification of systemic lupus erythematosus[J].Arthritis Rheum,1997,40(9):1725.
[7]Abdel K M,EL-Barbary A M,Essa S A,et al.Serum Hepcidin:a direct link between anemia of inflammation and coronary artery atherosclerosis in patients with rheumatoid arthritis[J].J Rheumatol,2011,38(10):2153-2159.
[8]Masson C.Rheumatoid anemia[J].Joint Bone Spine,2011,78(2): 131-137.
[9]Wahle M.Anemia in patients with rheumatoid arthritis[J].Z Rheumatol,2012,71(10):864-868.
[10]陈波斌,林果为,倪赞明,等.血清转铁蛋白受体和血清铁蛋白在鉴别慢性病性贫血和缺铁性贫血价值的评价[J].中华血液学杂志,2000, 21(1):44-45.
[11]Nicolas G,Chauvet C,Viatte L,et al.The gene encoding the iron regulatory peptide hepcidin is regulated by anemia,hypoxia,and imflammation[J].J Clin Invest,2002,110(7):1037-1044.
[12]Nemeth E,Rivera S,Gabayan V,et al.IL-6 mediates hypoferremia of inflammation by inducing the synthesis of the iron regulatory hormone hepicidin[J].J Clin Invest,2004,113(9):1271-1276.
[13]Lee P,Peng H,Gelbart T,et al.Regulation of Hepcidin transcription by interleukin-1 and interleukin-6[J].J Proc Natl Acad Sci USA,2005,102(6):1906-1910.
[14]Kim H R,Kim K W,Yoon S Y,et al.Serum pro-hepcidin could reflect disease activity in patients with rheumatoid arthritis[J].J Korean Med Sci,2010,25(3):348-352.
[15]Simic P,Culej J B,Orlic I,et al.Systemically administered bone morphogenetic protein-6 restores bone in aged overiectomized rats by increasing bone formation and suppressing bone resorption[J].J Biol Chem,2006,281(35):25509-25521.
[16]Atndt S,Maegdifran U,Dorn C,et al.Iron-induced expression of bone morphogenetic protein 6 in intestinal cells is the main regulator of hepatic hepcidin expression in vivo[J].Gastroenterology,2010,138(1):372-382.
[17]Andriopoulos B Jr,Corradini,Xia Y,et al.BMP-6 is a key endogenous regulator of hepcidin expression and iron metabolism [J].Nat Genel,2009,41(4):482-487.
[18]Hashizume M,Mihara M.The roles of interleukin-6 in the pathogenesis of rheumatoid arthritis[J].Arthritis,2011,2011(10):765624.
[19]Koca S S,Isik A,Ustundag B,et al.Serum pro-Hepcidin levels in rheumatoid arthritis and systemic lupus erythematosus[J].Inflammation,2008,31(3):146-153.
Association of serum bone morphogenetic protein-6 and hepcidin levels with anemia in patients with rheumatoid arthritis
Objective To investigate the association of serum bone morphogenetic protein-6(BMP-6)and hepcidin (Hepc)levels with anemia in patients with rheumatoid arthritis(RA).Methods Blood samples were collected from 99 patients with RA,19 patients with systemic lupus erythematosus(SLE)and 40 healthy controls.Serum BMP-6,Hepc and IL-6 were measured by ELISA,and serum iron(SI),ferritin(SF),soluble transferrin receptor(sTfR)levels were also determined.The correlation of BMP-6 and Hepc levels with anemia and disease activity score for 28 joints(DAS28)was analyzed by SPSS software.Results In 99 RA patients,59(59.6%)were complicated with anemia,including 30 patients(52.5%)with anemia of chronic disease(ACD)having sTfR/logSF index value<1.5,and 29(47.5%)with anemia of chronic disease and coexistent iron deficiency anemia(ACD+IDA) having sTfR/logSF index value≥1.5.Serum BMP-6 and Hepc levels in RA patients were higher than those in healthy controls or SLE(P<0.05).DAS28 scores and serum IL-6 were higher in anemic RA patients than in RA patients without anemia (P<0.05), but no differences were observed in levels of SI,SF,BMP-6 and Hepc between two groups.The levels of SF,BMP-6,Hepc and DAS28 score was higher in RA patients with ACD than those in RA patients with ACD+IDA(P<0.05).Hemoglobin levels in RA patients with high DAS28 scores(>5.1)were lower than those with low DAS28 scores(≤5.1),while serum BMP-6 and Hepc levels were higher in RA patients with high DAS28 scores than those with low DAS28 scores(P<0.05).In RA patients,the level of serum BMP-6 was positively correlated with Hepc,IL-6,SI and DAS28 scores(P<0.01).And the level of serum Hepc was positivelycorrelated with IL-6 and DAS28 scores(P<0.05).Conclusion The serum levels of BMP-6 and Hepc are high in RA patients,especially in patients with ACD or high DAS28 scores.The correlation between BMP-6,Hepc and IL-6 suggests that BMP-6 and Hepc may induce ACD in RA and might be used as therapeutic target for ACD in RA.
Rheumatoid arthritis Hepcidin BMP-6 Anemia

2013-07-16)
(本文编辑:严玮雯)
(本文由浙江省医学会风湿病学分会推荐)
宁波市自然科学基金(2013A610265)
315010 宁波市第二医院风湿免疫科
邬秀娣,E-mail:awu1100@aliyun.com
