HIF-1α及VEGF在类风湿关节炎成纤维样滑膜细胞中的表达及意义
2013-04-17彭勇陈勇邬秀娣罗晶张振黄娴倩干敏芝
彭勇 陈勇 邬秀娣 罗晶 张振 黄娴倩 干敏芝
HIF-1α及VEGF在类风湿关节炎成纤维样滑膜细胞中的表达及意义
彭勇 陈勇 邬秀娣 罗晶 张振 黄娴倩 干敏芝
目的 研究类风湿性关节炎(RA)患者滑膜细胞在体外常氧和缺氧培养条件下缺氧诱导因子-1α(HIF-1α)和血管内皮生长因子(VEGF)表达的差异性及意义。 方法 对RA患者及骨关节炎(OA)患者的关节滑膜细胞在体外常氧和缺氧条件下分别进行培养,根据培养条件分为常氧组、缺氧6h组及缺氧12h组;采用免疫印迹法分别检测各组成纤维样滑膜细胞的HIF-1α及VEGF的表达情况。结果 与常氧组相比,缺氧6h及12h的RA和OA患者滑膜细胞的HIF-1α及VEGF的表达均显著增加,差异均有统计学意义(均P<0.05)。同时RA和OA患者缺氧12h组滑膜细胞HIF-1α及VEGF的表达高于缺氧6h组,差异均有统计学意义(均P<0.05)。RA和OA患者3组滑膜细胞的HIF-1α及VEGF的表达均呈正相关(均P<0.05)。常氧组RA与OA患者滑膜细胞的HIF-1α及VEGF的表达均无统计学差异(均P>0.05);而缺氧6h和12h组中RA滑膜细胞HIF-1α及VEGF的表达均高于OA滑膜细胞,差异均有统计学意义(均P<0.05)。 结论 在缺氧条件下RA患者滑膜细胞HIF-1α及VEGF表达显著升高且密切相关,可能缺氧—HIF-1α—VEGF这一信号途径在RA的发生、发展中起着重要作用。
类风湿性关节炎 骨关节炎 滑膜细胞 缺氧诱导因子-1α 血管内皮生长因子
类风湿性关节炎(rheumatoid arthritis,RA)是一种 慢性系统性的以侵蚀性关节炎症为主要表现的自身免疫病,其基本病理表现为滑膜炎和血管翳的形成。而骨关节炎(osteoarthritis,OA)是一种最为常见的慢性关节退行性疾病,其特征在于关节软骨的变性、破坏以及软骨下骨的改变。目前的研究已经证实RA受累关节微环境中存在缺氧[1];并发现缺氧在RA血管新生中起着关键调节作用,包括诱导炎症细胞的浸润及炎症因子[如血管内皮生长因子(VEGF)]的产生[2]。体内细胞缺氧反应的核心调节因子是缺氧诱导因子(HIF-1α)。缺氧时,HIF-1α可以激活40多种低氧适应性基因的表达,在RA成纤维细胞中参与能量代谢、细胞内信号转导、血管生成、免疫及炎症反应等的调节基因的表达均被上调[3]。VEGF是一种较强的刺激血管新生的物质,在血管新生中起着核心的作用。近年来有学者提出关节滑膜的炎症在OA的发病过程中也起着十分重要的作用,尤其在发病的早期[4];新生血管的形成也参与了OA关节软骨的破坏[5]。因此,HIF-1α和VEGF可能在RA和OA的发病过程中均起着重要的作用。笔者采用蛋白免疫印迹法(Western blot)体外检测RA和OA患者成纤维样滑膜细胞在常氧和缺氧培养条件下HIF-1α和VEGF蛋白表达水平,分析两者表达的差异性及相关性,探讨其在RA发病机制中的作用。
1 材料和方法
1.1 材料 无菌获取宁波市第二医院及宁波市第六医院关节外科行关节置换术的RA和OA患者各9例的滑膜组织。RA患者中男2例,女7例,年龄42~64岁,平均(54.3±10.5)岁;均符合2010年美国风湿病学会/欧洲风湿病联盟(ACR/EULAR)的类风湿新关节炎分类标准[6]。OA患者中男4例,女5例,年龄54~75岁,平均(60.6±8.7)岁;均符合1995年ACR的OA诊断标准[7]。标本获取前经两家医院医学伦理委员会批准,且均获得患者同意并签订知情同意书。标本获取后置于盛有20ml无血清的DMEM培养基的50ml离心管中,2h内运送至实验室进行处理。
1.2 主要试剂和仪器 眼科剪;眼科镊;细胞培养皿及培养瓶(美国NUNC公司);DMEM培养基及胎牛血清(FBS)(美国Hyclone/Thermo Scientific公司);Tris-HCl缓冲液(TBS)及含0.2%吐温的TBS缓冲液(上海索莱宝公司);总蛋白提取试剂盒(北京索莱宝科技有限公司);BCA蛋白定量试剂盒(上海捷瑞生物工程有限公司);PVDF膜(美国Millipore公司);兔抗人HIF-1α多克隆抗体(一抗)(美国Cell Signaling公司);兔抗人VEGF多克隆抗体(一抗)(美国Canta Cruz公司);兔抗人β-actin单抗(一抗)及鼠抗兔二抗(北京博奥森生物技术有限公司);Western Bright Quantum增强型发光底物(APG BIO环亚生物科技有限公司);Bio-Rad蛋白凝胶电泳仪(美国Bio-Rad公司);Thermo Scientific转膜系统(美国Thermo公司);Tanon-4200SF全自动数码凝胶图像分析系统(中国上海天能仪器有限公司)。
1.3 方法
1.3.1 滑膜细胞培养 将无菌的滑膜组织于生物安全柜中,在100mm细胞培养皿中用眼科剪和镊子去除组织块表面血污及脂肪组织,PBS缓冲液清洗2遍。将组织块转移至新的盛有DMEM培养基(含抗生素)的培养皿内,用新的眼科剪和镊子将组织块剪成1mm3的小块;用枪头或者眼科弯镊,将组织块摆放至新的25cm2的培养瓶内,间隔1cm左右,将培养瓶倒置(组织块面朝上)于细胞培养箱中。孵育4h后向瓶内加入含15% FBS和青、链霉素双抗的DMEM培养基5ml,然后将培养瓶轻轻翻转让培养基浸没组织块,置于培养箱内常规培养24h后换液,以后每隔2~3d换液。培养期间偶有组织块离壁、漂浮,即时换液去除漂浮组织块。待细胞汇集占瓶底面积90%时采用0.25%胰酶常规消化传代,实验所用滑膜细胞均采用第3~5代滑膜细胞。
1.3.2 实验分组 将生长至90%左右的RA和OA第3~5代滑膜细胞均分为常氧组、缺氧6h组和缺氧12h组,分别将细胞置于常氧条件下(21%O2+5%CO2)和缺氧条件下(1%O2+5%CO2)培养6、12h。
1.3.3 Western blot检测 分别收集各实验组细胞,严格按试剂盒操作说明提取总蛋白,采用BCA法测定总蛋白浓度。取30μg总蛋白,加入适量的上样缓冲液混匀,沸水浴中煮沸5min备用。制备SDS-PAGE凝胶,蛋白上样。蛋白电泳:分离胶恒压80V 20min,浓缩胶恒压100V 90min;转膜:转膜前将滤纸于转移缓冲液中平衡20min,恒流41mA半干转2h,将蛋白转到PVDF膜上。将膜置于5%BSA封闭液中封闭1h;采用TBST洗膜2次,每次10min,TBS洗膜1次,10min;加待测的相应目的蛋白的一抗(抗HIF-1α或抗VEGF抗体),4℃过夜孵育,同上洗膜;加二抗,室温孵育1h,同上洗膜。ECL发光剂发光,Tanon-4200 SF全自动数码凝胶成像仪中,CCD曝光成像。凝胶图像分析软件对结果进行吸光度扫描,以β-actin做内参进行校正,以HIF-1α和VEGF蛋白条带的吸光度值比上各自β-actin的吸光度值为目的蛋白的相对表达量。
1.4 统计学处理 采用SPSS18.0统计软件。计量资料用表示,3组间比较采用单因素方差分析,两两比较采用SNK法;两组间的比较采用t检验。两种蛋白表达水平相关性分析采用Pearson相关分析。
2 结果
2.1 滑膜细胞生长情况 组织块生长至第4天可见组织块周围有成纤维样细胞爬出,培养第10天可见大量细胞围绕组织快生长;培养至第16天可传至第1代,见图1、2。

图1 RA原代滑膜细胞生长第4天

图2 RA原代滑膜细胞生长第10天
2.2 RA和OA患者滑膜细胞中HIF-1α和VEGF蛋白表达情况 RA和OA患者滑膜细胞的HIF-1α和VEGF蛋白的Western blot结果见图3、4。与常氧组相比,RA和OA缺氧6h组及缺氧12h组的滑膜细胞HIF-1α和VEGF蛋白表达均明显增高,差异均有统计学意义(均P<0.05);而常氧条件下两者的滑膜细胞HIF-1α和VEGF蛋白几乎不表达。与缺氧6h组相比,缺氧12h组RA及OA滑膜细胞的HIF-1α和VEGF蛋白表达也均显著增高,差异均有统计学意义(均P<0.05)。此外,常氧组RA和OA两者的HIF-1α和VEGF蛋白表达的差异均无统计学意义(均P>0.05);而缺氧6h组和缺氧12h组中RA滑膜细胞的HIF-1α和VEGF蛋白表达要高于同组的OA滑膜细胞的表达,差异均有统计学意义(均P<0.05),详见表1。
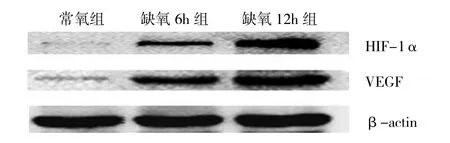
图3 RA患者电泳凝胶图
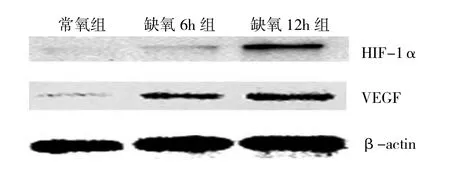
图4 OA患者电泳凝胶图
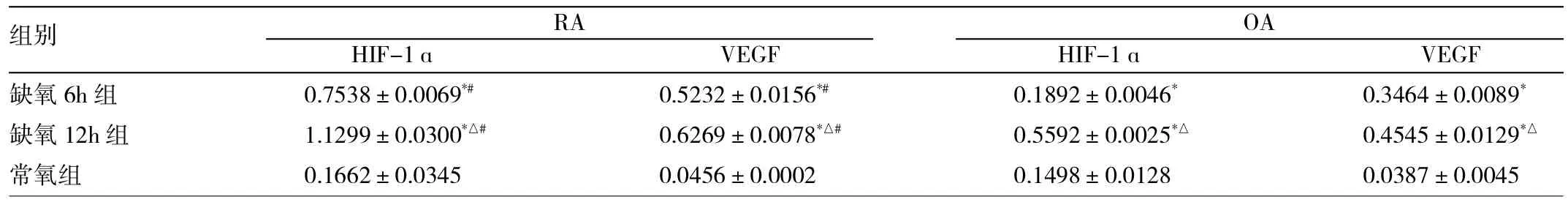
表1 RA和OA患者滑膜细胞常氧和缺氧条件下的HIF-1和VEGF表达情况
2.3 RA和OA滑膜细胞中HIF-1α和VEGF蛋白表达的相关性 分别将RA和OA患者3组滑膜细胞的HIF-1α和VEGF蛋白Western Blot结果进行相关分析,发现RA患者3组滑膜细胞的HIF-1α和VEGF蛋白表达呈正相关(r=0.971,P<0.05);OA患者滑膜细胞的VEGF表达与HIF-1α的表达也呈正相关(r=0.759,P<0.05)。
3 讨论
关节滑膜炎是RA关节炎的基本病理改变,关节滑膜的增厚、大量炎症细胞的浸润及炎症因子的释放造成了关节微环境的缺氧,从而导致了新生血管及血管翳形成。血管翳具有类似肿瘤组织侵蚀的特性,最终将导致关节软骨和骨的破坏。血管翳的形成在RA的发生和发展中起着关键作用,而体内细胞缺氧反应的核心调节因子是HIF-1α。Brouwer等[8]应用重复染色方法对RA及OA的患者滑膜组织进行对照研究,发现RA患者滑膜组织衬里下层高表达HIF-1α,相反地OA滑膜组织细胞HIF-1α表达较低;同时还发现RA滑膜组织HIF-1α阳性细胞数与其血管数目、炎症细胞浸润数呈正相关。有研究也表明,早期活动组RA患者的血清HIF-1α要显著高于OA患者组及健康对照组,并且高于中晚期活动组及稳定组RA患者[9]。同时有学者还发现RA患者血清中VEGF表达显著增高且与患者受累关节滑膜呈正相关[10]。OA是以关节软骨的变性、破坏以及骨质增生为特征的慢性关节病。类似的大量研究也发现OA患者受累关节中氧浓度显著降低[11]。同时有学者对OA患者、急性创伤性关节炎及正常人滑膜组织共60例,进行HIF-1α、VEGF免疫组化染色,发现OA患者组的HIF-1α及VEGF表达要显著高于其他两组,且两者的表达呈正相关[12]。
本研究通过对RA和OA患者滑膜细胞进行体外细胞原代培养,采用Western blot检测其不同条件下HIF-1α及VEGF蛋白表达情况,发现RA和OA患者缺氧6h组及缺氧12h组滑膜细胞的HIF-1α及VEGF蛋白表达显著高于常氧组,而常氧组的HIF-1α及VEGF几乎不表达;与缺氧6h组相比,两者滑膜细胞的HIF-1α及VEGF蛋白也随之增加。同时对HIF-1α及VEGF的表达进行相关分析发现,RA和OA患者3组滑膜细胞的HIF-1α及VEGF蛋白表达呈正相关,以上结果均表明关节微环境的缺氧可以诱导滑膜细胞HIF-1α的高表达,进而促进VEGF的表达而产生作用。笔者推测,缺氧的持续存在促使了HIF-1α和VEGF蛋白的表达进一步升高,从而可能加剧了滑膜的炎症。国内有学者对多例RA和OA患者受累膝关节进行关节镜检查及滑膜组织染色分析,镜下发现RA患者滑膜组织增生及血管密度较OA患者明显;染色发现RA滑膜组织表达的VEGF要显著高于OA患者,同时分析发现滑膜组织增生程度与VEGF水平呈正相关[13]。而本研究从细胞水平对RA和OA患者3组滑膜细胞的HIF-1α及VEGF表达进行比较,发现RA缺氧6h组和缺氧12h组的滑膜细胞中HIF-1α及VEGF表达均高于同组OA滑膜细胞的表达,差异均有统计学意义(均P<0.05);而两者常氧组的表达则无统计学差异(P>0.05)。通过文献复习发现CaMKII(Ca2+/钙调蛋白依赖性蛋白激酶家族之一)表达于RA的成纤维样滑膜细胞,而CaMKII可以调节HIF-1α等因子的转录激活;同时发现CaMKII的抑制剂可以抑制RA滑膜细胞HIF-1α及VEG的表达,这可能是通过抑制pI3K/Akt信号来实现的[14]。pI3K/ Akt和MAPK这两条信号途径是介导缺氧条件下RA滑膜细胞HIF-1α转入激活的主要磷酸化途径[15]。类似的研究发现青蒿琥酯可以通过抑制pI3K/Akt信号途径进而降低RA成纤维样滑膜细胞HIF-1α及VEG的表达[16]。同时有学者使用pI3K/Akt信号途径抑制剂下调CIA大鼠模型的HIF-1α表达水平,发现其关节炎的临床表现、影像学改变、滑膜的增生程度及炎症细胞的浸润都得到显著改善[17]。因此,在缺氧条件RA成纤维样滑膜细胞表达相关受体可以通过多种信号途径从而能更有效的诱导HIF-1α的转录激活[18],从而增加缺氧条件下RA滑膜细胞HIF-1α及VEGF的表达。这可能解释RA滑膜细胞在缺氧条件下HIF-1α及VEGF表达显著高于OA滑膜细胞。
综上所述,体外缺氧条件培养的RA患者成纤维样滑膜细胞HIF-1α及VEGF的表达水平要高于OA患者,且两者的表达呈正相关。因此,笔者推测缺氧诱导的HIF-1α高表达及随后产生的VEGF在RA的发病过程中起着十分重要的作用;而缺氧—HIF-1α—VEGF这一信号通路可能与RA的发生、发展有着十分密切的关系,通过改善缺氧、阻断这一信号通路、拮抗HIF-1α及VEGF表达可能成为RA治疗的新思路。
[1]Sivakumar B,Akhavani M A,Winlove C P,et al.Synovial hypoxia as a cause of tendon rupture in rheumatoid arthritis[J].J Hand Surg Am,2008,33(1):49-58.
[2]Konisti S,Kiriakidis S,Paleolog E M.Hypoxia-a key regulator of angiogenesis and inflammation in rheumatoid arthritis[J].Nat Rev Rheumatol,2012,8(3):153-162.
[3]Del Rey M J,Izquierdo E,Usategui A,et al.The transcriptional response of normal and rheumatoid arthritis synovial fibroblasts to hypoxia[J].Arthritis Rheum,2010,62(12):3584-3594.
[4]Sellam J,Berenbaum F.The role of synovitis in pathophysiology and clinical symptoms of osteoarthritis[J].Nat Rev Rheumatol, 2010,6(11):625-635.
[5]Walsh D A,McWilliams D F,Turley M J,et al.Angiogenesis and nerve growth factor at the osteochondral junction in rheumatoid arthritis and osteoarthritis[J].Rheumatology,2010,49:1852-1861.
[6]Aletaha D,Neogi T,Silman A J,et al.2010 rheumatoid arthritis classification criteria:an American College of Rheumatology/European League Against Rheumatism collaborative initiative[J]. Ann Rheum Dis,2010,69(9):2568-2581.
[7]Hochberg M C,Altman R D,Brandt K D,et al.Guidelines for the medical management of osteoarthritis.PartII.Osteoarthritis of the knee.American College of Rheumatology[J].ArthritisRheum,1995, 38(11):1541-1546.
[8]Brouwer E,Gouw A S,Posthumus M D,et al.Hypoxia inducible factor-1-alpha(HIF-1alpha)is related to both angiogenesis and inflammation in rheumatoid arthritis[J].Clin Exp Rheumatol,2009, 27(6):945-951.
[9]黄娴倩,陈勇,龚丽敏,等.类风湿关节炎患者血清缺氧诱导因子-1α的检测及与关节滑膜病变的相关性[J].浙江医学,2011,33(10):1420-1422.
[10]黄娴倩,陈勇,谢斌华,等.类风湿关节炎患者血清血管内皮生长因子、血管生成素-1与血管生成素-2的检测及与关节滑膜病变相关性研究[J].中华风湿病学杂志,2012,10(16):679-683.
[11]Marrelli A,Cipriani P,Liakouli V,et al.Angiogenesis in rheumatoid arthritis:a disease specific process or a common response to chronic inflammation[J]?Autoimmun Rev,2011,10:595-598.
[12]段鑫,李奇,林荔军,等.骨关节炎滑膜组织中缺氧诱导因子-1α、血管内皮生长因子的表达[J].南方医科大学学报,2011,01:117-120.
[13]赵绵松,夏蓉晖,王玉华,等.骨关节炎与类风湿关节炎患者膝关节滑膜中血管内皮生长因子及血管形态的特征[J].北京大学学报(医学版),2012,06:927-931.
[14]Westra J,Brouwer E,Bouwman E,et al.Role for CaMKII inhibition in rheumatoid arthritis:effects on HIF-1-induced VEGF production by rheumatoid synovial fibroblasts[J].Ann N Y Acad Sci,2009,1173:706-711.
[15]Gaber T,Dziurla R,Tripmacher R,et al.Hypoxia inducible factor (HIF)in rheumatology:low O2!See what HIF can do[J]!Ann Rheum Dis,2005,64(7):971-980.
[16]He Y,Fan J,Lin H,et al.The anti-malaria agent artesunate inhibits expression of vascular endothelial growth factor and hypoxia-inducible factor-1α in human rheumatoid arthritis fibroblast-like synoviocyte[J].Rheumatol Int,2011,31(1):53-60.
[17]Li G,Y Zhang,Y Qian,et al.Interleukin-17A promotes rheumatoid arthritis synoviocytes migration and invasion under hypoxia by increasing MMP2 and MMP9 expression through NF-kappaB/HIF-1alpha pathway[J].Mol Immunol,2013,53(3): 227-236.
[18]Chakravarty S D,Poulikakos P I,Ivashkiv L B,et al.Kinase inhibitors:A new tool for the treatment of rheumatoid arthritis[J]. Clin Immunol,2013,148(1):66-78.
Expression of HIF-1α and VEGF on fibroblast-like synoviocytes cells in patients with rheumatoid arthritis
Objective To investigate the expression of hypoxia-inducible factor-1α (HIF-1α)and vascular endothelial growth factor(VEGF)on fibroblast-like synoviocytes cells in rheumatoid arthritis and its correlation with normoxia and hypoxia. Methods Primarily cultured fibroblast-like synoviocytes cells from patients with rheumatoid arthritis(RA)and osteoarthritis(OA) were exposed to normoxia for 6h or hypoxia for 6h and 12h.The expression of HIF-1α and VEGF were detected by Western blot. Results The expressions of HIF-1α and VEGF in fibroblast-like synoviocytes cells from RA or OA patients exposed to hypoxia for 6h and 12h were higher than those exposed to normoxia(P<0.05).Compared to those exposed to hypoxia for 6h,the expression of HIF-1α and VEGF in cells exposed to hypoxia for 12h was higher(P<0.05).The expression of HIF-1α was positively correlated with VEGF in three groups(P<0.05).The expressions of HIF-1α and VEGF in fibroblast-like synoviocytes cells from RA patients exposed to hypoxia for 6h and 12h were higher than those from OA patients correspondingly(P<0.05),however, there were no significant difference in normoxic group between RA and OA patients(P>0.05).Conclusion In hypoxia conditions the expressions of HIF-1α and VEGF on fibroblast-like synoviocytes cells from RA patients are significantly higher than those from OA patients,indicating that Hypoxia—HIF-1α—VEGF signaling pathway may be closely related to the occurrence and development of RA.
Rheumatoid arthritis Osteoarthritis Synoviocytes Hypoxia-inducible factor-1α Vascular endothelial growth factor

2013-07-16)
(本文编辑:严玮雯)
(本文由浙江省医学会风湿病学分会推荐)
宁波市社会发展科研项目基金资助(2012C50010);宁波市自然基金项目资助(2013A610259)
315010 宁波市第二医院风湿免疫科(彭勇、陈勇、邬秀娣、张振、黄娴倩、干敏芝);宁波市第六医院风湿免疫科(罗晶)
陈勇,E-mail:nbdyyycy@163.com.
