苦丁茶中酚酸类化合物的HPCE分离测定
2013-04-15李娟檀华蓉杨利新王荣富
李娟,檀华蓉,杨利新,王荣富*
(1.安徽农业大学生物技术中心,安徽合肥 230036;2.安徽农业大学生命科学学院,安徽合肥 230036)
苦丁茶中酚酸类化合物的HPCE分离测定
李娟1,檀华蓉1,杨利新2,王荣富1*
(1.安徽农业大学生物技术中心,安徽合肥 230036;2.安徽农业大学生命科学学院,安徽合肥 230036)
通过建立了高效毛细管电泳法同时分离测定苦丁茶中山奈酸、芦丁、没食子酸、原儿茶酸、咖啡酸、没食子酸、原儿茶酸等7种酚酸类物质含量的方法。对缓冲液离子浓度和pH、分离电压和毛细管温度等电泳分离条件进行了优化,结果发现在柱温25℃、电压20kV、20mmol/L pH7.5磷酸二氢钾-硼砂缓冲液的电泳条件下,可在13min内实现了7种酚酸类物质的分离检测。本方法具有较高的灵敏度,呈现较好的线性关系,r为0.9982~0.9996,迁移时间重现性为0.1557%~0.1664%,峰面积重现性为1.080%~3.466%,回收率为80.14%~93.24%。本研究采用建立好的方法测定了不同产区苦丁茶中7种酚酸类化合物的含量。
毛细管电泳,苦丁茶,酚酸类物质
中国茶叶加工 2013,(1):43~47
苦丁茶(Ilex kudingchaC.J.Tseng)属冬青科冬青属植物,又称瓜卢、皋卢等,是我国南方和东南亚地区人民常饮用的一类代用茶,也是传统的药用植物[1]。酚酸类化合物是高等植物中普遍存在的次级代谢产物,具有营养和抗氧化等药理活性和药用价值,如绿原酸具有利胆、抗菌、降压、增高白血球及兴奋中枢神经系统等多种药理作用;没食子酸则作为重要的有机精细化学品,广泛用于有机合成、医药止血收敛剂、食品抗氧化剂、防腐剂、消毒剂、葡萄生长剂等;咖啡酸和阿魏酸则作为新的非肽类ET拈抗剂,可治疗高血压、冠心病、心律失常等内皮素相关性疾病[2]。近年来酚酸类化合物已成为医药和食品研究领域的热点之一[3-7]。用于酚酸类分析的方法有纸色谱(PC)、薄层色谱(TLC)、气相色谱(GC)、高效液相色谱(HPLC)[8-9]等,而高效毛细管电泳(HPCE)兼高效液相色谱的高效率及高压电泳的高速、高分辨率等优点,同时又因其样品处理简单、用量少、自动化程度高等特点,已被广泛用于分子生物学、医学、药学、材料学以及与化学有关的化工、环保、食品、饮料等各个领域[10-13]。本文利用高效毛细管电泳测定了苦丁茶中小分子酚酸类物质的含量,以期为苦丁茶资源的开发利用提供理论依据。
1 材料与方法
1.1 仪器和试剂
Beckman P/ACETM MDQ高效毛细管电泳仪带二极管阵列(PDA)检测器(购自美国贝克曼公司);未涂层熔融石英毛细管内径75μm×65cm(购自河北永年与锐沣色谱器件有限公);ASE3000型快速溶剂萃取仪器(购自美国戴安公司),PHS23精密pH计(购自上海雷磁仪器厂),7种酚酸物质的标样(购自上海源聚生物科技有限公司),四硼酸钠,磷酸二氢钾,乙醇等试剂均为分析纯,实验用水均为超纯水。
1.2 溶液的制备
标准溶液:准确称取标准品山奈酸、芦丁、没食子酸、原儿茶酸、咖啡酸、没食子酸、原儿茶酸各1.0000mg,用甲醇溶解分别定容至1mL,配制成1.0g/L的标准液,再稀释为100μg/mL、75μg/mL、50μg/mL、25μg/mL、12.5μg/mL、6.25μg/mL的梯度标准溶液,采用“1.3”中电泳条件检测,用外标法绘制标准曲线。
样品溶液:准确称取加工好的苦丁茶样品5g,用快速溶剂萃取仪进行样品的提取。萃取条件:温度,40℃;溶剂,70%乙醇;冲洗体积,20%V;2次循环;静态萃取时间为5min。提取液,过0.22μm微孔滤膜纯化样品。
1.3 实验方法
毛细管柱在每次使用前依次用0.1mol/L氢氧化钠溶液、超纯水和电泳缓冲液各冲洗10min,更换缓冲液或进样3次后也按上述步骤清洗毛细管,保证其重现性。采用0.5psi压力,进样6s,紫外检测波长为214nm,20mmol/L pH7.5磷酸二氢钾-硼砂缓冲液,在分离电压为20kV,运行温度为25℃的条件下同时进行山奈酸、芦丁、没食子酸、原儿茶酸、咖啡酸、没食子酸、原儿茶酸等7种酚酸类物质的分离测定。
2 结果与讨论
2.1 检测波长的确定
如图1所示,经紫外检测器在190~400nm波长范围内扫描,绿原酸和咖啡酸的特征吸收峰为300~360nm,芦丁、槲皮素、没食子酸和原儿茶酸的特征吸收峰为200~220nm,7种酚酸类物质在214nm处都有较强吸收,所以选定214nm为最佳检测波长。

图1 混合标样的紫外特征吸收峰图(注:1-山奈酸,2-芦丁,3-槲皮素,4-绿原酸,5-咖啡酸,6-没食子酸,7-原儿茶酸)Fig.1UV characteristic absorption peak of mixed standard samples(Note:1-kaempferol,2-rutin,3-quercetin,4-chlorogenic acid, 5-caffeine acid,6-gallic acid,7-protocatechuic acid)
2.2 缓冲体系的选择
2.2.1 缓冲液离子浓度的选择
本实验选择了20、30、40mmol/L三个离子浓度的磷酸二氢钾-硼砂缓冲体系。结果表明(图2-A),迁移时间随着缓冲盐的离子浓度的增加而增长,分离度随着缓冲盐的离子浓度的增加而变小,在20mmol/L的缓冲液浓度时有一个最佳的分离。2.2.2缓冲液pH的选择
本实验选择了缓冲液的pH值为7.0、7.5、8.0、8.5时对样品分离度的影响。结果表明(图2-B),迁移时间随着pH值的增加而增长,但分离度变差。pH7.0时,后3峰无法分离;pH7.5时,在12min之内7种酚类物质有一个很好的分离。
2.2.3 分离电压和温度的选择
本实验考察了工作电压分别为18、20、22、 24kV时对样品提取液的分离效果。结果表明(图2-C),随着电压的增加,样品溶液的分离速度增大,迁移时间缩短,但当电压为22kV时,噪音明显增大,综合考虑,本实验选择20kV的工作电压。本实验同时考察了15、20、25、30℃的柱温对样品提取液分离的影响,结果表明(图2-D),随着温度的升高,迁移时间缩短,但达到一定的柱温后,分离效果明显降低,本实验选择分离最佳时的25℃柱温。
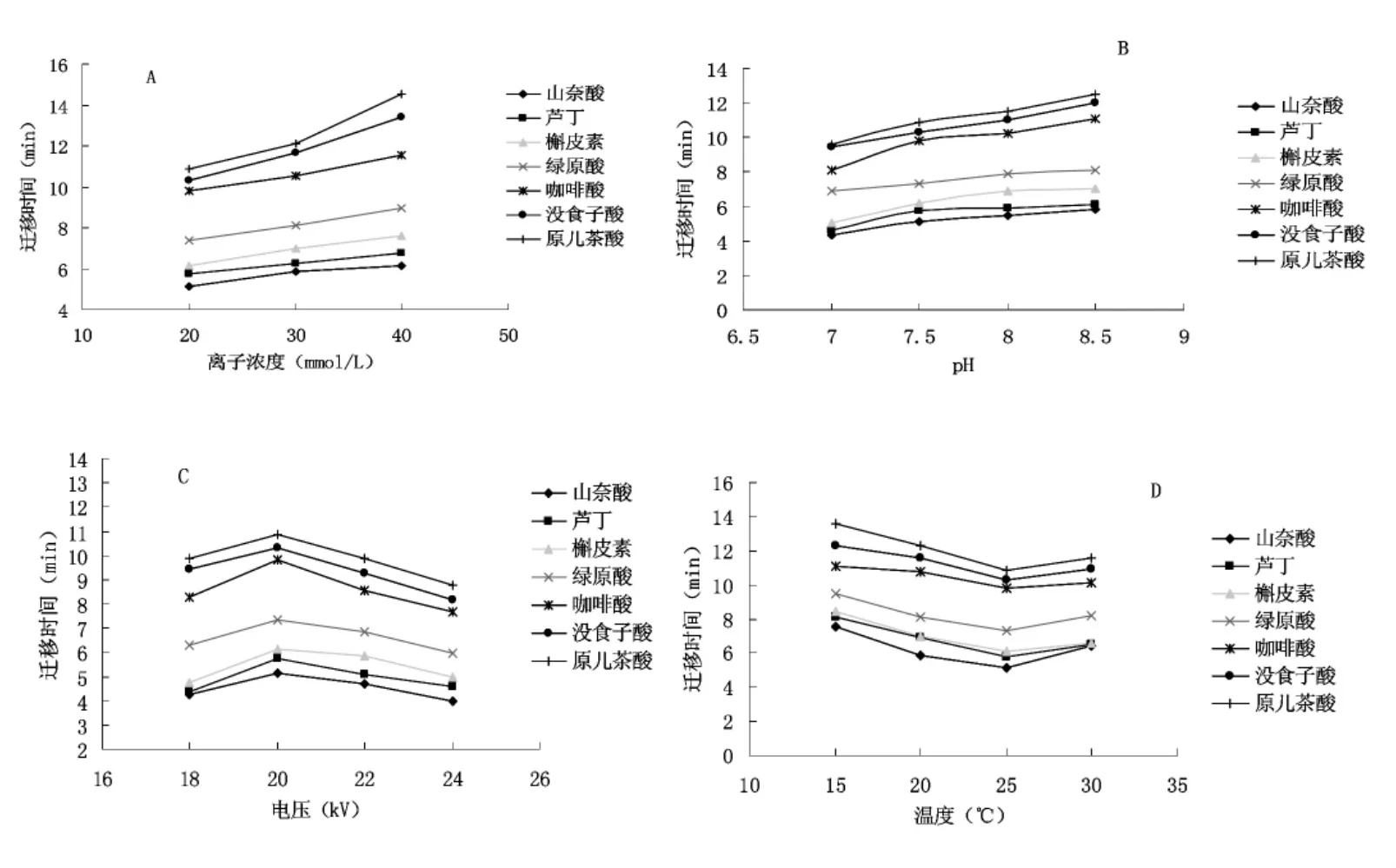
图2 各因素对迁移时间的影响Fig.2Effects of various factors on migration time
2.3 回归方程、相关系数的确定
将混合标准样品用甲醇稀释为100μg/mL、 75μg/mL、50μg/mL、25μg/mL、12.5μg/mL、6.25μg/ mL八个浓度梯度,在最佳的电泳条件下进行HPCE测定,以浓度为横坐标,峰面积为纵坐标,进行回归处理,得到浓度在6.25~100μg/mL之间的标准曲线和回归方程。结果表明,7种酚酸类物质的相关性良好,相关系数为0.9982~0.9996,见表1。

表1 线性范围和回归方程Table1Regression equation and linear range
2.4 回收率实验及精密度
准确度验证采用添加回收率法进行试验。在已知七种酚酸类物质含量的苦丁茶提取液中加入已知量的标样溶液后进行测定,实测添加量与标准添加量之比为回收率。通过实验,测得的仪器的回收率在80.14%~93.24%之间(结果见表2)。

表2 回收率实验(n=3)Table2Experiment of recovery(n=3)
分析方法的重复性是评价其保持不受参数微小偏差影响的能力,可作为正常使用的一个可靠性指标,取相同样品6份,按1.2样品提取、纯化方法制备供试液,在最优条件下进行6次平行实验,考察各组分的校正峰面积和迁移时间的重复性。结果表明,7种酚酸类物质的峰面积RSD≤2.522%,迁移时间的RSD≤1.561%,见表3。

表3 精密度实验Table3Experiment of accuracy
2.5 样品的分析结果
按1.2样品提取、纯化方法处理样品,在最佳的电泳分离条件下,采用外标法计算不同产地苦丁茶7种酚酸类物质的含量,图3和表4结果显示,样品中的7种酚酸类物质可以得到有效分离;不同产地的苦丁茶中7种酚酸类物质的含量明显不同,没食子酸在几种苦丁成品茶种都未检测出。
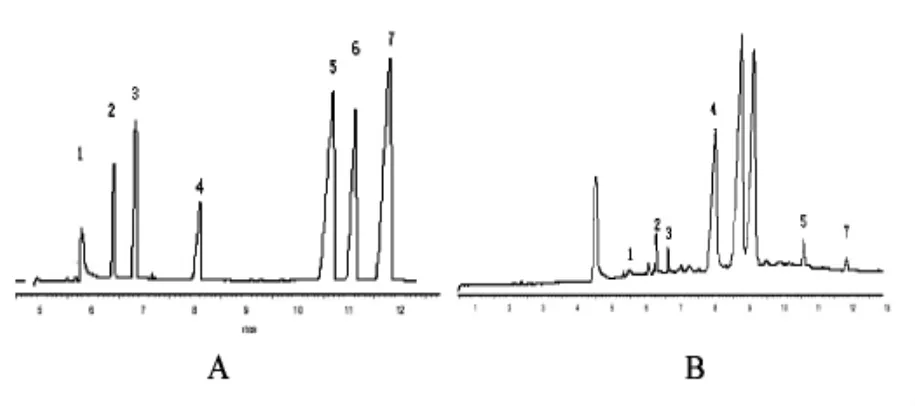
图3 标样品(A)和样品(B)的HPCE色谱图(注:1-山奈酸,2-芦丁,3-槲皮素,4-绿原酸,5-咖啡酸,6-没食子酸,7-原儿茶酸)Fig.3 Electropherograms of standards(A)and sample(B)(Note:1-kaempferol,2-rutin,3-quercetin,4-chlorogenic acid, 5-caffeine acid,6-galli acid,7-protocatechuic acid)
3 结论
本文通过对电泳条件进行的比较研究,确立了分离测定苦丁茶山奈酸、芦丁、槲皮素、绿原酸、咖啡酸、没食子酸和原儿茶酸等7种酚酸类物质的最佳电泳条件:缓冲液采用20mmol/L,pH7.5磷酸二氢钾-硼砂缓冲液,分离电压20kV,运行温度25℃,紫外检测波长214nm。本方法工作曲线线性关系良好、结果的准确度和精密度高,样品用量少,分析时间短,与其他分析方法相比较,高效毛细管电泳法操作更简便、快速,可在12min内同时分离7种物质,大大减少了分析成本,为同时分离检定多种酚酸类物质提供了一个良好的方法。

表4 不同产地苦丁茶中7种酚酸类物质含量比较(单位:μg/g)Table4Comparation of seven phenolic acids in Kudingcha from different areas(unit:μg/g)
酚酸类物质是高等植物中普遍存在的次级代谢产物,具有广泛的生物活性。关于苦丁茶酚酸类物质的组成,梁月荣等[14]通过分析浙江省大叶冬青苦丁茶中的化学成分发现苦丁茶中含有儿茶素和芦丁等酚酸类物质,而Negishi等[15]认为苦丁茶冬青苦丁茶的主要酚类化合物为绿原酸及其衍生物。本实验对不同产区的苦丁茶酚酸类化合物的测定结果中都不含有没食子酸,而绿原酸的含量最高;来自源于黄山和四川的苦丁茶中没有检测出咖啡酸和原儿茶酸。
[1]刘韶,秦勇,杜方麓.苦丁茶化学成分研究[J].中国中药杂志, 2003,28(9):834-836.
[2]Barberan T,Espin J C.Phenolic compounds and related enzymes as determinant so quality in fruit sand vegetables[J]. SciFoodAgric,2001,81:853-876.
[3]王祥军,齐军仓,贾力群,等.反相高效液相色谱法快速测定大麦籽粒中13种酚酸类化合物[J].分析实验室,2011,30(11)5-10.
[4]苏贻娟,冯远娇,罗赐君,等.同效液相色谱法测定玉米叶片中的酚酸类化合物[J].玉米科学,2009,17(5):166-168.
[5]江和源,蒋迎.茶叶中5种酚酸类化合物的HPLC测定方法[J].食品工业科技,2004,25(12):122-124.
[6]龙文静,张盛,袁玲,等.反相高效液相色谱法同时测定咖啡豆中的6种酚酸类化合色谱,2011,29(5):439-442.
[7]杨柳,吴金雄,许舜军,等.苍耳子中酚酸类化合物的鉴别及绿原酸的含量测定[J].中国实验方剂学杂志,17(19):85-88.
[8]颜栋美,李仁菊.高效液相色谱法测定金花茶中5种酚类物质的研究[J].河南工业大学学报(自然科学版),2010,31(1):59-62.
[9]朱玉,张书胜,张西林,等.薄层色谱法分析葵花仁粕中的绿原酸[J].色谱,2001,19(1):82-84.
[10]汪泰初,张和禹,李瑞雪.高效毛细管电泳法测定虫草制品中核苷类化合物[J].中国蚕业,2010,(03):14-16.
[11]彭进进,罗泽娇,李龙媛.高效毛细管电泳-二极管阵列检测法测定土壤中的苯酚[J].分析科学学报,2012,(01):103-105.
[12]张汆,李敏,贾小丽.芡种壳乙酸乙酯提取物的毛细管电泳法分离[J].食品工业科技,2012,4(05):188-190.
[13]韩海峰,王庆,刘霞.聚合离子液体为添加剂的毛细管电泳法用于快速高效分离饮料中7种有机酸[J].色谱,2012,(05).113-117.
[14]LIANG Yuerong,MA Weiyang,LU Jianliang,et al.Comparison of chemical compositions ofIlex latifoliaThumb andCamellia sinensisL.[J].Food Chemistry,2001,75:339-343.
[15]Negishi O,Negishi Y,Yamaguchi F,et al.Deodorization with Ku-ding-cha containing a large amount of caffeoyl quinine acid derivatives[J].Journal of Agricultural and Food Chemistry,2004,52:5513-5518.
Separation and Determination of Phenolic Acids inIlex kudingcha C.J.Tsengby High Performance Capillary Electrophoresis
LI Juan1,TAN Hua-rong1,YANG Li-xin2,WANG Rong-fu1*
(1.Biotechnology center,Anhui Agricultural University,Hefei 230036,China; 2.College of Life Science,Anhui Agricultural University,Hefei 230036,China)
A high performance capillary electrophoresis(HPCE)method was established for the determination of phenolic acids in Kudingcha,including kaempferol,rutin,quercetin,chlorogenic acid,caffeine acid,gallic acid and protocatechuic acid.The samples were extracted with methanol by fast solvent extraction equipment(ASE3000).The electrophoretic separation conditions,such as ion concentration and pH of buffer, running voltage and capillary temperature were optimized.Results showed that the optimum conditions were the running buffer consisted of 20mmol/L KH2PO4-sodium borate,pH7.5,separation voltage 20kV,running temperature 25℃,and the UV-detection wave length 214 nm.Under these conditions,the seven phenolic acids could be well separated within 13 minutes,and their corresponding coefficient reached from 0.9982 to 0.9996.The RSD values of migration time and peak area were 0.1557%~0.1664%and 1.080%~3.466% respectively.The average recovery percentage was 80.14%~93.24%.Results indicated that this method wasrapid,accurate and simple for determining phenolic acids in Kudingcha coming from different areas.
High performance capillary electrophoresis,Kudingcha,Phenolic acids
2012-11-29
李娟(1977-),女,安徽安庆人,助理研究员,主要从事分析测试工作。
*通讯作者:rfwang@ahau.edu.cn
