盐酸奥洛他定治疗变应性鼻炎疗效评估:多中心、随机、双盲、双模拟临床试验
2013-04-09顾建青谭国林王珮华李添应王德辉
李 宏,顾建青,谭国林,程 雷,王珮华,张 罗,李添应,王德辉,尹 佳#
(中国医学科学院 北京协和医学院 北京协和医院变态反应科,北京 100730)
变应性鼻炎是全球性的鼻部变态反应性疾病,人群患病率为10%~20%[1]。变应性鼻炎是IgE介导的I型变态反应,组胺作为其中最重要的炎性介质,在诱发打喷嚏、流涕、鼻痒、鼻塞等鼻部症状时起关键作用。因此,抗组胺药被推荐为轻度变应性鼻炎的首选治疗药物。基础研究显示,盐酸奥洛他定做为一种新型第二代H1受体拮抗剂不仅具有抗组胺作用,还能抑制调节激活正常T-细胞表达分泌因子(regulated upon activation normal T-expressed and secreted,RANTES)、单核细胞趋化蛋白-1(monocyte chemoattractant protein-1,MCP-1)等炎性介质的产生与释放,抑制嗜酸粒细胞和嗜碱粒细胞浸润[2-3]。本试验旨在评价抗组胺药盐酸奥洛他定治疗变应性鼻炎的有效性和安全性。
对象和方法
试验设计
采用多中心、随机、双盲、双模拟、平行对照设计。
研究对象
病例选择:2007年8月至2008年1月7个研究中心(中国医学科学院北京协和医学院北京协和医院变态反应科、中南大学湘雅三医院耳鼻喉科、南京医科大学第一附属医院耳鼻喉科、上海交通大学医学院附属第九人民医院耳鼻喉科、首都医科大学附属北京同仁医院耳鼻喉科、中山大学附属第一医院耳鼻喉科、复旦大学附属眼耳鼻喉科医院耳鼻喉科)就诊的变应性鼻炎患者。凡符合入选标准、无任何1项排除标准,且自愿参加者均纳入试验。
入选标准:(1)年龄18~65岁,男女不限。(2)符合变应性鼻炎诊断标准。病史:具有打喷嚏、流涕、鼻塞、鼻痒4项症状中的3项,季节性变应性鼻炎常伴有眼痒、结膜充血、流泪,病程≥1年;鼻腔检查:鼻黏膜苍白、水肿、水样或黏液样鼻涕,可有程度不等的通气不畅,眼结膜充血和水肿等;变应原皮肤试验呈阳性反应;并可通过荧光酶联免疫反应UniCAP方法进行特异性sIgE(≥2级)检测辅以诊断。(3)症状积分中至少有2个鼻部症状达到2分及以上。(4)愿意接受治疗并签署知情同意书。
排除标准:(1)孕妇及未采取有效避孕措施的育龄妇女(视必要进行妊娠检查),以及哺乳期妇女。(2)从事危险工作的人员及驾驶员。(3)正在参加其他临床试验或在近3个月内参加过其他临床试验的受试者。(4)非变应性鼻炎患者(指未查出变应原者)。(5)严重鼻中隔偏曲、鼻息肉、鼻窦炎、肥厚性鼻炎者。(6)正处于哮喘发作期的患者。(7)器质性心脏病或心律失常者,心电图参数异常者。(8)肝肾功能异常者。(9)对试验药或对照药变应者。(10)阿司咪唑停药时间小于6周,其他抗组胺药停药时间小于1周。(11)鼻吸入抗组胺药停药时间小于1周。(12)皮质激素滴鼻剂或喷鼻剂停药时间小于1周。(13)系统使用皮质类固醇停药时间小于4周。(14)正在使用大环内酯类抗生素,和(或)正在系统使用咪唑类抗真菌剂。(15)正罹患严重疾病者(如癌症、心肌梗死等)的患者。(16)需要维持服用精神类安定药、镇静药的患者。(17)研究者认为其他不宜入选的患者。
剔除标准:(1)不符合入选标准或符合排除标准。(2)入选后未曾用药者。(3)无任何随访记录者。
试验用药
受试药安慰剂:同受试药外观相同,但是不含盐酸奥洛他定。由协和发酵工业株式会社提供。批号为0198-A,生产日期为2006年11月21日,有效期为2009年11月20日。
对照药安慰剂:同对照药外观相同,但是不含盐酸西替利嗪。由江苏联环药业股份有限公司为此次临床试验专门定制。批号为20061101,生产日期为2006年11月10日,有效期为2009年11月9日。
用药方法
盐酸奥洛他定组:早饭后服用盐酸奥洛他定(5 mg)1片+模拟盐酸西替利嗪安慰剂1片;晚饭后服用盐酸奥洛他定(5 mg)1片+模拟盐酸西替利嗪安慰剂1片。
盐酸西替利嗪组:早饭后服用盐酸奥洛他定安慰剂1片+盐酸西替利嗪(10 mg)1片;晚饭后服用盐酸奥洛他定安慰剂1片+盐酸西替利嗪安慰剂1片。
两组均连续用药14 d。
疗效评估
主要疗效指标:本试验采用症状积分下降指数(symptom score reduce index,SSRI)作为疗效评定的主要终点指标。本药系H1受体拮抗剂,评价该类药物疗效主要根据患者症状的改善程度。由于入组时患者病情轻重不同,所以评定疗效时要参考患者入组时的症状积分,根据用药前与用药后症状积分之差显示患者症状改善程度,以用药前与用药后症状积分之差与治疗前症状积分比值表示症状改善幅度。SSRI越大说明疗效越显著。计算公式为SSRI=(治疗前积分-治疗后积分)治疗前积分。症状积分按4级评分法记录受试者喷嚏、鼻涕、鼻痒、鼻塞情况(表1),上述4项评分相加即为症状积分,试验期间要求患者每日如实记录症状变化情况,根据症状严重程度进行评分。
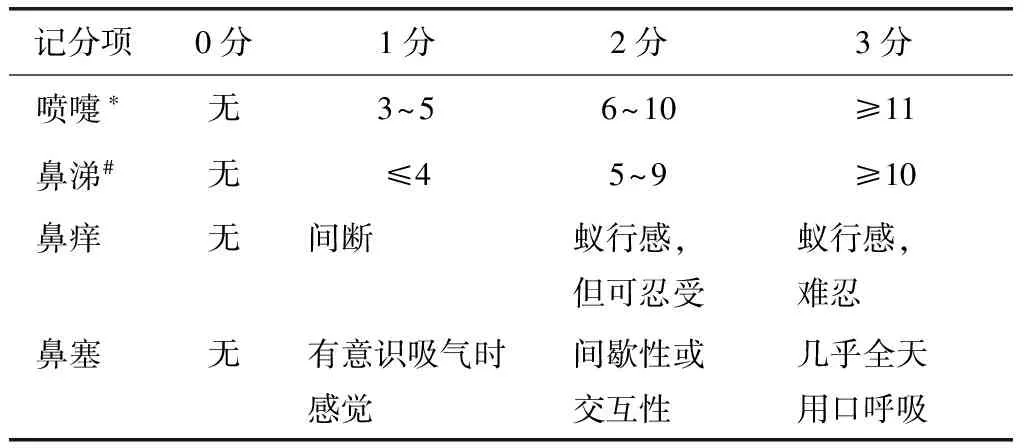
表1 变应性鼻炎症状评分标准Table 1 Symptoms scoring of allergic rhinitis
*1次连续喷嚏个数;#每日擤鼻次数
症状积分下降指数为负数时的数据处理:当中期随访和最终随访后症状积分大于用药前积分时,下降指数可能为负数,此时记分均为0。负值的出现往往与疾病自身有关,并非因药物所致。在花粉季节空气中花粉计数随时间和气象条件变化,如果入组时空气花粉浓度较低,结束时花粉浓度陡然上升,药物应用又不能控制症状时,可出现此种情况,故将负值计为0是合理的。
次要疗效指标:变应性鼻炎是一种严重困扰生活质量的疾病,除了应用症状积分的方法评价疗效外,还应从鼻炎症状对生活质量影响程度的角度综合分析,据此评定出总体疗效。为便于进行总体疗效评价,将病情分为4级,并将4级绘制成4个阶梯(图1)。总体疗效评价标准:显效:治疗后症状消失或基本消失(下降2级或2级以上);良效:症状明显改善(下降1级);微效:症状略有改善;无效:症状无好转甚至加剧。总有效率以显效加良效之和计算。
安全性评估
记录治疗过程中患者出现的与治疗目的无关的各种不良事件,说明其程度、持续时间、是否需要处理及转归等情况。对所有不良事件与治疗药物的相关性均按“肯定”、“很可能”、“可能”、“可疑”及“不可能有关”5项进行分析,并将前3种定为药物不良反应。

图1 病情分级阶梯图Fig 1 Disease grades ladder diagram
测定用药前后患者的血、尿常规、肝肾功能等实验室指标,并进行心电图检查。
统计学处理
用SAS V8.2版统计软件进行分析,所有试验均采用双侧检验,当P≤0.05时认为差异有统计学意义。分别描述用药2周和1周时SSRI的均数、标准差,并用t检验或wilcoxon秩和检验比较两组有无差别,计算两组95%可信区间及两组之差的95%可信区间。检验假设为非劣效性假设,以0.1作为主要评价指标SSRI的非劣效界值。分别描述两组试验前后病情分级评分分布及总体疗效分布,并用Pearson χ2检验或Fisher确切概率检验作两组比较。安全性分析包括不良事件反应例数及其百分比、实验室异常例数及其百分比。用药后的主要和次要疗效指标对全分析数据集(full analysis set,FAS)进行分析,安全性分析对安全集(safety set,SS)进行分析。
结 果
一般资料
7个研究中心共筛选了200例受试者,筛选合格180例。盐酸奥洛他定组91例,盐酸西替利嗪组89例。其中173例受试者数据进入FAS,盐酸奥洛他定组87例、盐酸西替利嗪组86例。7例未进入FAS原因:未服药(两组各1例),违反方案用药(两组各1例),受试者无疗效评价数据(两组各1例),不符合入选标准(盐酸奥洛他定组1例)。178例数据进入SS,其中盐酸奥洛他定组90例、盐酸西替利嗪组88例。两组患者入组年龄、性别、总症状积分等均具有可比性(表2)。
疗效分析
SSRI:FAS集分析结果显示,治疗中,盐酸奥洛他定组及盐酸西替利嗪组分析例数(缺失数)分别为85(2)例、83(3)例。盐酸奥洛他定组症状积分下降指数0.460±0.223,95%可信区间为(0.412~0.508),盐酸西替利嗪组症状积分下降指数0.422±0.281,95%可信区间为(0.360~0.483),两组间比较差异无统计学意义(P=0.329);两组间差及95%可信区间为0.038(-0.039~0.115)。治疗后,盐酸奥洛他定组及盐酸西替利嗪组分析例数(缺失数)分别为87(0)例、86(0)例。盐酸奥洛他定组症状积分下降指数0.597±0.266,95%可信区间为(0.540~0.654),盐酸西替利嗪组症状积分下降指数0.596±0.282,95%可信区间为(0.536~0.657),两组间比较差异无统计学意义(P=0.984);两组间差及95%可信区间为0.001(-0.082~0.083)。
总体疗效评价及总有效率:FAS集分析结果显示,治疗中,两组在总体疗效的显效、良效、微效、无效的分布上差异无统计学意义(P=0.517);盐酸奥洛他定组的总有效率及95%可信区间为70.6%(60.9~80.3),盐酸西替利嗪组的总有效率及95%可信区间为60.2%(49.7~70.8),两组间总有效率比较差异无统计学意义(P=0.158)。两组间总有效率差及95%可信区间为10.3%(-4.0~24.7)(表3)。治疗后,两组在总体疗效的显效、良效、微效、无效的分布上差异无统计学意义(P=0.917)。盐酸奥洛他定组的总有效率及95%可信区间为79.3%(70.8~87.8),盐酸西替利嗪组的总有效率及95%可信区间为81.4%(73.2~89.6),两组间总有效率比较差异无统计学意义(P=0.730),两组间总有效率差及95%可信区间为-2.1%(-13.9~9.8)(表4)。
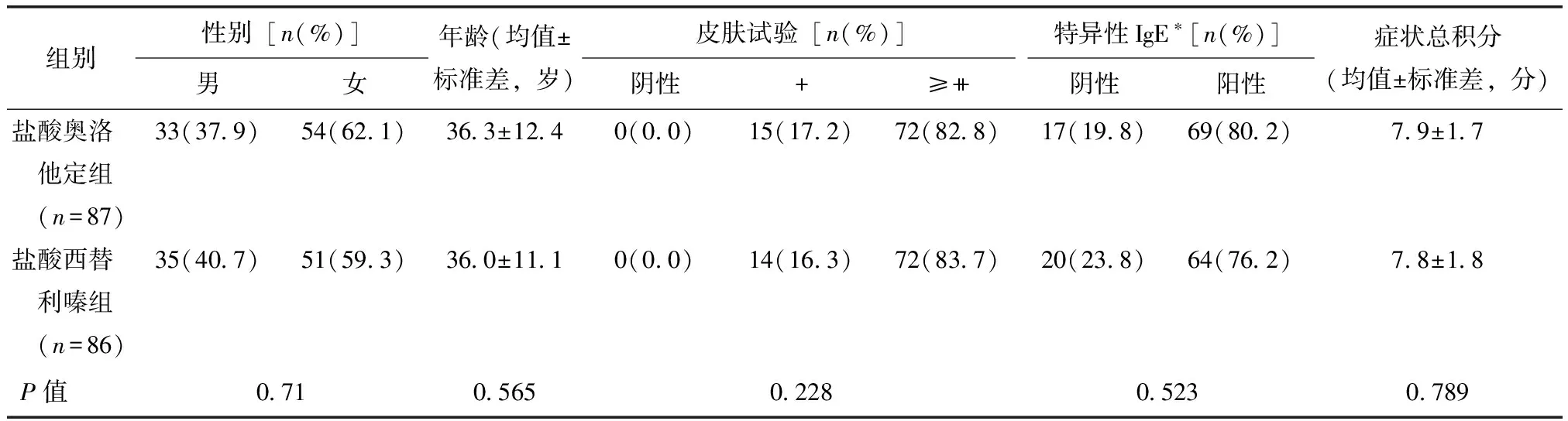
表2 受试者一般资料Table 2 Analysis of clinical basic information
*参考值为0.70 kUAL,检测对象为全数据分析集患者
根据主要和次要疗效指标分析结果,两组各项疗效指标组间比较差异均无统计学意义。根据非劣效性检验结果,证明盐酸奥洛他定临床疗效非劣效于盐酸西替利嗪。
安全性评价
所有患者均未发现严重不良反应。盐酸奥洛他定组发生不良反应28例(31.1%),盐酸西替利嗪组发生不良反应24例(27.3%),两组比较差异无统计学意义(P=0.573)。不良反应主要表现为嗜睡、口干、鼻干、丙氨酸转氨酶或天冬氨酸转氨酶异常、心电图异常和出血。两组均以嗜睡和口干发生最多,其中盐酸奥洛他定组出现18例嗜睡(20.0%)和7例口干(7.8%),盐酸西替利嗪组出现17例嗜睡(19.3%)和6例口干(6.8%)。有关出血倾向的不良反应,盐酸奥洛他定组发生子宫异常出血1例(1.1%)和鼻出血1例(1.1%),盐酸西替利嗪组发生1例痰中带血(1.1%)(表5)。
讨 论

表3 治疗中两组总体疗效评估统计描述(全分析数据集)Table 3 Global efficacy of the two groups during treatments (full analysis set)
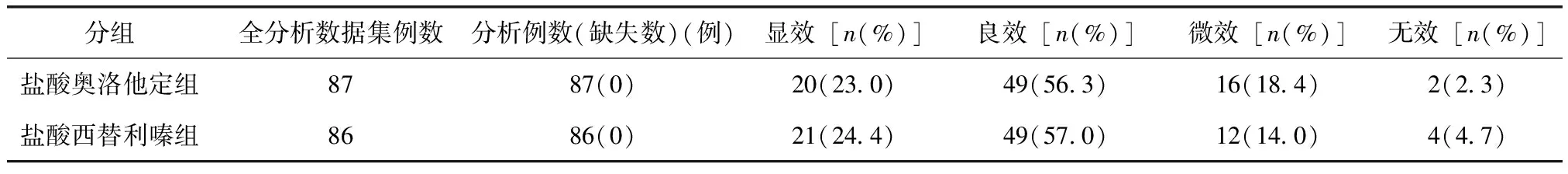
表4 治疗后两组总体疗效评估统计描述(全分析数据集)Table 4 Global efficacy of the two groups after treatments (full analysis set)
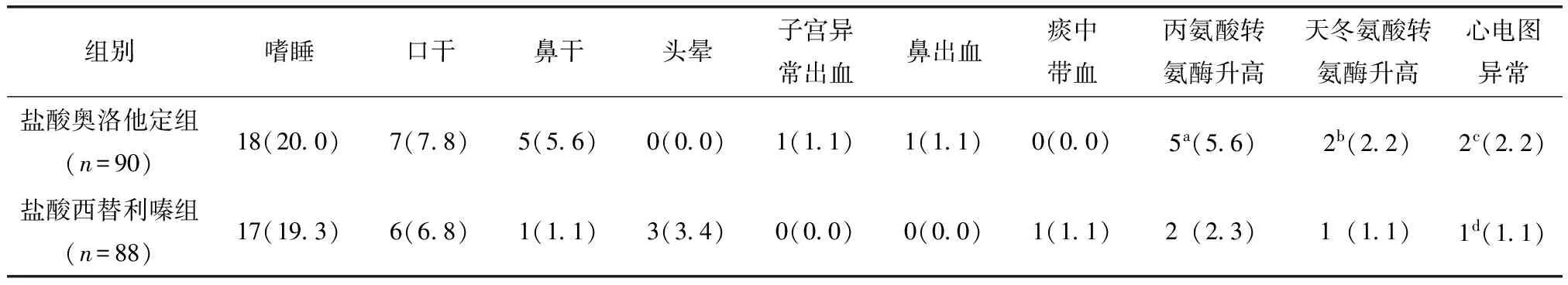
表5 两组主要不良反应发生率Table 5 Incidence of adverse drug reactions between two groups [n(%)]
a丙氨酸转氨酶水平分别为72、68、59、62、53 UL;b天冬氨酸转氨酶水平分别为68、30 UL;cⅠ°房室传导阻滞1例、T波倒置低平1例;dST段抬高、T波高尖及QRS波呈M型
盐酸奥洛他定除了具有抑制组胺H1受体的作用外,还具有抑制白三烯、血栓素、血小板活化因子等介质产生和释放的作用[4-6],对速激肽(tachykinin)释放和嗜酸粒细胞浸润也有抑制作用[7]。在变应性鼻炎豚鼠、大鼠模型试验中,对抗原诱发的血管通透性增加和鼻塞有抑制作用[8-9]。
第一代H1受体拮抗剂常见不良反应有困倦感、口干等。本试验患者也以上述不良反应为主,但程度较轻。以往研究显示,盐酸奥洛他定对组胺H1受体选择性高,通过血脑屏障少[2]。对蕈毒碱M1受体几乎无亲合性[10]。
口服盐酸奥洛他定后,约30%经肝脏代谢,70%通过肾脏以药物原形排泄。对血清蛋白结合率和肝药酶影响较小,药物相互作用小。本临床试验发现2例天冬氨酸转氨酶异常者及5例丙氨酸转氨酶异常,所有肝功能异常者停药后均恢复。说明盐酸奥洛他定治疗后对肝酶影响程度较轻。
H1受体拮抗剂对心肌的毒性作用受到重视[11]。本研究中,盐酸奥洛他定组有2例患者出现心电图异常,盐酸西替利嗪组有1例患者心电图异常,患者均无心血管系统相关临床症状,且停药后心电图均恢复正常。
在本临床研究中,盐酸奥洛他定组发现子宫异常出血1例、鼻出血1例。根据日本上市前及上市后9620例临床调查结果显示,与上述病例相似的不良反应仅发现1例(0.01%),表现为鼻出血。另外,在日本自发呈报的报告中,有数例患者出现月经异常。盐酸奥洛他定与异常出血倾向的相互机制还有待进一步研究。
盐酸奥洛他定能改善变应性鼻炎患者喷嚏、流涕、鼻痒和鼻塞等症状,其疗效与盐酸西替利嗪相似,较为安全,具有一定的临床使用价值。
[1]Brozek JL, Bousquet J, Baena-Cagnani CE, et al. Allergic Rhinitis and its impact on Asthma guidelines: 2010 revision[J]. JACI, 2010,126:466-476.
[2]Yamauchi Y, Fujikura T, Shimosawa T. The effect of H1 antagonists carebastine and olopatadine on histamine induced expression of CC chemokines in cultured human nasal epithelial cells[J]. Allergol Int, 2007, 56:171-177.
[3]Ono SJ, Lane K. Comparison of alcaftadine and olopatadine on conjunctival epithelium and eosinophil recruitment in a murine model of allergic conjuntivititis[J]. Drug Des Devel Ther, 2011, 5:77-84.
[4]佐佐木康夫, 池村俊秀, 石井秀卫,等. 新規抗アレルギー薬KW-4679のplatelet-activating factor (PAF)誘発モルモット気道収縮反応,気道過敏症および気道への細胞浸潤に及ぼす影響[J]. 日药理志, 1995, 106:347-357.
[5]佐佐木康夫, 池田よしみ, 池村俊秀,等. 新規抗アレルギー薬KW-4679のラット腹腔浸出細胞からのヒスタミン遊離およびロイコトリエン遊離に及ぼす影響[J]. 药理与临床, 1995, 5:1837-1849.
[6]Ikemura T, Manabe H, Sasaki Y, et al. KW-4679, an antiallergic drug, inhibits the production of inflammatory lipids in human polymorphonuclear leukocytes and guinea pig eosinophils[J]. Int Arch Allergy Immunol, 1996, 110:57-63.
[7]Ikemura T, Okarmura K, Sasaki Y, et al. KW-4679-induced inhibition of tachykininergic contraction in the guinea-pig bronchi by prejunctional inhibition of peripheral sensory nerves[J]. Br J Pharmacol, 1996, 117:967-973.
[8]石井秀卫, 佐佐木康夫, 池村俊秀,等. 抗アレルギー薬KW-4679の薬理作用(第1報)受身皮膚アナフィラキシーおよび実験的喘息に及ぼす影響[J]. 日药理志, 1995, 106:289-298.
[9]石井秀卫, 佐佐木康夫, 池村俊秀,等. 抗アレルギー薬KW-4679の薬理作用-受身皮膚アナフィラキシー(PCA) および気道収縮反応に及ぼす影響[J]. 基础与临床, 1995, 29:3543-3559.
[10] 野中裕美, 石井明男, 三木一郎,等. 新規抗アレルギー薬, KW-4679の各種受容体およびex vivoヒスタミンH1受容体に対する作用[J]. 药理与临床, 1995, 5:1817-1824.
[11] Soldovieri MV, Miceli F, Taglialatela M. Cardiotoxic effects of antihistamines: from basics to clinics (…and back)[J]. Chem Res Toxicol, 2008, 21:997-1004.
