类风湿关节炎患者血清铁调素与贫血及疾病活动性的关系
2013-04-09邬秀娣干敏芝黄娴倩谢斌华
邬秀娣,张 振,陈 勇,干敏芝,黄娴倩,谢斌华
(浙江省宁波市第二医院风湿免疫科,宁波 315010)
类风湿关节炎(rheumatoid arthritis,RA)是一种常见的全身性慢性自身免疫性疾病,多发于青壮年,我国发生率为0.24%~0.5%,累及数百万人。贫血为RA中最常见的关节外症状之一,文献报道发生率在30%~60%不等。合并严重贫血是加重患者全身症状及关节功能障碍、影响预后的重要因素[1]。铁调素(hepcidin,Hepc)是由肝细胞分泌的小分子多肽,被认为是调节体内铁代谢平衡的关键因子。Hepc通过调节肠道铁吸收及调控巨噬细胞内铁的释放,调节铁代谢。研究表明,Hepc不仅是导致慢性炎性贫血的潜在因素,同时还具有铁调节功能外的其他功能,其可能通过免疫调节作用直接参与了慢性炎性疾病的发病机制[2]。为进一步了解Hepc在RA中的作用及其与贫血的关系开展本研究,以期为临床提供参考。
对象和方法
病例收集及分组
选择2011年10月至2012年6月在浙江省宁波市第二医院风湿免疫科住院的且有完整资料的患者作为RA组,诊断均符合 2010年美国风湿病学会(American College Of Rheumatology,ACR)欧洲风湿病防治联合会(European League Against Rheumatism,EULAR)RA的分类标准[3]。RA组中血清Hepc水平>5.86 ngml者纳入Hepc升高组,Hepc水平≤5.86 ngml者纳入Hepc正常组。其他系统性结缔组织病(connective tissue disease,CTD)对照组(其他CTD组)20例,诊断均符合相应的分类诊断标准。健康对照组20例,均选自同期在我院健康体检中心常规体检的健康志愿者。
排除标准:合并除自身免疫性疾病及其继发疾病外的其他系统原发慢性疾病者,包括高血压、糖尿病;急性感染者;乙型、丙型肝炎病毒感染;人类免疫缺陷病毒、结核等慢性感染者;恶性肿瘤患者;严重肝肾功能异常者(血清总胆红素、丙氨酸转氨酶、天冬氨酸转氨酶>2倍参考值上限;血清肌酐、尿素氮>1.5倍参考值上限);半年内有明确出血史、手术史或分娩史者;妊娠者;3个月内有补充铁剂治疗或生物制剂治疗史者;健康对照组参照个人档案及其他检查结果,剔除已患有急慢性疾病者、肿瘤史者、乙型及丙型肝炎病毒携带者,剔除合并高脂血症、高血压、高血糖、高尿酸血症者。
本研究得到宁波市医学伦理委员会批准,所有参与者均知情并同意其血液用于临床研究。
临床资料收集
收集RA患者的临床资料,包括性别、年龄、病程、是否合并其他疾病、肿胀关节数、压痛关节数、患者自我综合评分;收集其他CTD组患者的临床资料,包括性别、年龄、所患疾病及其他共存疾病。收集健康志愿者的一般资料,包括年龄、性别、健康状况。
实验室检测
所有标本为空腹12 h以上后于次日清晨7:00~9:00抽取外周静脉血15 ml。其中5 ml立即用于检测红细胞沉降率(erythrocyte sedimentation rate,ESR)、血红细胞计数(red blood cell,RBC)、血红蛋白含量(hemoglobin,Hb)。另10 ml予2000转min离心10 min后,取血清,检测C反应蛋白(C reaction protein,CRP)、类风湿因子(rheumatoid factors,RF)、铁蛋白(ferritin,FRN)。剩余血清置于-80°冰箱中保存,待统一融解后用于检测血清Hepc、白介素(interleukin,IL)-6、IL-1β、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)4项。ESR检测采用魏氏法;血常规、CRP、RF、FRN的检测分别使用Beckman-Coulter 公司生产的全自动血球计数仪 和Array360特定蛋白分析仪;Hepc[4]、IL-1β、IL-6及TNF-α检测使用购自Green-gene 公司的试剂盒,采用双抗体一步夹心法酶联免疫吸附试验,按照说明书步骤操作,并绘制标准曲线。
评价指标
将健康对照组血清Hepc浓度均值+2倍标准差,即3.5+2.36=5.86(μgL)作为正常值高限。
疾病活动性评估采用疾病活动性评分(disease activity score,DAS28)评分,由关节肿胀数、压痛数、患者自我综合评分、ESR、CRP构成,DAS28评分≤5.1为病情非高度活动,>5.1为病情高度活动。
细胞因子评价指标:IL-6、TNF-α、IL-1β。贫血评价指标:HB、RBC、FRN;男性Hb<120 gL、女性Hb<110 gL者定义为贫血。炎性指标:CRP、ESR。
统计学处理
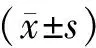
结 果
一般资料
RA组80例,其中男15例,女65例,平均年龄(55.6±12.3)岁。其他CTD组20例,包括系统性红斑狼疮9例(45%,920)、系统性硬化症8例、皮肌炎3例,其中男4例,女16例,平均年龄(57.5±11.9)岁。健康对照组20例,男4例,女16例,平均年龄(54.6±11.9)岁。3组患者年龄及性别比相匹配。RA组中,贫血患者47例,占59%;疾病对照组,贫血患者5例,占25%;健康对照组,贫血者2例,占10%。
3组实验室检查结果比较
RA组、健康对照组和其他CTD组血清Hepc浓度分别为(9.75±10.37)μgL,(3.50±1.18)μgL,(3.41±1.08)μgL。与健康对照组和其他CTD组比较,RA组血清Hepc浓度均明显升高,差异均有统计学意义(P分别=0.007、0.005)。其他CTD组与健康对照组血清Hepc浓度差异无统计学意义(P>0.05)。RBC、Hb及FRN水平在3组间比较虽有差别,但差异均无统计学意义(均P>0.05)。
RA患者Hepc升高组与正常组实验室检查比较
RA组80例患者中,Hepc升高组36例(45%),Hepc正常组44例(55%)。Hepc升高组DAS28评分和IL-6浓度均高于Hepc正常组,差异有统计学意义(均P<0.05)。年龄、Hb、RF、TNF-α、IL-1β在两组间均无明显差异(均P>0.05)(表1)。
表1类风湿关节炎患者Hepc升高组与正常组间比较
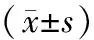

组别年龄∗(岁)血红蛋白∗(g∕L)疾病活动性评分∗(分)类风湿因子#(U∕L)白介素⁃6#(μg∕L)白介素⁃1β#(μg∕L)肿瘤坏死因子α#(μg∕L)Hepc升高组(n=36)52 93±10 73106 36±15 985 53±1 63334 06±355 81258 30±342 6518 91±74 9160 71±113 94Hepc正常组(n=44)56 56±13 26111 29±16 234 63±1 67263 24±373 39245 76±425 4721 52±73 3672 70±266 58P0 2330 3690 0330 0810 0220 9950 344
Hepc:铁调素;*正态分布数据,t检验;#非正态分布数据,Mann-Whitney U检验
RA贫血者与非贫血者实验室检查比较
RA组中,贫血者47例,非贫血者33例。RA贫血者IL-6较非贫血者明显升高,差异有统计学意义(P<0.05)。而TNF-α、IL-1β及Hepc在RA贫血者及非贫血者间差异无统计学意义(均P>0.05)(表2)。
RA病情高度活动者与非高度活动者实验室检查比较
RA组内,病情高度活动者41例,非高度活动者39例。病情高度活动者Hb水平明显低于非高度活动者,差异有统计学意义(P<0.05)。病情高度活动者Hepc水平较非高度活动者升高,但其差异无统计学意义(P=0.063)。而TNF-α、IL-1β和IL-6水平,在病情高度活动者与非高度活动者间均无明显差异(均P>0.05)(表3)。
RA患者Hepc与其他检查指标的相关性
RA组血清Hepc水平与IL-6(r=0.298)和RF(r=0.264)均存在正相关(均P<0.05);与DAS28存在明显正相关(r=0.359,P<0.01);但与年龄、TNF-α、IL-1β、HB、RBC、FRN、CRP、ESR均不存在相关性(均P>0.05)(表4)。
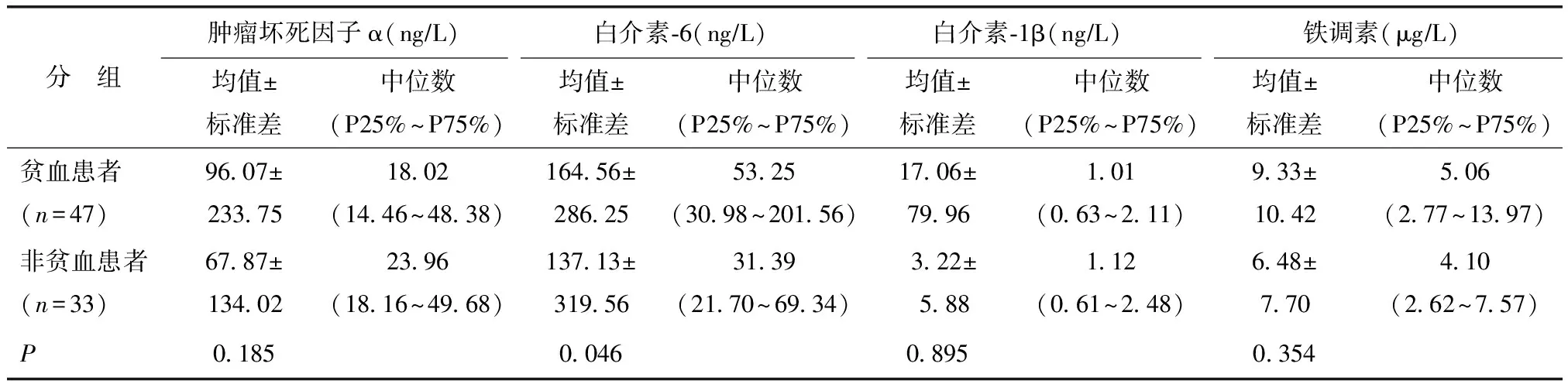
表2 类风湿关节炎贫血患者与非贫血患者实验室检查比较Table 2 Comparison of laboratory examination results between RA patients with anemia and without anemia
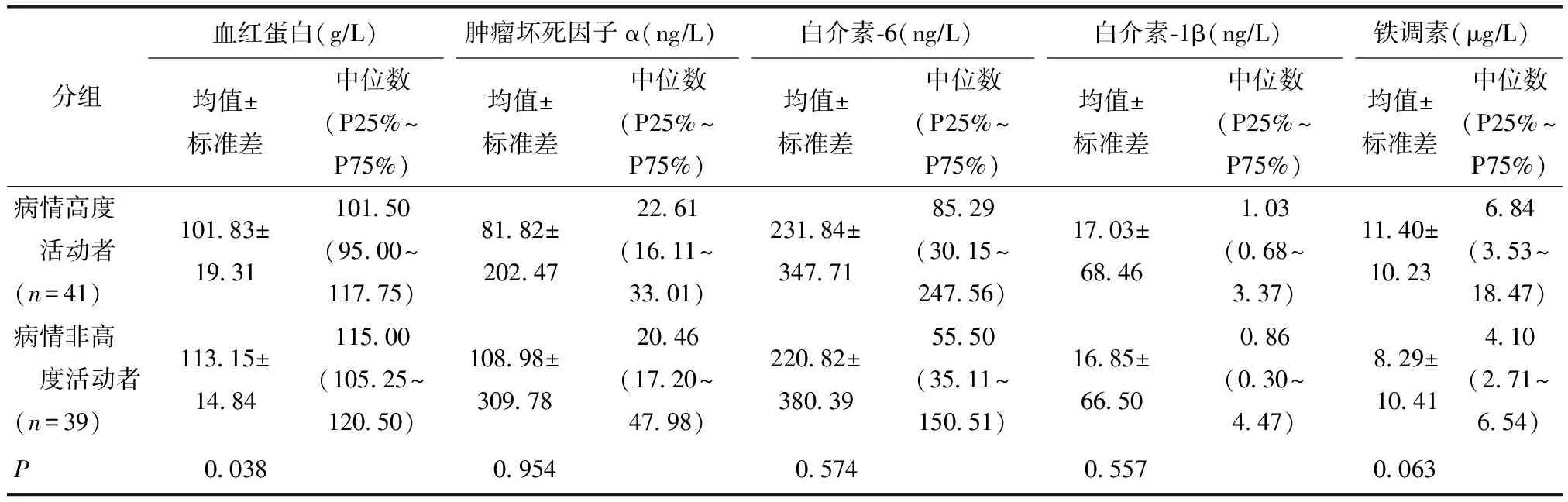
表3 类风湿关节炎病情高度活动者与非高度活动者实验室检查比较Table 3 Comparison of laboratory examination results between RA patients with high and low DAS28 scores
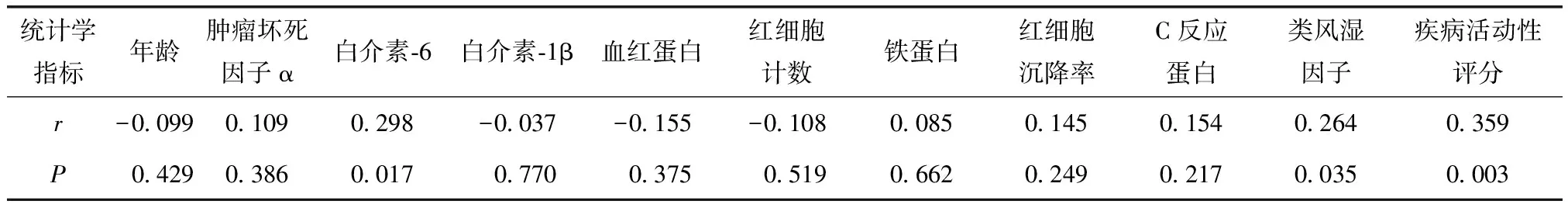
表4 类风湿关节炎患者铁调素与其他因素相关性分析Table 4 Correlation analysis of hepcidin and other factors in RA patients
讨 论
RA是高发病率的系统性自身免疫性疾病,机制复杂,至今未完全阐明。血清Hepc是近10年发现的小分子多肽,是体内铁代谢的关键因子,受机体铁的负反馈调节。当机体铁过多时,可刺激Hepc生成,阻止肠道铁吸收及巨噬细胞释放细胞内铁,避免铁超载发生;而机体缺铁时可抑制Hepc生成,增加肠道铁吸收,促进巨噬细胞细胞内铁及肝脏储存铁释放,弥补铁不足[5]。研究认为,Hepc不仅受体内铁水平调节,还受炎性因子调控,同时其本身也参与了炎性反应[6]。Armitage等[7]发现,H1N1急性感染者Hepc水平明显升高,提示Hepc不仅是铁代谢调节因子,还是急性时相蛋白。在自身免疫性疾病、慢性肾病等慢性炎性疾病中均发现Hepc水平升高[2]。Wang等[8]在针对炎性肠病的研究中发现,Hepc与其发病机制及炎性反应有关,推测其可能可作为炎性肠病的治疗靶点。在RA患者中发现,Hepc水平与疾病活动性关系密切[9-10],但针对RA患者Hepc相关研究十分有限,检索万方数据库及维普资讯,尚未见相关报道。探讨Hepc在RA患者中的变化及与贫血的关系,可以探索Hepc是否参与了RA的发病机制;同时,Hepc作为急性时相蛋白,是否可以反应RA疾病活动性及作为治疗RA的药物作用靶点。
本研究表明,RA患者贫血发生率达59%,不仅比正常人群高,也比其他CTD患者贫血发生率高。RA患者贫血原因很多,铁摄入不足、药物影响胃肠道引起失血可致缺铁性贫血,但少有单纯性缺铁性贫血,更多的是慢性炎性贫血或两者兼有,体内铁储存一般正常或偏高[11]。本研究也显示,RA病情高活动者Hb较非高活动者降低,提示疾病活动度高会进一步加重贫血。同时,RA组FRN与健康对照组相比无差异,提示RA患者缺铁并不是引起贫血的主要因素。一般情况下,贫血时Hepc降低,促进铁吸收及细胞内铁释放[5]。而本研究发现,RA患者Hepc水平明显升高,且RA贫血者与非贫血者间并无明显差异,与Hb、RBC、FRN也无关,与Hae等[10]的报道一致。提示Hepc可能作为炎性因子参与RA炎性反应。
Nemeth等[12]发现,给予正常人静脉注射IL-6后,其血清Hepc水平升高,血清铁和转铁蛋白饱和度下降。Kawabata等[13]发现,使用抗IL-6受体抗体治疗的巨大淋巴结增生症(castleman病)患者,其血清Hepc水平明显下降。Nemeth等[12]还发现,体外培养的人类肝细胞被IL-6诱导后出现Hepc mRNA表达增加,而IL-1、TNF-α却无此作用,故认为Hepc的生成是由于IL-6通过STAT-3机制作用于肝细胞后刺激了Hepc mRNA高转录及生成,与其他细胞因子如IL-1、TNF-α等无明显关系[14-15]。但Lee等[16]则通过动物实验提出,Hepc上调并非为IL-6诱导,也可以是非IL-6依赖的,IL-1、IL-6、转化生长因子β等细胞因子均可作为炎性介质刺激Hepc mRNA转录及生成。大量研究已证实,IL-6、IL-1、TNF-α等参与了RA的发病机制并在其病情活动中发挥重要作用,且均已作为药物治疗靶点成功应用于临床,如Tocilizumab(托珠单抗)[17]、Anakinra(阿那白滞素)、Etanercept(依那西普)。Hashizume和Mihara[18]也认为,IL-6是诱导RA患者Hepc生成并导致慢性炎性贫血的主要炎性因子。本研究检测了上述3种细胞因子,结果发现,45%的RA患者血清Hepc水平异常升高,且IL-6水平和DAS28评分均明显高于Hepc水平正常者;相关性分析也发现,Hepc水平与IL-6水平及DAS28评分呈正相关,但与TNF-α及IL-1β水平无关;同时,RA贫血者IL-6水平高于非贫血者,而TNF-α及IL-1β在两组间无明显差异。上述结论支持了Hashizume和Mihara的观点,提示RA中Hepc与IL-1、TNF-α无明显关联,而与IL-6及病情活动度关系密切。推测IL-6在RA中可能作为Hepc主要诱导刺激因子,RA疾病活动时,IL-6水平升高,诱导Hepc生成,共同参与炎性反应,导致铁吸收及利用障碍,引起或加重RA患者贫血。但本研究在病情活动度分析中未发现IL-6的差异,考虑可能跟样本量小及所采用的Mann-Whitney U检验敏感度较低有关。
Koca等[19]发现,RA患者Hepc水平比系统性红斑狼疮患者明显升高,而系统性红斑狼疮患者并未发现Hepc升高。本研究发现,Hepc水平在其他CTD组与健康对照组间无差异;其他CTD组中,45%的患者为系统性红斑狼疮,这在一定程度上也支持了Koca等[19]的结论。所以,推测Hepc异常升高可能在RA患者中更明显。本研究发现,Hepc水平与RF成正相关。一般并不认为RF水平代表RA病情活动度,但高滴度RF常与关节破坏及不良预后有关。且已有研究证实,贫血是影响RA预后的因素之一[1]。RA患者高水平的Hepc可能正是引起或加重贫血的原因之一,故提示RA患者Hepc水平可能可作为评估预后的指标。本研究还发现,Hepc和DAS28评分及IL-6水平相关,这与Abdel等[9]的研究一致,提示Hepc水平可能也可作为病情活动度评价指标。
总之,RA患者贫血发生率高,而Hepc水平明显升高,推测Hepc不仅是RA铁代谢调节因子,更主要的是作为炎性因子参与RA的炎性反应,其水平升高与IL-6和病情活动度密切相关,并与RF水平相关。RA患者高水平IL-6诱导了血清Hepc升高,导致铁代谢紊乱,诱发或加重了RA患者贫血。Hepc可能可作为病情活动度评价指标和预后评价指标之一;而Hepc是否可作为RA的治疗靶点,则有待于进一步研究。
[1]Han C,Rahman MU,Doyle MK,et al.Association of anemia and physical disability among patients with rheumatoid arthritis[J]. J Rheumatol,2007,34:2177-2182.
[2]Singh B,Arora S,Agrawal P,et al.Hepcidin:a novel peptide hormone regulating iron metabolism[J].C Chim Acta,2011,412:823-830.
[3]Aletaha D,Neogi T,Silman AJ,et al. Rheumatoid arthritis classification criteria:an American college of rheumatologyEuropean League Against Rheumatism collaborative initiative[J].Ann Rheum Dis, 2010,69:1580-1588.
[4]Butterfield AM,Luan P,Witcher DR,et al.A dual-monoclonal sandwich ELISA specific for Hepcidin-25[J].Clin Chemistry, 2010,56:1725-1732.
[5]Viattle L,Vaulont S. Hepcidin,the iron watcher[J].Biochimie,2009,91:1223-1228.
[6]Malyszko J. Hemojuvelin: the Hepcidin story continues. Kidney Blood Press Res[J], 2009,32:71-76.
[7]Armitage AE, Eddowes LA, Gileadi U,et al. Hepcidin regulation by innate immune and infectious stimuli[J].Blood,2011,118;4129-4139.
[8]Wang L,Trebicka F,Fu Y,et al.The bone morphogenetic protein-Hepcidin axis as a therapentic target in inflammatory bowel disease[J].In Flamm Bowel Dis, 2012,18:112-119.
[9]Abdel KMA,EL-Barbary AM, Essa SA, et al.Serum Hepcidin:a direct link between anemia of inflammation and coronary artery atherosclerosis in patients with rheumatoid arthritis[J]. J Rheumatol,2011,38:2153-2159.
[10] Hae RK, Kyoung WK, So YY, et al. Serum pro-Hepcidin could reflect disease activity in patients with rheumatoid arthritis[J]. J Koren Med Sci,2010,25:348-352.
[11] Wahle M. Anemia in patients with rheumatoid arthritis[J]. Z Rheumatol,2012,71:864-868.
[12] Nemeth E,Rivera S,Gabayan V,et al.IL-6 mediates hypoferremia of inflammation by inducing the synthesis of the iron regulatory hormone hepicidin[J]. J Clin Invest, 2004, 113:1271-1276.
[13] Kawabata H,Tomosugi N,Kanda J,et al.Anti-interleukin 6 receptor antibody tocilizumab reduces the level of serum hepcidin in patients with multicentric Castleman’s disease[J].Haematologica,2007,92:857-858.
[14] Nemeth E, Valore EV, Territo M, et al. Hepcidin, a putative mediator of anemia of inflammation, is a type II acute phase protein[J]. Blood,2003,101:2461-2463.
[15] Verga FMV, Vujic SM,kessler R,et al.STAT3 mediates hepatic Hepcidin expression and its inflammatory stimulation[J]. J Blood,2007,109:353-358.
[16] Lee P, Peng H, Gelbart T,et al. Regulation of Hepcidin transcription by interleukin-1 and interleukin-6[J]. J Proc Natl Acad Sci USA,2005,102:1906-1910.
[17] 姜楠,费允云,赵岩.白细胞介素6阻断剂在类风湿关节炎治疗的应用[J]. 中华临床免疫和变态反应杂志,2012,6:232-236
[18] Hashizume M,Mihara M. The role of interleukin-6 in the pathogenesis of rheumatoid arthritis[J]. Arthritis,2011,2011:765624.
[19] Koca SS,Isik A,Ustundag B,et al. Serum pro-Hepcidin levels in rheumatoid arthritis and systemic lupus erythematosus[J].Inflammation,2008,31:146-153.
