原发性干燥综合征外周血单个核细胞P2X7受体表达及其与焦虑、抑郁的相关性
2013-04-09谢斌华邬秀娣黄娴倩季蕴辛禹海航
谢斌华,彭 勇,陈 勇,张 顺,邬秀娣,张 振,黄娴倩,季蕴辛,禹海航
(宁波市第二医院风湿免疫科,宁波 315010)
原发性干燥综合征(primary Sjögren’s syndrome,pSS)是一种慢性、系统性自身免疫性疾病,其发病率为0.5%~5%,男女比例约为1∶9,发病机制不明。国内外研究均提示,少数pSS患者合并焦虑、抑郁等心理障碍[1-4],且显著高于类风湿关节炎(rheumatoid arthritis,RA)患者及全部人群[2]。pSS和焦虑、抑郁等心理障碍之间是否存在联系值得引起临床关注。
嘌呤受体分为配体为腺苷酸的P1受体和配体主要为三磷酸腺苷(adenosine triphosphate,ATP)的P2受体。P2受体又分为P2X受体和P2Y受体,其中P2X受体是一类配体门控非选择性阳离子通道嘌呤受体,目前已有7型P2X(P2X1-7)受体被克隆。相关研究证实,P2X7受体(purinergic P2X7receptor,P2X7R)可能通过ATP诱导促炎性细胞因子合成、凋亡、基因多态性等多重机制与自身免疫性疾病(如系统性红斑狼疮及RA等)[5-6]及焦虑、抑郁等心理障碍[7]的发病过程或病理生理相关。大量研究提示,P2X7R下游信号传导与促炎性级联反应耦联,P2X7R主要表达于单核巨噬细胞、淋巴细胞及脑内小胶质细胞,并与其释放成熟的促炎性细胞因子,如白介素(interleukin,IL)-1β及IL-6等有关[8-9]。
本研究针对pSS患者外周血单个核细胞(peripheral blood mononuclear cell,PBMC)上P2X7R的表达情况及其相关促炎性细胞因子(IL-1β、IL-6)水平进行研究,并量化评估上述指标与pSS患者合并焦虑、抑郁等心理障碍的相关性,从而探讨pSS患者PBMC上P2X7受体的表达情况及其与焦虑、抑郁的相关性。
对象和方法
研究对象
pSS组:选择2012年1月至9月在宁波市第二医院确诊的pSS患者,诊断符合2002年修订的干燥综合征国际分类标准,且排除其他潜在的自身免疫疾病、感染、恶性肿瘤等疾病。
阳性对照:选取同时期同医院确诊的未合并干燥综合征的RA患者作为RA组,以及同时期宁波市康宁医院神经症科确诊的、排除自身免疫性疾病的、焦虑和(或)抑郁患者作为焦虑抑郁组。
阴性对照:选取宁波市第二医院健康职工(包括退休职工)20名为健康组。
所有化验样本的取得都事先取得了受试者的同意。
心理评估量表
汉密尔顿抑郁量表和焦虑量表用于评估受试对象是否存在焦虑和(或)抑郁及其程度。评定时间范围设为过去1周内。由2名经培训的医师采用交谈与观察的方式进行检查,结束后2名评定者分别独立评分后取均值。汉密尔顿抑郁量表超过17分评定为抑郁,小于7分为无抑郁症状;焦虑量表总分超过14分评定为焦虑,小于6分为无焦虑症状。
PBMC分离
抽取受试者空腹静脉血(约3ml)于肝素抗凝的真空采血管中,用Ficoll-hypague(GE,USA)密度梯度离心法分离收集PBMC,并在Hanks平衡盐液(Hyclone,USA)中洗涤2次。用含有10%热灭活的胎牛血清(Hyclone,USA)、2mM L-谷氨酰胺及100 Uml青霉素和100 μgml链霉素的RPMI-1640液(Hyclone,USA)作为完全培养基重悬细胞。收集得到的PBMC用于P2X7受体表达流式细胞分析。
P2X7受体表达流式细胞分析
将上述完全培养基重悬的PBMC(1×106ml)分成2份,在其中1份中加入3 mM ATP,均在37℃5% CO2培养箱中孵育过夜,用Hanks平衡盐液洗涤1次。用PE-耦联的抗CD14(BD Bioscience,USA)及FITC-耦联的抗P2X7(Sigma,USA)标记,用PE耦联的IgG1(BD Bioscience)及全IgG抗体(Sigma,USA)作为同型对照。细胞悬液与抗体充分混匀,4℃避光静置30 min。Hanks平衡盐液洗涤2次后重悬细胞。用流式细胞仪(Beckman Coulter Epics XL,USA)对上述细胞进行上样分析。流式细胞上样分析方案见图1。
酶联免疫吸附检测技术测定IL-1β、IL-6
抽取受试者空腹静脉血于肝素抗凝的真空采血管中,留取1 ml离心1 000g×5 min,取血浆在-20℃冻存,备测。在1.5 ml EP管中加入200 μl上述抗凝新鲜全血,加入200 μl上述RPMI-1640培养基,并加入100 ngml脂多糖(lipopolysaccharide,LPS)(Sigma,USA)和3 mM ATP(Sigma,USA),并在37℃5% CO2培养箱中孵育2 h。离心1 000 g×5 min,取上清液在-20℃冻存,备测。用双抗体夹心酶联免疫吸附检测技术检测上述细胞培养上清液中的IL-1β和IL-6。采用杭州联科生物人IL-1β和IL-6酶联免疫吸附检测技术试剂盒,严格按照试剂盒说明书操作。
统计学处理
采用SPSS17.0软件,连续数据根据各测量结果的离散程度决定由四分位数范围或(均值±标准差)表示。连续数据符合正态分布则进行均数比较,否则采用非参数统计。均数比较两个独立样本采用t检验,两个以上独立样本采用单因素方差分析,两两比较用LSD检验;非参数统计两两比较采用Mann-Whitney U检验,两个以上样本采用Kruskal-Walli检验。双变量服从正态分布则采用Pearson相关分析,否则采用Spearman秩相关分析。P<0.05为差异有统计学意义。
结 果
一般情况
pSS组共纳入31例患者,其中男2例,女29例,年龄为23~81岁,平均年龄为(52.79±13.88)岁。阳性对照组中,RA组19例,其中男3例,女16例,年龄为43~78岁,平均年龄为(61.33±10.19)岁;焦虑和或抑郁组18例,其中男2例,女16例,年龄为33~66岁,平均年龄为(51.38±8.74)岁。健康组20名,男2例,女18例,年龄为34~71岁,平均年龄为(51.36±10.63)岁。各组年龄和性别构成差异均无统计学意义(P>0.05)。
P2X7受体表达
pSS组、RA组、焦虑抑郁组、健康组的PBMC表面均有P2X7受体表达。ATP刺激较未刺激,仅pSS组CD14+PBMC(主要为单核细胞)表面P2X7受体表达显著增高(t=3.647,P=0.001);在CD14-PBMC(主要为淋巴细胞)表面,P2X7受体表达在pSS组(t=4.908,P<0.001)及焦虑抑郁组(t=3.412,P=0.003)均显著增高(表1)。
ATP刺激后,pSS组CD14+PBMC表面P2X7受体表达显著高于RA组(P=0.044)、焦虑抑郁组(P=0.004)及健康组(P=0.002);在CD14-PBMC表面,pSS组P2X7受体表达较RA组(P=0.039)及阴性对照组(P<0.001)显著增高,而与焦虑抑郁组差异无统计学意义(P=0.126);其余各组两两比较差异均无统计学意义(均P>0.05)(表1)。
无论ATP是否刺激,同时存在焦虑和抑郁的pSS患者CD14-PBMC表面P2X7受体表达显著高于无焦虑和抑郁的pSS患者(ATP刺激时P=0.003,无刺激时P=0.009)(表2)。
IL-1β及IL-6测定
PBMC培养上清液在无LPS及ATP刺激时,各组几乎均未检测出IL-1β。刺激后各组均检测出IL-1β,在LPS和ATP刺激2 h后,pSS组IL-1β水平显著高于RA组(Z=-2.560,P=0.010)、焦虑抑郁组(Z=-2.109,P=0.035)及阴性对照组(Z=-2.244,P=0.025),其余各组两两比较差异均无统计学意义(均P>0.05)(表2)。
无LPS及ATP刺激时,阴性对照组IL-6水平显著低于pSS组(Z=-2.521,P=0.012)、RA组(Z=-3.724,P<0.001)及焦虑抑郁组(Z=-2.406,P=0.016);RA组IL-6水平较pSS组(Z=-2.647,P=0.008)及焦虑抑郁组(Z=-2.347,P=0.019)均显著增高;pSS组与焦虑抑郁组比较差异无统计学意义(Z=-0.074,P=0.941)。LPS及ATP刺激2 h后,各组IL-6水平显著高于未刺激前水平(Z=-6.793,P<0.001),但刺激后各组IL-6水平差异无统计学意义(χ2=0.778,P=0.855)(表3)。
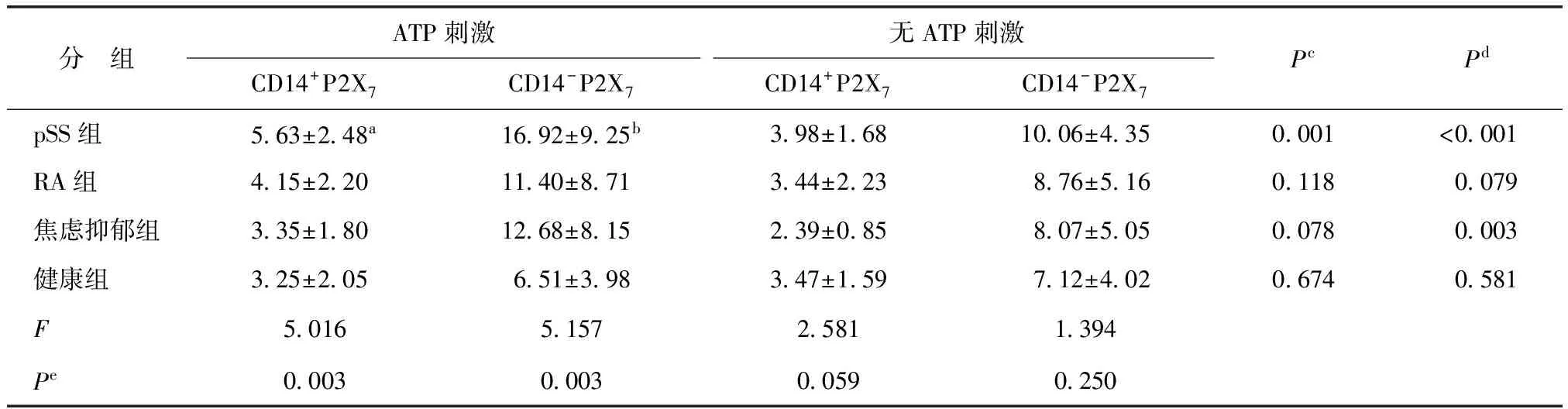
表1 流式细胞仪检测外周血单个核细胞表面P2X7受体表达Table 1 Expression of P2X7 receptor on peripheral blood mononuclear cells by flow cytometry [%,(均数±标准差)]
ATP:三磷酸腺苷;pSS:原发性干燥综合征;RA:类风湿关节炎;a显著高于RA组(P=0.044)、焦虑抑郁组(P=0.004)、健康组(P=0.002);b显著高于RA组(P=0.039)及健康组(P<0.001),但与焦虑抑郁组比较差异无统计学意义(P=0.126);cATP刺激与无刺激CD14+P2X7表达之差;dATP刺激与无刺激CD14-P2X7表达之差;e单因素方差分析

表2 原发性干燥综合征患者外周血单个核细胞表面P2X7受体表达Table 2 Expression of P2X7 receptor on peripheral blood mononuclear cells in patients with primary Sjogren’s syndrome (均数±标准差)
ATP:三磷酸腺苷;*单因素方差分析;NA:未测出
相关性分析
ATP刺激后,pSS组、焦虑抑郁组外周血CD14-PBMC表面P2X7受体表达与焦虑评分(r=0.344,P=0.030)及抑郁评分(r=0.319,P=0.045)呈显著正相关;无ATP刺激,其表达仅与焦虑评分(r=0.442,P=0.045)呈显著正相关。LPS及ATP刺激2 h后,pSS患者IL-1β水平与其在ATP刺激后外周血CD14+PBMC表面P2X7受体表达呈显著正相关(r=0.447,P=0.025);pSS组PBMC表面P2X7受体表达与 IL-6、红细胞沉降率、C反应蛋白及免疫球蛋白等疾病活动性指标未见显著相关性(表4)。
表3 外周血单个核细胞培养上清液IL-1β及IL-6水平Table 3 Peripheral blood mononuclear cells culture supernatant levels of IL-1β and IL-6 [pgml,(均数±标准差;四分位数区间)]
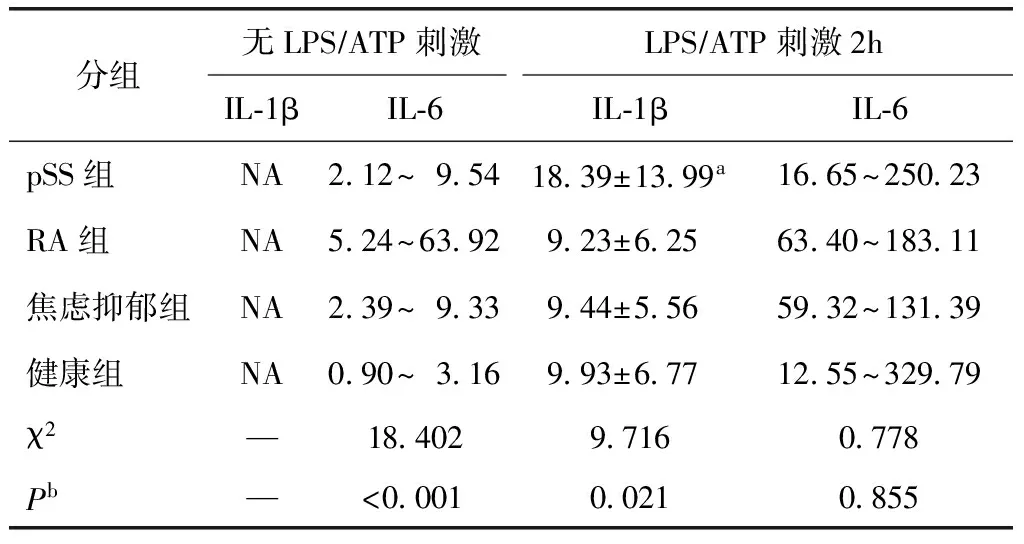
表3 外周血单个核细胞培养上清液IL-1β及IL-6水平Table 3 Peripheral blood mononuclear cells culture supernatant levels of IL-1β and IL-6 [pgml,(均数±标准差;四分位数区间)]
分组无LPS∕ATP刺激LPS∕ATP刺激2hIL⁃1βIL⁃6IL⁃1βIL⁃6pSS组NA2 12~9 5418 39±13 99a16 65~250 23RA组NA5 24~63 929 23±6 2563 40~183 11焦虑抑郁组NA2 39~9 339 44±5 5659 32~131 39健康组NA0 90~3 169 93±6 7712 55~329 79χ2—18 4029 7160 778Pb—<0 0010 0210 855
IL:白介素;LPS:脂多糖;ATP:三磷酸腺苷;pSS:原发性干燥综合征;RA:类风湿关节炎;NA:未测出;a显著高于RA组(P=0.010)、焦虑抑郁组(P=0.035)及健康组(P=0.025);bKruskal-Wallis检验
讨 论
早在1988年,国外学者的研究就表明pSS患者有明显焦虑、抑郁等严重的精神症状[1]。随后欧美等国的小规模研究均提示,pSS患者合并焦虑、抑郁等心理障碍的发生率明显增高[2]。我国也有研究提示,49%的pSS患者存在焦虑,30%的pSS患者合并抑郁[3]。2009年美国Barbara等[4]的大规模研究也证实了上述研究结果。本研究采用了汉密尔顿焦虑、抑郁量表进行评价,也得到了相似结果。
本研究显示,ATP刺激较未刺激,pSS患者外周血CD14+PBMC(单核细胞)表面P2X7受体表达显著增高,而对于健康组,其表达的差异并无统计学意义;ATP刺激后,pSS患者外周血CD14+PBMC(单核细胞)表面P2X7受体表达较健康组显著增高;进而提示,与RA患者、焦虑抑郁患者及健康人相比,pSS患者单核细胞对ATP的刺激更为敏感。在LPS存在的条件下,ATP刺激外周血后上清中IL-1β、IL-6显著增高,提示嘌呤受体(特别是P2)可能与外周血细胞释放成熟的促炎性细胞因子IL-1β、IL-6有关。而ATP刺激pSS患者外周血后,其上清中IL-1β水平与CD14+PBMC表面P2X7受体表达呈显著正相关,进而提示单核细胞表面的P2X7受体可能参与了IL-1β的释放。也就是说,ATP刺激后pSS患者除了单核细胞P2X7受体表达量增高外,其功能也增强。

表4 ATP刺激后CD14+外周血单个核细胞表面P2X7受体表达与pSS临床参数的相关性Table 4 Correlation between the expression of P2X7 receptor on ATP stimulation CD14+ peripheral blood mononuclear cells and clinical parameters in pSS
IL:白介素;ATP:三磷酸腺苷;pSS:原发性干燥综合征;a脂多糖及ATP刺激2 h
P2X7受体除了与免疫紊乱相关外,还与心理障碍有关。其被认为是神经精神和免疫系统联系的一个关键因子[7],焦虑、抑郁等心理障碍的发病机制可能涉及P2X7受体。Basso等[11]研究提示,P2X7受体敲除的小鼠在悬尾实验和强迫游泳实验显示出抗抑郁样行为。Boucher等[12]研究表明也证实这一关点。编码P2X7受体的P2X7基因位于染色体12q24.31,该区域是抑郁和焦虑障碍的重要遗传区域,提示其可能与情感障碍有关[13]。基因图谱和连锁不平衡分析显示,P2X7基因中Gln460Arg单核苷酸多态性有抑郁和双相情感障碍的易感性,量化的病例对照研究也提示其与抑郁障碍相关[14]。
激活的P2X7受体所致细胞因子释放可能参与了焦虑、抑郁等心理障碍的发生发展。一方面,一些针对细胞因子的研究提示,焦虑、抑郁等心理障碍普遍存在细胞因子紊乱。Song等[15]发现,抑郁症患者血清IL-1β水平显著增高,抗抑郁治疗后其水平减低。Boufidou等[16]研究提示,妇女脑脊液IL-6水平与产后抑郁有关。大量的动物实验也提示这一关点。促炎性细胞因子IL-1β及IL-6能够导致动物出现明显的抑郁样行为,而IL-1受体敲除的小鼠未诱导出焦虑样行为[17],IL-6敲除的小鼠亦未因应激而导致抑郁样行为[18]。另一方面,动物实验证实,在LPS刺激下P2X7受体敲除的小鼠脑内小胶质细胞分泌IL-1β明显减少[19]。
本研究结果提示,与健康组相比,无论是pSS患者还是焦虑抑郁患者血浆中IL-6水平均显著增高。在LPS存在的条件下,ATP刺激后外周血中IL-1β、IL-6显著增高。ATP刺激较未刺激,pSS患者及焦虑抑郁患者外周血CD14-PBMC(主要为淋巴细胞)表面P2X7受体表达显著增高。ATP刺激后,pSS患者外周血CD14-PBMC表面P2X7受体表达较RA患者及健康人显著增高,而与焦虑抑郁患者相比其表达差异无统计学意义。无论ATP是否刺激,同时存在焦虑和抑郁的pSS患者CD14-PBMC表面P2X7受体表达显著高于无焦虑和抑郁的pSS患者。ATP刺激后,外周血CD14-PBMC表面P2X7受体表达与焦虑、抑郁评分呈显著正相关。无ATP刺激,其表达与焦虑评分呈显著正相关。进而提示pSS患者及焦虑抑郁患者外周血CD14-PBMC(主要为淋巴细胞)对ATP刺激更为敏感。
P2X7受体可能通过活化后调节促炎性细胞因子、基因多态性等参与pSS患者及其合并焦虑抑郁状态的发病机制及病理生理。这一结论提示,一方面或可通过动物实验等检测ATP刺激前后脑内小胶质细胞上P2X7受体表达情况,进而研究其与焦虑、抑郁等心理障碍的相关性;另一方面或可将P2X7基因作为研究位点,分析pSS患者的基因多态性,进而研究其与合并焦虑、抑郁等心理障碍的相关性。
综上所述,pSS和焦虑、抑郁等心理障碍存在着明显的共病倾向。无论是pSS患者还是焦虑、抑郁等心理障碍的患者都存在免疫紊乱,而P2X7受体则被认为是神经精神和免疫系统联系的关键因子。P2X7受体可能涉及pSS混着及其合并焦虑、抑郁等心理障碍的发病机制或病理生理,而其中促炎性细胞因子IL-1β等可能发挥着重要作用。进一步研究其机制对于揭示pSS及其合并心理障碍的发病机制、寻找新的治疗靶点都具有积极意义。
(本文图1见封3)
[1]Angelopoulos N, Drosos AA, Kosovitsa G, et al. Personality and psychopathology in patients with primary Sjögren’s syndrome[J]. Ter Arkh, 1988, 60:49-52.
[2]Valtysdóttir ST, Gudbjörnsson B, Lindqvist U, et al. Anxiety and depression in patients with primary Sjögren’s syndrome[J]. J Rheumatol, 2000, 27:165-169.
[3]王艳艳, 张缪佳, 沈友轩, 等. 47例原发性干燥综合征患者的抑郁与焦虑情况调查[GOL]全国自身免疫性疾病专题研讨会暨第十一次全国风湿病学学术年会论文汇编. 2006:232.http:lib.cnki.netcpfdFSBx200605001402.html.
[4]Barbara S, Simon JB, Phili PCF, et al. Primary Sjögren’s Syndrome:health experiences and predictors of health quality among patients in the United States[J]. Health Qual Life Outcomes, 2009, 7:46-54.
[5]王美云,陶金辉,李向培,等.嘌呤受体P2X配体门控性离子通道7在初发系统性红斑狼疮患者外周血淋巴细胞的表达及意义[J]. 中华风湿病学杂志, 2013,17:46-48.
[6]Baroja-Mazo A, Pelegrín P. Modulating P2X7Receptor Signaling during Rheumatoid Arthritis: New Therapeutic Approaches for Bisphosphonates[J]. J Osteoporos, 2012, 2012:408242.
[7]Volonte C, Apolloni S, Skaper SD, et al. P2X7Receptors Channels, Pores and More[J]. CNS Neurol Disord Drug Targets, 2012, 11:705-721.
[8]Lister MF, Sharkey J, Sawatzky DA, et al. The role of the purinergic P2X7receptor in inflammation[J]. J Inflamm(Lond), 2007,4:5.
[9]Arulkumaran N, Unwin RJ, Tam FW.A potential therapeutic role for P2X7receptor (P2X7R) antagonists in the treatment of inflammatory diseases[J].Expert Opin Investig Drugs, 2011,20:897-915.
[10] Solle M, Labasi J, Perregaux DG,et al.Altered cytokine production in mice lacking P2X(7) receptors[J].J Biol Chem, 2001,276:125-132.
[11] Basso AM, Bratcher NA, Harris RR, et al.Behavioral profile of P2X7receptor knockout mice in animal models of depression and anxiety: relevance for neuropsychiatric disorders[J]. Behav Brain Res, 2009, 198:83-90.
[12] Boucher AA, Arnold JC, Hunt GE,et al.Resilience and reduced c-Fos expression in P2X7receptor knockout mice exposed to repeated forced swim test[J]. Neuroscience, 2011,189:170-177.
[13] Erhardt A, Lucae S, Unschuld PG,et al. Association of polymorphisms in P2RX7 and CaMKKb with anxiety disorders[J]. J Affect Disord, 2007, 101:159-168.
[14] Hejjas K, Szekely A, Domotor E,et al.Association between depression and the Gln460Arg polymorphism of P2RX7 gene: a dimensional approach[J].Am J Med Genet B Neuropsychiatr Genet, 2009, 150B:295-299.
[15] Song C, Halbreich U, Han C,et al. Imbalance between pro- and anti-inflammatory cytokines, and between Th1 and Th2 cytokines in depressed patients: the effect of electroacupuncture or fluoxetine treatment[J]. Pharmacopsychiatry, 2009, 42:182-188.
[16] Boufidou F, Lambrinoudaki I, Argeitis J, et al. CSF and plasma cytokines at delivery and postpartum mood disturbances[J]. J Affect Disord, 2009, 115:287-292.
[17] Koo JW, Duman RS.Interleukin-1 receptor null mutant mice show decreased anxiety-like behavior and enhanced fear memory[J].Neurosci Lett, 2009, 456:39-43.
[18] Chourbaji S, Urani A, Inta I,et al. IL-6 knockout mice exhibit resistance to stress-induced development of depression-like behaviors[J]. Neurobiol Dis, 2006, 23:587-594.
[19] Mingam R, De Smedt V, Amédée T, et al. In vitro and in vivo evidence for a role of the P2X7receptor in the release of IL-1 beta in the murine brain[J]. Brain Behav Immun, 2008, 22:234-244.
