乙醛液相羟醛缩合反应工艺和动力学
2013-03-28伍艳辉任伟丽梁泽磊刘仲能吴高胜
伍艳辉,任伟丽,梁泽磊,刘仲能,吴高胜
(1.同济大学化学系,上海200092;2.中国石油化工股份有限公司上海石油化工研究院,上海201208)
乙醛是一种重要的化工原料,两个乙醛分子经羟醛缩合反应可生成3-羟基丁醛,3-羟基丁醛经加氢得到的1,3-丁二醇,可用于合成多种树脂和表面活性剂[1,2]。3-羟基丁醛脱水可制得丁烯醛,在高分子聚合物[3]和合成树脂等方面有广阔的应用。目前国内丁烯醛的生产技术还不够成熟,在国际市场上还缺乏竞争力[4]。乙醛的羟醛缩合是乙醛在液碱(NaOH,KOH,Na2CO3和有机胺)或阴离子树脂催化作用下缩合生成3-羟基丁醛,在稀酸作用下可进一步脱水生成丁烯醛。上世纪20年代就有对乙醛缩合反应的专利报道[5],周兴佳等[6]对生产工艺流程进行了优化,加入了吸收塔和精馏塔对产品进行精制,由于该反应转化率仍然偏低,需对乙醛缩合反应的催化剂进行更细致地筛选,考察不同碱性条件对反应的影响。在乙醛缩合过程中,反应时间延长会导致反应产物羟基丁醛和乙醛发生深度缩合等副反应,采用反应精馏工艺来进行羟醛缩合可以将未反应完全的乙醛与产物羟基丁醛及时分离,从而有效提高全程转化率。塔内液相乙醛缩合动力学研究是反应精馏过程模拟的基础,在实际反应精馏过程中不同塔段溶液的pH值会有不同,在进行动力学研究时需要分别考虑,但目前这方面的研究还较少。本工作首先对不同类型的碱催化剂的羟醛缩合反应效果进行了考察,深入分析pH值与温度对反应的影响,并在不同pH值条件下对反应动力学进行研究,为后续的反应精馏研究提供动力学基础。
1 实验部分
1.1 实验方法
将质量分数为50%的乙醛水溶液(本研究所用乙醛主要由三聚乙醛在酸性条件下解聚得到)与一定量的碱催化剂混合并快速测其初始pH值,随后将其迅速加入装有机械搅拌、温度计、冷凝管的250 mL的三口烧瓶中,水浴加热使温度维持在25℃。反应一定时间后取样分析。若采用阴离子交换树脂(大孔强碱苯乙烯型阴离子交换树脂A500P和强碱丙烯酸型阴离子交换树脂A850,由漂莱特(PUROLITE)国际有限公司提供)为催化剂,先将树脂活化:依次用质量分数为5%的HCl溶液、去离子水、质量分数为5%的NaOH溶液清洗,再采用质量分数为5%的NaOH溶液浸渍24 h,洗至中性后与一定量的蒸馏水混合加入三口烧瓶,然后加入反应原料进行反应。以质量分数为50%乙醛溶液为原料,以Na2CO3为催化剂,调节pH值至11.8,分别在不同的温度下反应60 min,考察温度对转化率和选择性的影响。
反应前后样品采用气相色谱分析,以异丙醇为内标物,采用内标法定量,所用色谱为天美GC7890II型气相色谱仪,FID检测器,HP-FFAP(50 m×0.2 mm×0.3µm)毛细管柱。色谱条件如下:进样口温度200℃,检测器温度250℃,柱温90℃,进样量0.2µL,分流比60:1。
1.2 反应动力学研究
乙醛缩合反应机理如式(1)~(3)所示。乙醛在碱性条件下失去α-H与OH-生成烯醇负离子,烯醇负离子与一分子乙醛发生亲核加成生成烷氧基负离子,然后烷氧基负离子夺取水分子中的一个质子生成β-羟基丁醛。其中第一步反应是慢反应,为速率控制步骤,第二步和第三步为快反应。

文献报道[7,8]低乙醛浓度下该反应是二级反应,而工业上所用乙醛溶液浓度很高,需要对高浓度下反应动力学进行研究,通过实验得到动力学方程和参数,以便对乙醛缩合反应精馏过程的模拟和实验。
假设高浓度下乙醛的缩合反应为二级反应,反应动力学方程可表示为

积分得

式中ca为乙醇瞬时浓度,kmol·L-1;ca0为乙醇初始浓度,kmol·L-1;k为反应速率常数;t为反应时间,min。
若实验所测(1/ca-1/ca0)与t之间关系为线性,说明二级反应假设正确。然后可由不同温度下反应速率常数k与温度的关系得到反应活化能和指前因子。

式中,Ea为反应活化能,kJ·mol-1;A为指前因子,m3·kmol-1·s-1;R为气体常数,J·mol-1·K-1;
配制质量分数为50%的乙醛溶液,与适量Na2CO3催化剂混合,考虑到后续反应精馏过程中乙醛缩合反应在不同塔段pH值会有所不同,控制反应体系pH值为11.4,11.0和10.4,迅速将溶液加入水浴控温的三口烧瓶中反应,并适度搅拌,每隔5~15 min取样分析,根据实验数据计算、分析得到动力学方程和参数。
2 结果与讨论
2.1 催化剂筛选
为考察催化剂对乙醛缩合反应的影响,分别以强碱、弱碱、混合碱、有机胺和丙烯酸树脂,大孔苯乙烯树脂等为催化剂进行乙醛缩合反应实验,结果见表1。可以看出,以丙烯酸树脂和大孔苯乙烯树脂为催化剂时,反应转化率较低,分别为5.5%和2.5%。在实验过程中,发现大孔苯乙烯树脂在反应后出现变色和失活。由表1还可以看出,乙醛缩合反应效果和反应体系溶液的pH值密切相关。以强碱KOH和NaOH溶液为催化剂,其初始pH值很高,反应比较剧烈,在短时间内转化率和选择性较高,而且反应时间延长,出现深度缩合,选择性会迅速降低;反应前后pH值变化较大,反应过程中出现pH值下降主要是由于乙醛与空气接触会氧化生成乙酸以及OH-会与醛结合。以Na2CO3溶液为催化剂时,反应较缓和,需较长时间才能获得较高的转化率,但溶液易于形成缓冲体系,反应前后pH值基本稳定,使选择性可在较长时间内维持较高水平。以NaOH和Na2CO3形成的混合碱以及有机胺溶液为催化剂,虽能得到高选择性(100%),但转化率低。综合考虑,以Na2CO3溶液为催化剂较合适,因此,后续研究采用Na2CO3溶液为催化剂。

表1 不同催化剂的反应性能Table 1 Performance of different catalysts
2.2 pH对乙醛缩合的影响
OH-浓度对反应动力学影响至关重要[7,9],而且催化剂的失活也与溶液酸碱性密切相关,而直接反映OH-浓度的就是溶液的pH值,已有研究[10]表明乙醛缩合反应体系以(NH4)2SO4为催化剂时pH值高于7~8时反应效果较好,而以Na2CO3为催化剂时控制pH值大于11转化率较高;另外也有报道指出在酸性条件下可进行缩合[11]。本研究考察了pH值对反应的影响,以不同初始浓度的KOH溶液为催化剂,测定初始pH值,当反应温度为30℃,反应时间为30 min时,反应结果如表2所示。由表2结果可知:在30 min内,pH值小于11时,转化率较低,选择性接近100%;pH值大于12时,转化率明显提高,选择性明显下降。原因在于碱性增强时体系副反应(如多聚乙醛的生成和丁烯醛环化或氧化反应)更容易发生。考虑到可以通过延长反应时间或采用反应精馏工艺等方法提高转化率,控制较高的反应选择性更重要,将反应体系pH值控制在11~12对反应比较有利。

表2 反应初始pH值对乙醛缩合的影响Table 2 Effects of initial pH on condensation of aldol
2.3 温度对反应的影响
伍艳辉[12]曾对乙醛缩合反应进行热力学计算,发现其主反应为强放热反应,常温下反应焓约为-40 kJ/mol,低温对反应有利,但升高温度能加快反应速率,需要对合适的温度条件进行优化。
控制pH值在11~12之间,考察了温度对乙醛缩合反应的转化率和选择性的影响,结果如图1和2所示。由图1可知:转化率随反应温度升高而提高,反应开始时乙醛浓度最高,反应速率最快,转化率变化明显;随着反应的进行,乙醛浓度降低,反应速率变慢。图2表明反应选择性随着反应的进行而下降,且反应温度越高,选择性越低,随反应时间延长降低越快。如30℃时反应60 min选择性大于97%,35℃时反应60 min选择性大于94%,40℃时反应60 min时选择性只有80%。为了抑制副反应,将反应体系pH值控制在11~12和反应温度为35℃时对获得较高的转化率和选择性有利。

图1 温度对反应转化率的影响Fig.1 The impact of temperature on the conversion

图2 温度对反应选择性的影响Fig.2 The impact of temperature on the selectivity
2.4 反应动力学实验结果
反应体系动力学实验结果如图3所示,其中图3(a)为不同温度下反应物浓度随反应时间的变化规律。可看出,同一温度下,(1/ca-1/ca0)与t近似为线性关系(相关系数接近1),表明乙醛羟醛缩合反应为二级反应。对图3(a)中数据进行线性拟合,得到

其中t的系数即为该温度下反应速率常数k。
pH为11.4时,将不同温度下lnk对1 000T-1进行线性回归分析得到图3(b),对应的方程为:lnk=-3 393.7/T+12.16,R2=0.988 0,其中R2为相关系数。
将k值代入式(7)可计算得到:Ea=28.21 kJ/mol,A=3.18 m3/(kmol·s)。
所以pH为11.4时,乙醛缩合反应的动力学方程为


图3 动力学实验数据(pH=11.4)Fig.3 Kinetic experimental data(pH=11.4)
分析pH值分别为11.0和10.4的动力学实验数据,得到图4,图5以及相应的动力学方程和参数。
其中pH值为11.0时,反应的动力学方程为

则活化能Ea为47.24 kJ/mol。

图4 动力学实验数据(pH=11.0)Fig.4 Kinetic experimental data(pH=11.0)
而pH为10.4时,乙醛缩合反应动力学方程为

其中Ea=130.9 kJ/mol。
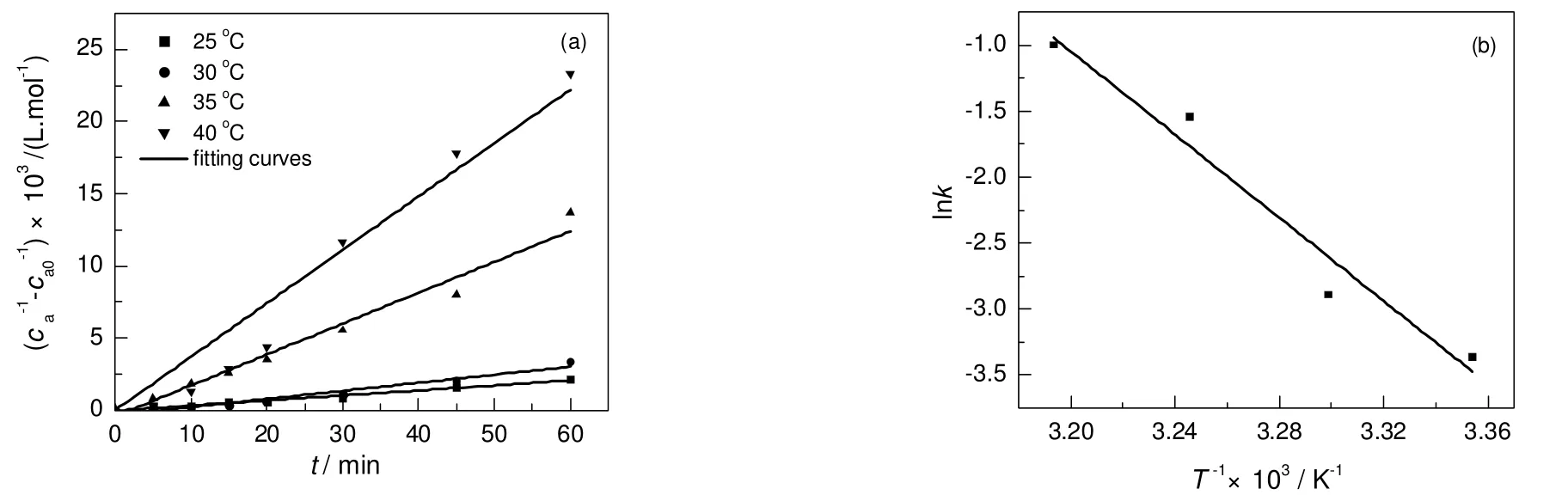
图5 动力学实验数据(pH=10.4)Fig.5Kinetic experimental data(pH=10.4)
对不同pH值下反应活化能进行比较可知,pH值小于11时,活化能较大,反应不易进行,pH值为11~12时,活化能较小,反应更易发生。与pH值控制在11~12时反应转化率和选择性较高结论一致。
3 结论
a)催化剂对乙醛缩合反应过程有较大影响。以强碱为催化剂时,反应剧烈,副产物多且复杂,有机碱和阴离子树脂催化效果差;以Na2CO3作为催化剂时,反应温和,反应前后体系pH值稳定,反应转化率和选择性较好,因此Na2CO3适用于乙醛液相羟醛缩合反应。
b)反应体系pH值和反应温度是影响反应效果的重要因素。pH值控制在11~12对反应比较有利;乙醛缩合反应的主反应为放热反应,转化率随反应温度升高而提高,而选择性随反应温度升高而降低。
c)在不同温度和pH值下进行动力学实验,对实验数据进行分析得到相应的动力学方程和动力学参数。pH值在11~12时,活化能较小,反应更易发生;pH值小于11时,反应活化能迅速增大,反应较难。由实验获得的动力学数据可用于后续的反应精馏过程模拟和实验研究。
[1] Ohtake Y T,Kakogawa H U,Hisaka H K.High-purity 1,3-butylen glycol,process for producing 1,3-butylen glycol,and process for producing by-product butanol and butylacetate:USA,6900360[P].2005-05-31.
[2] Ungureanu A,Royer S,Hoang TV.Aldol condensation of aldehydes over semicrystalline zeolitic-mesoproous UL-ZSM-5[J].Microporous and Mesoproous Material,2005,84(1-3):283-296.
[3] 化学工业出版社《化学百科全书》编辑部.化学百科全书[M].北京:化学工业出版社,1993:647-655.
[4] 王怀利.2-丁烯醛生产工艺改进研究[J].山东化工,2009,38(11):34-36.Wang Huaili.Study on the production of 2-butenal[J].Shandong Chemical Industry,2009,38(11):34-36.
[5] Maude H.Aldehyde Manufacture:USA,1738659[P].1929-12-10.
[6] 周兴佳,殷刚,阚国权.丁烯醛生产方法及装置:中国,1810755[P].2006-08-02.
[7] Anderson J B,Peters M S.Acetaldehyde aldol condensation kinetics[J].Journal of Chemical and Engineering Data,1960,5(3):359-364.
[8] Nozière B,Còrdova A A.Kinetic and mechanistic study of the amino acid catalyzed aldol condensation of acetaldehyde in aqueous and salt solutions[J].Journal of Physical Chemistry A,2008,112(13):2827-2837.
[9] Reymond J L,Chen Y.Catalytic,enantioselective aldol reaction with an artificial aldolase assembled from a primary amine and an antibody[J].Journal of Organic Chemistry,1995,60(21):6970-6979.
[10] Nozière B,CòrdovaA.Novel catalyst for aldol condensation reactions:WO 045156A1[P].2009-04-09.
[11] Baigrie L M,Cox R A,Tilk H S.Acid-catalyzed enolization and aldol condensation of acetaldehyde[J].Journal of American Chemical Soceity,1985,107:3640-3645.
[12] 伍艳辉,梁泽磊,刘剑.乙醛缩合反应体系热力学计算和分析[J].同济大学学报,2011,39(3):456-461.Wu Yanhui,Liang Zelei,Liu Jian.Thermodynamics of aldol condensation of acetaldehyde[J].Journal of Tongji University,2011,39(3):456-461.
