多巴胺受体(DR2)激活对乳鼠心肌细胞缺氧/再灌注损伤的保护作用及其机制*
2013-03-28陈爱东白淑芝李宏霞邵洪江李梅秀徐长庆李鸿珠
魏 璨,高 君,陈爱东,白淑芝,李宏霞,柳 磊,邵洪江,彭 雪,李梅秀,徐长庆△,李鸿珠△
(1.哈尔滨医科大学基础医学院病理生理学教研室,黑龙江哈尔滨150086;2.哈尔滨市第一医院骨一科,黑龙江哈尔滨150010;3.牡丹江医学院红旗医院,黑龙江牡丹江157011)
在原发性心脏病中,缺血性心脏病的发病率居首位,其中50%以上都是由心肌缺血/再灌注损伤(myocardial ischemia/reperfusion injury,MI/RI)所引起[1]。大量的动物实验研究已发现,MI/RI的发生与细胞凋亡密切相关[2],缺血/再灌注后心肌细胞凋亡明显增加,那么减少心肌细胞凋亡,则对减轻心肌损伤具有重要的意义。
多巴胺受体(dopamine receptor,DR)属于七个跨膜区域组成的G蛋白偶联受体家族[3],主要分布在中枢神经系统,在外周主要分布于肾脏、肠系膜、心脏、血管等。当今国内外对于DR的研究多集中在精神分裂症、帕金森病、药物依赖、胃溃疡等,心血管系统主要涉及多巴胺对高血压、充血性心力衰竭等的影响。DR对MI/RI的影响,国内外尚未见报道。我们在前期研究中发现,大鼠离体 MI/RI过程中DR1和DR2的表达是增加的[4],且在模拟的原代培养乳鼠 MI/RI模型中,DR1激动剂(SKF-38393)可上调线粒体和死亡受体途径,促进 MI/RI和细胞凋亡[5]。有报道,多巴胺D2受体激动剂培高利特能减轻脑缺血/再灌注时海马神经元的凋亡[6]。我们采用原代培养乳鼠心肌细胞缺氧/再灌注损伤模型,探讨DR2激动剂是否在MI/RI诱导的细胞凋亡中发挥类似作用,以便为缺血性心脏病的防治提供新思路和新靶点。
1 材料与方法
1.1 实验动物
Wistar乳鼠(2~3 d,雄性,8~15 g),由哈尔滨医科大学实验动物中心提供。
1.2 主要试剂
溴麦角环肽(bromocriptine,Bro)和氟哌啶醇(haloperidol,Hal,Sigma),Western及 IP细胞裂解液(beyotime),DMEM培养液(Hyclone),RT-PCR试剂盒(Promega),LDH、SOD、MDA测定试剂盒(南京建成),Annexin-V凋亡检测试剂盒(北京宝赛)等。
1.3 主要器材
高速低温离心机(Beckman),US-640型紫外分光光度计(Beckman),倒置相差显微镜(Olympus),Western blot电泳槽(美国 BIO-RAD),培养箱 MCO-17AICO2(SANYO),S-1300-U净化工作台,PCR仪PTC-100(美国)等。
1.4 原代心肌细胞培养
用70%的酒精浸泡消毒Wistar乳鼠,开胸取心,D-Hank’s液清洗2次,剪碎放入10 ml离心管中;加入心肌5倍体积的0.25%胰酶,37℃水浴消化12 min,共消化4~5次;除第一次外,每次收集的细胞悬液,放入等体积的高糖DMEM培养液终止消化后,1 500 r/min离心 15 min,弃上清,用含 10%胎牛血清的高糖DMEM培养液将沉淀吹打为单细胞悬液,经200目筛网过滤去除未消化组织块。用差速贴壁分离法去除成纤维细胞,将纯化心肌细胞计数后,以 5×106cells/cm2接种于培养皿中,37℃、5%CO2条件下孵育培养。隔天换液,取第4天的细胞进行实验。
1.5 心肌细胞缺氧/再灌注损伤模型的建立及分组
1.5.1 模型建立 参照文献[7],将高纯度氮气(N2)通入低糖DMEM中饱和30 min,驱除氧气,取生长4 d的单层心肌细胞,换用 N2饱和的低糖DMEM培养液,放入5%CO2的37℃孵箱中培养2 h;再将缺氧后心肌细胞的培养液换为含10%胎牛血清的高糖DMEM培养液培养24 h。
1.5.2 实验分组 培养的乳鼠心肌细胞随机分为4组(n=10):(1)正常对照组(Control):正常细胞培养,不做任何处理;(2)缺氧/再灌注组(H/R):按照上述方法缺氧 2 h,复氧 24 h;(3)激动剂干预组(Bro):同上,在复氧时加入 Bro(10μmol/L);(4)抑制剂干预组(Hal):复氧时加入 Hal(10μmol/L)。
1.6 形态学观察及细胞凋亡检测
1.6.1 倒置显微镜 在倒置显微镜下,肉眼观察不同培养时间、不同因素处理后乳鼠心肌细胞的形态变化。
1.6.2 透射电镜 用0.25%胰酶消化细胞 4 min,PBS洗涤1次,2 000 r/min离心 10 min后弃上清收集细胞;4℃,2.5%戊二醛固定;1%锇酸固定,常规乙醇、丙酮逐级脱水,环氧树脂包埋,超薄切片,铅铀双重染色,透射电镜下观察心肌细胞的超微结构并摄片。
1.6.3 Annexin-V染色检测凋亡率 取各组心肌细胞,0.25%胰酶消化,PBS洗涤2次后调整细胞密度为1×106cells/L,制成单细胞悬液;加入由 100μl Binding Buffer和 FITC标记的 Annexin-V(20μg/ml)10 μl,室温避光 30 min;加入 PI(50μg/ml)5μl,避光 5 min;加入400μl Binding Buffer,立即用流式细胞仪(FACScan)进行定量检测。
1.7 LDH和SOD活力以及 MDA水平的测定
取各组细胞的培养液,用考马斯亮蓝法测定蛋白浓度:标准品为牛血清白蛋白;按试剂盒说明书操作;紫外分光光度计上读出吸光度(OD)值,计算细胞的LDH和SOD活力以及MDA水平。
1.8 RT-PCR检测细胞凋亡相关蛋白的mRNA水平
1.8.1 心肌细胞总RNA提取 用 Trizol法提取心肌细胞总RNA,用A260和A280判断RNA纯度及含量。
1.8.2 DNase I酶处理 RNA RNA 15μl;DNase I 1 μl;10×DNase Ibuffer 5μl;DEPC-H2O29μl;37℃水浴30 min后加入Trizol reagent、氯仿重新提取总RNA。
1.8.3 逆转录(RT) 反应 AMV逆转录酶逆转RNA,合成第一链 cDNA,取 RNA 5μl,Oligo dT 1μl,DEPC-H2O 4.5μl,总体积为 10.5μl。70℃水浴 10 min后置于冰上,放入-20℃冰箱保存。
1.8.4 聚合酶链反应(PCR) 依据文献设计Bcl-2、Fas、Fas-L、caspase-3、caspase-8和 caspase-9的引物(表1)。引物扩增条件:首次循环为94℃3 min;随后进行 30次循环:94℃ 30 s,58℃40 s,72℃ 1 min;进行10次循环后加入β-actin,72℃终延伸5 min。

Tab.1PCR-primer sequences
1.8.5 PCR产物分析 取8μl产物进行1.2%琼脂糖凝胶电泳,在凝胶成像系统下拍照,分别用Bcl-2、Fas、Fas-L、caspase-3、caspase-8、caspase-9与β-actin扩增条带的信号面积之比判断其mRNA水平。
1.9 Western blot检测蛋白表达情况
取各组心肌细胞,PBS洗涤后加入全细胞裂解液,冰浴 10 min,4℃,12 000 r/min离心 15 min,取上清进行蛋白质定量。取50μg蛋白样品于10%SDSPAGE凝胶电泳;随后转印于PVDF滤膜上,用5%脱脂奶粉,37℃封闭1 h;用封闭液稀释一抗,4℃震荡过夜;TBST稀释二抗(1/2 000的羊抗兔IgG二抗,碱性磷酸酶标记),室温振荡孵育2 h;最后显色,凝胶成像系统下拍照,计算条带光密度值,蛋白表达水平以其与β-actin光密度比值来表示。
1.10 统计学分析
实验数据以均值 ±标准差s)表示,采用SPSS10.1软件进行统计分析,采用方差分析及配对t检验判断其差异显著性。
2 结果
2.1 倒置显微镜下细胞形态学变化
正常心肌细胞原代培养4~6 h后开始贴壁生长,由圆形变为梭形或多角形,胞核小,胞浆致密;培养24 h后,细胞呈团簇状并同步节律性收缩。取培养4 d的细胞进行分组实验。正常组细胞继续培养,细胞生长情况良好;H/R组可见心肌细胞皱缩,生长分散,心肌细胞收缩节律不规则,贴壁细胞变圆,部分脱落;加药孵育24 h后,Bro组心肌细胞形态及收缩性等较H/R组有所改善;而 Hal组则变化不显著(图 1)。

Fig.1 Morphological changes of neonatal rat cardiomyocytes by inverted microscope(×100)
2.2 透射电镜下各组心肌细胞超微结构改变
正常组:核膜清楚,线粒体结构完好;H/R组:细胞核固缩,染色质高度凝聚、边缘化,线粒体肿胀和空泡化;Bro组:核膜结构较完好,染色质部分凝聚,少量线粒体空泡化;Hal组:细胞核固缩,染色质凝聚、边缘化,线粒体空泡化(图2)。
2.3 流式细胞仪检测细胞凋亡率
正常组:心肌细胞少量凋亡;H/R组:心肌细胞凋亡率明显增加(P<0.01与对照组比);Bro组:心肌细胞凋亡率明显低于 H/R组(P<0.01);Hal组:心肌细胞凋亡率与H/R组没有显著差异(P>0.05,图 3)。

Fig.2 Ultrastructure of cardiomyocytes by transmission electron microscopy(×10k)

Fig.3 Apoptosis rate of cardiomyocytes by FCM(n=4)
2.4 各组LDH、SOD活性和MDA含量的变化
(1)与正常对照组比较:H/R组 LDH活性、MDA含量明显增加,SOD活性显著降低(P<0.01);(2)与H/R组比较:Bro组LDH活性、MDA含量降低,SOD活性增加(P<0.01);Hal组上述指标变化不明显(P>0.05,表 2)。
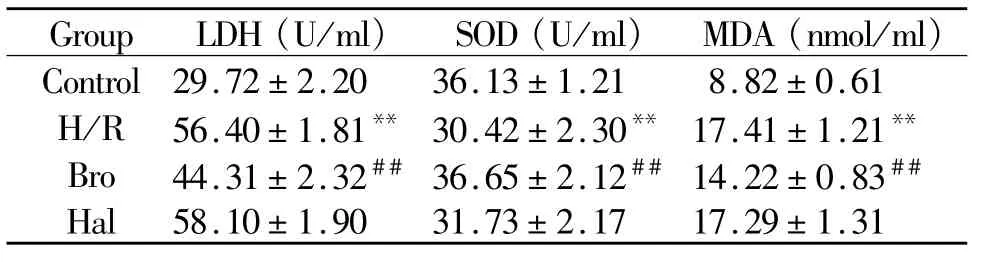
Tab.2 Changes of LDH and SOD activity and MDA content in cell medium(¯x±s,n=10)
2.5 RT-PCR检测各组心肌细胞凋亡相关因子mRNA水平
按 Trizol提取心肌细胞总 RNA,测定 OD260/OD280值为1.84,符合实验标准。RT-PCR的检测结果分别以各凋亡相关因子与β-actin扩增条带的面积比表示:(1)与正常组相比,H/R组所有凋亡相关因子表达均增加(P<0.01);(2)与 H/R组比较,加入Bro后除Bcl-2表达增加(P<0.01),其它因子表达都降低(P<0.05,P<0.01);加入 Hal对上述指标影响不显著(P>0.05,表 3)。
2.6 Western blot检测各组心肌细胞凋亡相关因子蛋白水平
以凋亡相关因子与β-actin蛋白条带面积之比作为观察参数,各组凋亡相关因子的表达规律与上面mRNA的转录规律一致(表4)。
Tab.3 Results analysis of mRNA expression of the factors in cell apoptosiss,n=6)
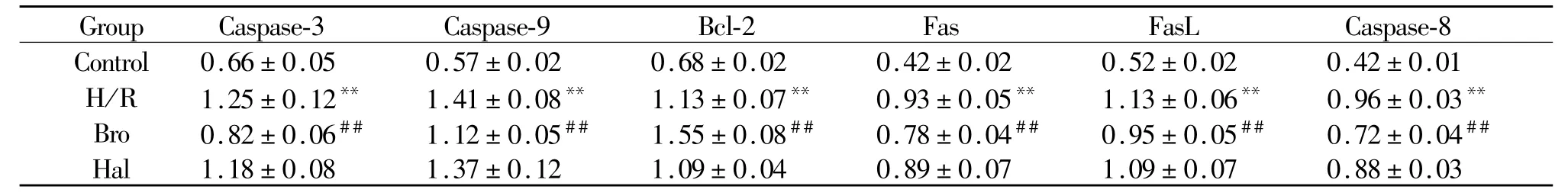
Tab.3 Results analysis of mRNA expression of the factors in cell apoptosiss,n=6)
H/R:Hypoxia/reperfusion;Bro:Dopamine receptor(DR2)agonist;Hal:DR2 antagonist**P<0.01 vs control group;##P<0.01 vs H/R group
?
Tab.4 Results analysis of protein expression of the factors in cell apoptosiss,n=4)
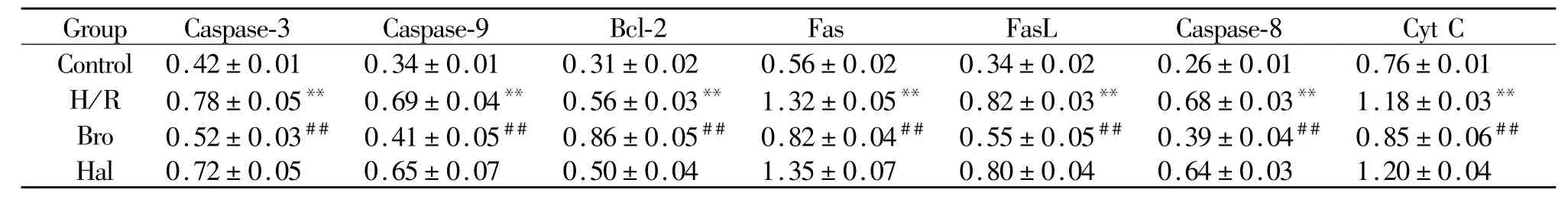
Tab.4 Results analysis of protein expression of the factors in cell apoptosiss,n=4)
Cyt C:Cytochrome C**P<0.01 vs control group;##P<0.01 vs H/R group
?
3 讨论
本实验通过乳鼠心肌细胞缺氧/再灌注模拟MI/RI,采用多种方法检测心肌细胞损伤和凋亡情况,并观察DR2激动剂和抑制剂对心肌细胞缺氧/再灌注所致损伤的作用并探讨其机制。
倒置显微镜和透射电镜观察显示,原代培养的乳鼠心肌细胞在缺氧/再灌注后出现贴壁细胞变圆,部分脱落;细胞核固缩,染色质凝聚,线粒体肿胀和空泡化;同时,细胞培养液LDH活性增强。这些均表明缺氧/再灌注导致心肌细胞发生明显的损伤。
LDH外漏程度可反映细胞受损程度;SOD活性可反映机体清除自由基和抗脂质过氧化的能力;MDA含量可反映氧自由基产生和组织的损伤程度。本研究显示,与正常对照组相比,缺氧/再灌注组培养液中MDA含量明显增加、SOD活性显著降低,表明缺氧/再灌注性心肌损伤与自由基生成增多有关。
大量动物实验和临床研究证明,缺血/再灌注心肌存在细胞凋亡[2]。心肌缺血/再灌注时,钙超载、氧自由基大量产生、ATP耗竭等,可触发细胞凋亡的发生[8]。细胞凋亡的发生可经外部的死亡受体途径及内部的线粒体途径。Caspase-3是细胞凋亡的关键蛋白酶,其活化是凋亡级联反应关键步骤[9]。上述两条途径都是通过激活 caspase-3执行凋亡过程。抗凋亡蛋白Bcl-2可抑制 Cyt C释放和 caspase激活,进而阻断凋亡发生[10]。
Annexin-V是目前检测细胞早期凋亡的灵敏指标之一。本实验的流式细胞仪分析结果显示:缺氧/再灌注后心肌细胞凋亡率约增加3倍。同时,RTPCR和Western blot的检测表明,缺氧/再灌注组Cyt C、caspase-3、caspase-8、caspase-9、Fas和 Fas-L mRNA和蛋白表达均明显增加,这就进一步证实上述结论。至于Bcl-2表达增加,可能是机体的一种代偿性适应性反应。
我们前期研究发现,在 MI/RI过程中 DR1和DR2的表达增加,DR1激动剂可上调线粒体和死亡受体途径,促进 MI/RI和细胞凋亡[4-5]。DR2的活性变化对MI/RI的影响,国内外尚未见报道。
Bromocriptine(Bro)是 DR2的激动剂,Haloperidol(Hal)是DR2的抑制剂。本实验倒置显微镜、透射电镜、流式细胞仪和生化检测结果均显示:Bro可减轻并抑制心肌缺氧/再灌注诱导的心肌细胞损伤和细胞凋亡以及增强机体的抗氧化能力;而Hal则无明显影响。分子生物学检测结果显示,加入Bro可下调促凋亡因子表达而上调抑凋亡因子Bcl-2表达。
综上所述,DR2激活可减轻缺氧/再灌注对心肌细胞的损伤,其机制与清除自由基、减少脂质过氧化和通过Cyt C-caspase-3线粒体途径和Fas/Fas-L死亡受体途径抑制心肌细胞凋亡有关。结合我们的前期实验结果,激活心肌DR2和抑制DR1有望为缺血性心脏病的防治提供一个新思路和新靶点。
[1] 欧阳越,张景红.心肌缺血/再灌注损伤的分子修复机制及其抑制剂的研究进展[J].中国医药科学,2012,2(1):30-34.
[2] Scarabelli TM,Knight R,Stephanou A,et al.Clinical implications of apoptosis in ischemic myocardium[J].Curr Probl Cardiol,2006,31(3):181-264.
[3] Gingrich JA,Caron MG.Recent advances in the molecular biology of dopamine receptors[J].Annu Rev Neurosci,1993,16(6):299-321.
[4] 李鸿珠,徐长庆,韩丽萍,等.大鼠心肌多巴胺受体在缺氧-复氧时表达变化及其意义[J].中国病理生理杂志,2007,23(12):2322-2326.
[5] Li HZ,Han LP,Jiang CM,et al.Effect of dopamine receptor-1 on apoptosis of cultured neonatal rat cardiomyocytes in simulated ischemia/reperfusion[J].Basic Clin Pharmacol Toxicol,2008,102(3):329-336.
[6] 纵艳艳,纵雪梅,许鹏程.多巴胺D1,D2受体激动剂对脑缺血/再灌注损伤的影响[J].生理学报,2003,55(5):565-570.
[7] 钟 理,宋治远.模拟缺血-再灌注诱导原代培养乳鼠窦房结细胞凋亡的研究[J].第三军医大学学报,2001,23(1):59-62.
[8] 陈天平.心肌缺血再灌注损伤与心肌细胞凋亡的研究进展[J].蚌埠医学院学报,2009,34(12):1162-1164.
[9] 厦 天,蒋春笋,李林江,等.呼吸代谢控制在 Caspase-3对线粒体凋亡信号正反馈作用中的机制和意义[J].科学通报,2001,46(21):1791-1796.
[10]李爱英,吉恩生,赵书明.牛磺酸对家兔缺血/再灌注心肌细胞凋亡的影响[J].中国应用生理学杂志,2004,20(3):224-227.
