低温暴露对真皮微血管内皮细胞功能的影响*
2013-03-28曹燕卿杨丹凤张竞丹安玉林刘嘉瀛
曹燕卿,杨丹凤,张竞丹,李 曦,安玉林,刘嘉瀛,汪 海
(军事医学科学院卫生学环境医学研究所,天津300050)
人体只有维持适宜的体温,才能保持正常的生理功能。当机体温度降低时,机体不可避免地出现各种变化,对机体的器官、组织和细胞的功能产生较大影响。如果冷环境的作用强度超出人体体温的调控能力,将引起人体局部或全身的温度改变,甚至造成全身或局部的冷损伤[1,2]。以往通过动物冻伤模型和主动脉血管内皮细胞冷冻暴露模型研究发现,血管内皮细胞是冷诱导冻伤发生的重要靶点和始动因素[3,4],但是不同低温暴露常可导致皮肤出现不同的病理变化[2],而关于不同低温暴露致皮肤血管内皮损伤机制的研究鲜有报道,因此本研究拟通过体外建立大鼠真皮微血管内皮细胞(dermal microvasvcular endothelial cells,DMVECs)低温暴露模型,进一步探讨冷诱导皮肤病变的相关机制,为冷损伤预防及冷习服机制研究提供理论依据。
1 材料与方法
1.1 实验材料
SPF级Wistar大鼠乳鼠(军事医学科学院动物中心),MCDB131培养基、II型中性蛋白酶(美国sigma公司),I型胶原酶、Trizol试剂(美国 Gibco公司),Percoll溶液(美国 Pharmacia公司),胎牛血清(美国Hyclone公司),ECGS(美国 Upstate公司),真皮微血管内皮细胞鉴定试剂盒(武汉Pricell公司),乳酸脱氢酶检测试剂盒(南京建成),PCR引物(上海invitrogen公司),PCR相关试剂(北京TIANGEN公司)。
1.2 主要仪器
常温及低温细胞培养箱(美国Thermo公司),低温细胞培养箱为本室设计(通5%CO2,21%O2,74%N2),酶标仪(瑞士 Tecan公司),PCR仪、紫外凝胶成像系统(美国Bio-Red公司),DNA电泳设备(北京六一仪器厂)。
1.3 大鼠真皮微血管内皮细胞的培养与鉴定[5]
取新生乳鼠断椎处死后于无菌条件下剪取背皮,放入含双抗的PBS溶液中浸泡10 min,使用眼科弯镊刮除皮下脂肪层后剪成2 cm×3 cm皮片,将表皮面朝下浸于2.5 mg/ml II型中性蛋白酶溶液中4℃消化过夜,撕除表皮,将真皮片剪碎放入4 mg/ml I型胶原酶溶液中37℃震荡消化45 min,待消化完全过100目细胞筛,1 500 r/min离心10 min,洗涤细胞沉淀2次后将细胞浓度调至2×106cells/ml。制备不连续密度梯度Percoll分离液,将上述细胞混悬液加入Percoll分离液上方,2 000 r/min离心20 min,吸取20%与30%交界处的细胞移至MCDB131培养基(含 15%胎牛血清,15μg/ml ECGS,1μg/ml氢化可的松)中,放入5%CO2,37℃细胞培养箱中培养,通过形态学观察及真皮微血管内皮细胞鉴定试剂盒进行细胞鉴定。
1.4 低温暴露模型构建及分组
选取2~3代细胞进行实验,分别在37℃、28℃、12℃及0℃条件下,同步建立不同低温温度暴露模型,并以37℃组为对照,暴露时间均为24 h。
1.5 细胞形态学观察
取2~3代生长良好的DMVECs细胞,以1×106cells/ml接种于六孔培养板中,不同温度暴露24 h后取出,置倒置显微镜下观察细胞形态学变化情况,拍照记录。
1.6 细胞培养液中LDH活性测定
取2~3代生长良好的DMVECs,以1×106cells/ml接种至六孔板中,每组设3个复孔。不同低温条件下分别培养24 h后,收集各孔细胞培养上清液,依照LDH试剂盒说明书立即测定各孔培养液中LDH活性。
1.7 RT-PCR测定VEGF表达
取2~3代生长良好的DMVECs,以1×106cells/ml接种至六孔板中,每组六孔。每2个孔提取一个mRNA样本。总RNA的提取严格按Trizol试剂说明书操作,紫外分光光度计测定其纯度并定量。使用TIANScript RT Kit完成各组cDNA的合成。PCR反应体系为:2μl cDNA,2μl引物,6μl ddH2O,10μl 2×PCR Reagent。VEGF上游引物 5’-CAGGGAAGACAATGGGATGA-3’, 下 游 引 物 5’-AGGAAGTGGGGTAGGGAGAG-3’,产物大小为 470 bp;βactin引物上游 5’-CAGGTCATCACTATCGGCAA-3’,下游引物 5’-AAGAAAGGGTGTAAAACGCA-3’,产物大小为430 bp。以上引物均由Invitrogen公司合成。反应条件:采用降落 PCR法:(1)94℃5 min;(2)94℃30 s,60℃40 s,每循环降低 0.2℃,72℃延伸 50 s,30个循环;(3)72℃10 min。将扩增的PCR产物进行2%琼脂糖电泳。采用凝胶成像系统灰度扫描检验各个条带的积分吸光度值,以VEGF和β-actin灰度的比值做半定量分析。
1.8 统计学处理
实验数据以平均数±标准差(¯x±s)表示,采用SPSS19.0软件进行统计学处理,两组间比较采用 t检验,多组间比较采用单因素方差分析。
2 结果
2.1 大鼠DMVECs的鉴定
培养第5天,细胞融合至90%~95%,呈现典型的“鹅卵石样”结构(图1A),于第三代时采用 FITC标记的血小板内皮细胞粘附因子-1(platelet/endothelial cell adhesion molecule-1,PECAM-1/CD31)进行细胞免疫荧光染色鉴定细胞,发出绿光的即为微血管内皮细胞,结果表明细胞呈阳性(图1B)。
2.2 不同温度暴露对大鼠DMVECs形态的影响
经不同温度暴露24 h后,与37℃组(图2A)比较,28℃组(图 2B)及 12℃组(图 2C)细胞形态由“铺路石样”变为“成纤维细胞样”,细胞间未出现明显间隙,0℃组细胞则出现明显的皱缩(图2D)。提示低温能够引起DMVECs细胞形态改变,0℃则对其形态造成了直接破坏。

Fig.1 Rat dermal microvascular endothelial cells culture
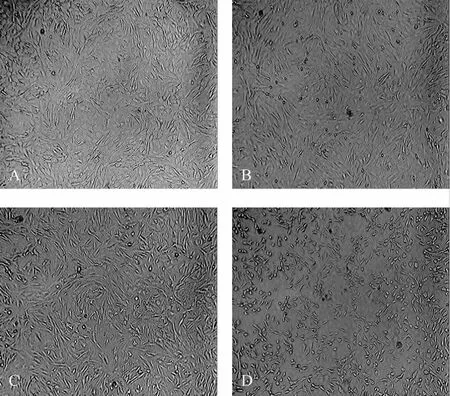
Fig.2 Change of cell morphology with different temperatures in rat dermal microvascular endothelial cells
2.3 不同温度暴露对大鼠DMVECs细胞膜完整性的影响
不同温度暴露24 h后,28℃、12℃及0℃组细胞培养液中 LDH活性(U/L)分别为 54.17±3.02,64.66±3.03,82.13±10.91,较 37℃组(12.23±3.03)显著提高(P<0.01,图 3),12℃组及 0℃组较28℃组 LDH活性增强(P<0.05),但 0℃组与 12℃组比较无明显差异。
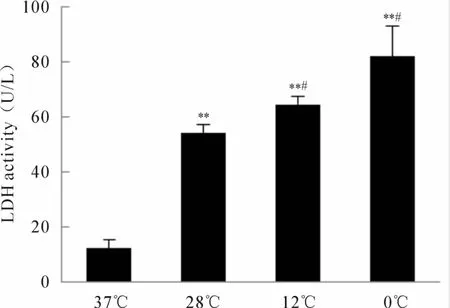
Fig.3 LDH leakage from rat dermal microvascular endothelial cells under the different temperatures(¯x±s,n=3)
2.4 不同温度暴露对大鼠DMVECs的VEGF表达影响
与37℃比较,28℃及 12℃暴露 24 h后可使DMVECs VEGF mRNA表达上调,37℃组VEGFmRNA的相对表达量为 0.64±0.01,28℃组、12℃组的相对表达量分别为 0.86±0.04和 1.04±0.04,差异具有统计学意义(P<0.05),而0℃组的相对表达量为0.64±0.01,与 37℃组比较无统计学差异(图 4)。

Fig.4 Effects of different temperatures on expression of VEGF mRNA in DMVECs(¯x±s,n=3)
3 讨论
大量的实验证明,皮下血管内皮细胞是机体冷应激反应最先做出应答的部位,同时是冷致皮肤病变过程中的主要靶点[3]。冷应激初期,其可通过合成释放血管舒张因子(如一氧化氮)与局部交感神经共同调控皮下血管的收缩与舒张[1],从而保证核心体温维持在37℃,减少体内能量散失,而长时间的低温暴露则可直接造成其功能紊乱,如一氧化氮(NO)合成减少、内皮素-1(ET-1)及其受体 ETA表达增高[1],免疫粘附分子表达增多,致使皮下血管持续收缩、血流淤滞、血管阻塞、免疫细胞沉积,引发局部微循环障碍[4],最终导致皮肤病变的发生。另外,不同低温持续暴露可使皮肤出现不同的改变[2],当皮肤温度降至29℃时,机体即可感到不适;降至28℃以下时,人体感觉到寒冷;降至17℃以下时,机体出现疼痛感,此时可发生冻疮;当温度降至12℃以下时,麻木感出现并可导致浸渍足或战壕足的发生;而在8℃以下则彻底失去痛觉感受,至0℃即刻,皮下微血管系统即可出现明显的形态学改变与亚细胞结构改变,至-2℃以下,皮肤及皮下血管即可发生冻结并出现变性,导致冻伤的发生。以上现象提示不同温度持续暴露致皮肤病变的机制可能存在差异。但以往关于冷致皮下血管内皮细胞病变的机制研究多采用动物模型在0℃以下进行[6],在细胞水平上对其机制进行阐明的报道较少[4],因此,将真皮微血管内皮细胞暴露于不同低温温度一定时间后对其相关性质的改变进行比较,能够更好的揭示不同低温暴露诱导皮肤病变的机制。
我们的研究结果显示,0℃作用24 h后,微血管内皮细胞呈明显的皱缩形态,其胞外LDH活力较37℃组升高近7倍,但其VEGF表达与37℃组没有差异;而28℃及12℃组细胞虽形态变为“成纤维状”,但未出现明显皱缩,其胞外LDH活力提高的同时胞内VEGF mRNA表达也较37℃及0℃组出现上调。通常,细胞形态可间接反映细胞骨架完整性,LDH常用作反映细胞膜完整性及通透性。对血管内皮生长因子(vascular endothelial growth factor,VEGF)的研究显示,其作为血管内皮细胞重要的内源性细胞因子,其表达上调将有益于细胞增殖、细胞存活[7]、细胞骨架维持及血管新生等过程,但同时可造成血管内皮细胞通透性提高[8],另外,研究发现低温暴露可引起心肌细胞VEGF表达上调[9],刺激棕色脂肪组织 VEGF表达,增强机体冷习服能力[10]。结合本实验结果,提示28℃及12℃暴露过程中微血管内皮细胞VEGF的表达上调可能对细胞骨架的维持起保护作用,抑制细胞形态趋向皱缩,但同时又不可避免的增强了细胞膜通透性,导致LDH外漏增多;而0℃组细胞形态皱缩明显,其 VEGF表达与37℃组比较却没有差异,提示0℃能够直接对内皮细胞骨架造成破坏,致使胞膜完整性丧失,导致LDH漏出程度严重。
综上,我们推测,0℃组可能通过直接破坏真皮微血管内皮细胞骨架及膜完整性,导致皮肤冻伤的发生,这与文献报道[4]一致;而皮下温度降至12℃左右时,机体皮肤表现出的发红水肿,则可能是皮肤微血管内皮细胞在冷刺激下代偿性增强VEGF表达的结果,其在维持内皮细胞形态,保证血管完整性的同时,提高血管内皮通透性。说明,机体长期暴露于正常皮温(<33℃)以下的温度导致的皮肤病理变化机制与0℃诱发冻伤的机制存在明显不同,但皮肤微血管内皮细胞在低温时如何调控其VEGF表达,尚不明确,通过阐明这一机制,将为我们预防和治疗非冻结温度导致的皮肤病变,加快和增强机体冷习服能力奠定基础。
[1] Sun Z.Cardiovascular responses to cold exposure[J].Front Biosci(Elite Ed),2010,2:495-503.
[2] Lehmuskallio E,Hassi J,Kettunen P.The skin in the cold[J].Int J Circumpolar Health,2002,61(3):277-286.
[3] Long CL,Liu JY,Yin ZY,et al.The key rolls of vascular endothelia dysfunction in injuries induced by extreme environment factors at high altitude[J].Science,2012(suppl):442-444.
[4] 刘嘉瀛,单秋玲,杨增仁,等.细胞间粘附分子-1在血管内皮细胞冻融损伤中的作用[J].中国应用生理学杂志,2006,22(2):153-157.
[5] Cha ST,Talavera D,Demir E,et al.A method of isolation and culture of microvascular endothelial cells from mouse skin[J].Microvasc Res,2005,70(3):198-204.
[6] Goertz O,Baerreiter S,Ring A,et al.Determination of microcirculatory changes and angiogenesis in a model of frostbite injury in vivo[J].J Surg Res,2011,168(1):155-161.
[7] 洪炳哲,王丽萍,李胜范,等.VEGF165对血管内皮细胞内Mg2+浓度调节机制的研究[J].中国应用生理学杂志,2009,25(1):86-90.
[8] Gavard J,Gutkind JS.VEGFcontrols endothelial-cell permeability by promoting the beta-arrestin-dependent endocytosis of VE-cadherin[J].Nat cell Biol,2006,8(11):1223-1234.
[9] Kim JC,Yi HK,Hwang PH,et al.Effects of cold-water immersion on VEGF mRNA and protein expression in heart and skeletal muscles of rats[J].Acta Physiol Scand,2005,183(4):389-397.
[10] Xue Y,Petrovic N,Cao R,et al.Hypoxia-independent angiogenesis in adipose tissues during cold acclimation[J].Cell Metab,2009,9(1):99-109.
