硫酸酯化川芎粗多糖的半合成及其抗氧化活性*
2013-03-26郭晓强孙晓春苟小军
郭晓强,颜 军,何 钢,孙晓春,姚 倩,苟小军
(1.成都大学a.生物产业学院;b.药食同源植物资源开发四川省高校重点实验室,四川成都 610106)
中药川芎为伞形科植物川芎的干燥根茎,始载于《神农本草经》。川芎味辛、性温,具有活血止痛、行气开郁、祛风燥湿之功效。早期从国产川芎分离出易挥发的油状生物碱、阿魏酸、酚性物质和挥发油等[1];范志超等[2]报道川芎粗多糖分离的四种均一多糖组分;本课题组[3]也采用DEAE-纤维素柱层析分离得到3个川芎多糖组分。但到目前为止,仅有原江锋等[4]对川芎粗多糖抗氧化活性进行了研究。
多糖中取代基的改造己成为研究多糖构效关系的有力手段,可以通过降解、羧甲基化、硫酸酯化、乙酰化、烷基化、磷酸酯化等改造多糖取代基的方法有目的地得到高生物活性的多糖或寡糖片段。目前,国内外还未见关于川芎多糖化学修饰的报道。
本文以水提醇沉法提取川芎粗多糖[主要由甘露糖、鼠李糖、葡萄糖、半乳糖、阿拉伯糖等吡喃型糖组成[2,3],用 D-OH(1)表示]。首次报道了 1与氯磺酸-吡啶经亲核取代反应半合成硫酸酯化川芎粗多糖(2,Scheme 1)的方法,其结构经UV和IR表征。对制备工艺进行了优化。用氯化钡-明胶比浊法测定2的取代度,并考察了1和2对邻苯三酚自氧化反应产生的超氧阴离子(O-·2)和1,1-二苯基-2-苦基肼(DPPH)的体外清除自由基能力。比较了化学修饰前后川芎粗多糖体外抗氧化活性的变化,以此来研究硫酸酯基团的引入对川芎粗多糖抗氧化活性的影响,为川芎多糖构效关系研究提供基础。
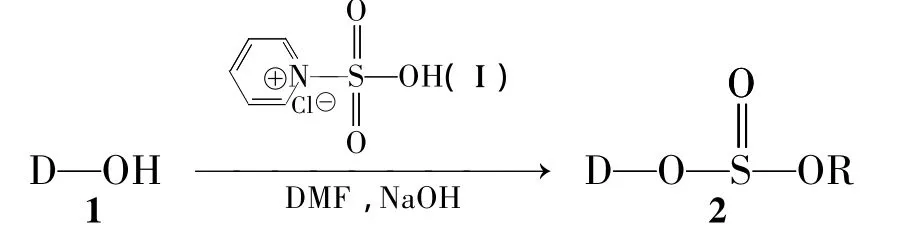
Scheme 1
1 实验部分
1.1 仪器与试剂
UV-2802PC型紫外扫描仪;UV-1800型紫外分光光度计;Spectrum Two型红外光谱仪(KBr压片)。
川芎,成都市中药材市场,经成都大学生物产业学院陈封政教授鉴定;1按文献[3]方法提取,Sevage试剂除蛋白,提取率5.7%;DPPH,百灵威科技公司;其余所用试剂均为化学或分析纯。
1.2 合成[5,6]
在三颈烧瓶中加入吡啶20 mL,冰盐浴冷却,搅拌下于缓慢滴加氯磺酸5 mL{y[V(吡啶)∶V(氯磺酸)=3}(控制滴加速度使温度保持在室温以下),滴毕,反应至终点得淡黄色固体磺酰化试剂(Ⅰ)。加入1 0.25 g的DMF(25 mL)悬浮液,于60℃反应3 h。冷至室温,用5 mol·L-1氢氧化钠溶液调至pH 7。加入乙醇至终浓度80%,析出沉淀,离心,沉淀用水溶解,置自来水中透析48 h;蒸馏水中透析24 h。真空冷冻干燥得白色固体210.22 g,收率88%;UV:λmax:215,260 nm;IR ν:3 431(O -H),2 927(C -H),1 737,1 637(C=O),1 407(C -H),1257(S=O),1 025(C-O-C),814(C-O-S)cm-1。
改变y,反应温度和反应时间,用类似方法合成2n(表1)。
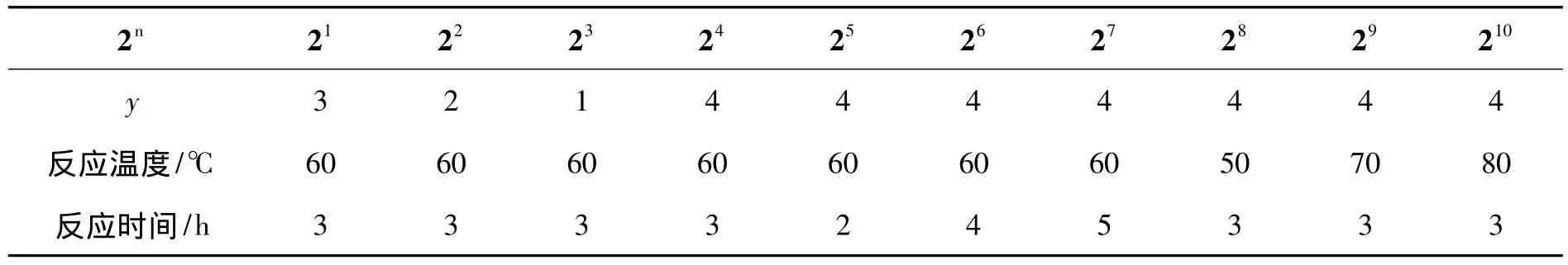
表1 2的制备条件Table 1 Preparation condition of 2
1.3 取代度的测定
以硫酸钾为标准品,按文献[7~9]方法绘制氯化钡-明胶标准曲线。
将样品40 mg溶于1 mol·L-1盐酸(2 mL)中,封管,置100℃沸水浴中1 h。取0.2 mL进行分析。根据测定的样品吸光度从标准曲线中得到试样中的百分含量,计算取代度(DS)[DS=1.62×S%/(32-1.02×S%),S%为样品中硫元素的百分含量]。
1.4 清除率测定
在样品溶液(c=3.0 mg·mL-1)0.1 mL 中加入 50 mmol·L-1Tris-HCl(pH 8.2)缓冲溶液(5 mL)中,于 25℃水浴中搅拌 10 min;加入 6 mmol·L-1邻苯三酚 0.2 mL,摇匀;每隔 30 s 取样,于4 min内在325 nm处测定吸光值(A)。以0.1 mL蒸馏水代替样品溶液,0.2 mL蒸馏水代替邻苯三酚作参比液,0.1 mL蒸馏水代替样品溶液作空白溶液;Vc作阳性对照,绘制A对时间的曲线,曲线斜率即为自氧化速率(K),对的清除率按下式计算:

(2)清除DPPH自由基清除率测定[10]
在样品溶液(c=3.0 mg·mL-1)1 mL 中加入0.6 mmol·L-1DPPH 溶液 2 mL和 95%乙醇 2 mL,搅拌均匀后 避光反应30 min,于517 nm处测定吸光值(A1)。另取1 mL蒸馏水代替样品溶液作对照,测定吸光度值(A0);1 mL蒸馏水代替样品溶液,2 mL 95%乙醇代替DPPH溶液作参比,测定吸光度值(A2)(以Vc为阳性对照),按下式计算清除率(DPPH)。

2 结果与讨论
2.1 制备2的条件优化
(1)y[V(吡啶)∶V(氯磺酸)]
以DS为考察标准,对合成2的反应条件进行优化。
于60℃反应3 h,其余反应条件同1.2,考察y对反应的影响,结果见表2。由表2可知,2的DS的大小并非严格遵循y提高而增加。当y=4,DS达最大值(0.958 9)。在硫酸酯化反应过程中吡啶作为缚酸剂中和反应副产物氯化氢,以促进反应平衡向酯化产物的生成方向。另外吡啶还起到催化反应的作用,吡啶首先与酯化试剂生成活性中间体,再与多糖分子上的醇羟基生成酯[11]。在实验条件下,最佳y=4。

表2 y对反应的影响*Table 2 Effect of y on reaction
(2)反应时间
y=4,其余反应条件同1.2,考察时间对反应的影响,结果见表3。由表3可见,反应3 h时,DS达最大值(0.958 9)。随着反应时间的进一步延长,DS反而有所下降。这可能是2在酸性条件下降解所致。最佳反应时间为3 h。

表3 反应时间对反应的影响*Table 3 Effect of time on reaction
(3)反应温度
y=4,反应时间 3 h,其余反应条件同 1.2,考察温度对反应的影响,结果见表4。从表4可见,于50℃ ~70℃间反应,产物的DS逐渐增大。当温度为70℃时,DS达最大值(1.761 6)。可能是在一定的温度范围内提高反应温度有利于加快反应速率,但反应温度过高时,可能会导致多糖的降解。最佳反应温度为70℃。

表4 反应温度对反应的影响*Table 4 Effect of temperature on reaction
综上所述,制备2的最佳反应条件为:V(吡啶)∶V(氯磺酸)=4,于70℃反应3 h。
2.2 活性研究
以水为溶剂,将1和 2配成c=3.0 mg·mL-1,测定其对的清除率,结果见表5。从表5可见,阳性对照Vc的清除率为91.55%。1和2与Vc相比,对的清除率极低,同时川芎粗多糖硫酸酯化前后对的清除作用无明显差异。
(2)对DPPH自由基的清除率
以水为溶剂,将1和2配成c=3 mg·mL-1,c(Vc)=0.05 mg·mL-1,其对 DPPH 自由基的清除率见表5。从表5可见,1和21,24,26~29对DPPH自由基有一定的清除作用,但效果都远远低于阳性对照Vc。1的清除率大于21~28,说明经硫酸酯化修饰的川芎粗多糖其活性并非一定会提高。
从表5可见,29的DS最大(1.761 6),其清除率也最高,但不能说明取代度与清除率之间呈正相关关系。
表5 1和2对和DPPH的清除率*Table 5 Clearance rate of 1 and 2 to and DPPH
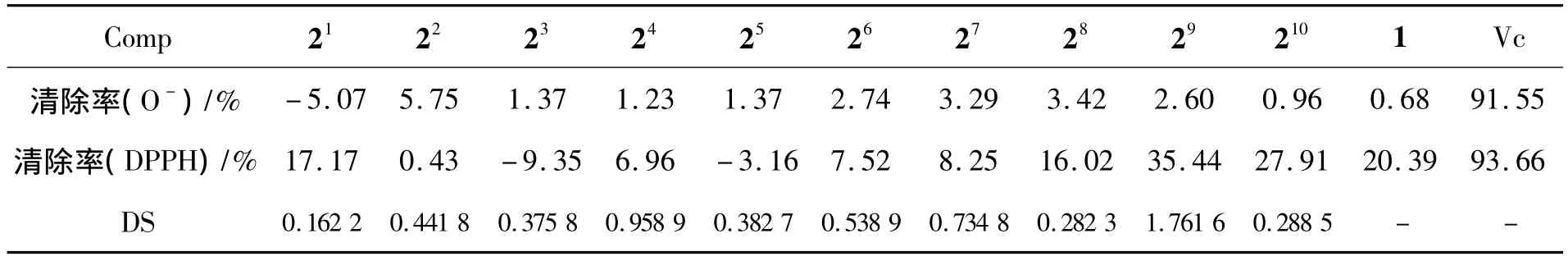
表5 1和2对和DPPH的清除率*Table 5 Clearance rate of 1 and 2 to and DPPH
*1和2 的 c为3.0 mg·mL-1
96 0.68 91.55清除率(DPPH)/% 17.17 0.43 -9.35 6.96 -3.16 7.52 8.25 16.02 35.44 27.91 20.39 93.66 DS 0.162 2 0.441 8 0.375 8 0.958 9 0.382 7 0.538 9 0.7 Vc清除率(O-)/% -5.07 5.75 1.37 1.23 1.37 2.74 3.29 3.42 2.60 0.Comp 21 22 23 24 25 26 27 28 29 210 1 34 8 0.282 3 1.761 6 0.288 5 - -
3 结论
吡喃型糖通常以氯磺酸-吡啶法进行硫酸酯化修饰[12]。本文采用氯磺酸-吡啶法制备硫酸酯化川芎多糖,并以取代度为考察指标,通过单因素实验优化酯化反应条件为吡啶与氯磺酸体积比为4∶1,反应时间为3 h,反应温度为70℃。
多糖分子通过引入硫酸酯基团所引起的多糖立体结构和理化性质的变化是引起硫酸酯化多糖生物活性变化的重要原因。相对于本文所采用的川芎粗多糖及其硫酸酯化产物而言,川芎粗多糖经过分离纯化操作所获得的单一川芎多糖组分及其硫酸酯化川芎多糖的相关研究还有待进一步探讨。
[1]李秋怡,干国平,刘焱文.川芎的化学成分及药理研究进展[J].时珍国医国药,2006,17(7):1298 -1299.
[2]范智超,张志琪.川芎中多糖的研究[J].中草药,2006,37(7):973 -976.
[3]孙晓春,颜军,何钢,等.川芎多糖的分离纯化及其单糖组成测定[J].四川农业大学学报,2011,29(1):56-60.
[4]原江锋,王大红.川芎粗多糖抗氧化和细胞毒活性研究[J].天然产物研究与开发,2012,24(7):877 -881.
[5]王顺春,方积年.香菇多糖硫酸化衍生物的制备及其结构分析[J].生物化学与生物物理学报,1999,31(5):594-597.
[6]Lu Y,Wang D Y,Hu Y L,et al.Sulfated modification of epimedium polysaccharide and effects of the modifiers on cellular infectivity of IBDV[J].Carbohydr Polymers,2008,71(2):180 -186.
[7]丛建波,王长振,李妍,等.褐藻硫酸多糖硫酸基含量测定-硫酸钡比浊法研究[J].解放军药学学报,2003,19(3):182 -183.
[8]谢佳,张静,柳红.南瓜多糖硫酸酯化衍生物的制备及抗氧化研究[J].食品工业科技,2008,29(9):60-62.
[9]张惟杰.糖复合物生化研究技术(第二版)[M].杭州:浙江大学出版社,2006.
[10]李燕凌,张志旭,胡令.茯苓多糖抗氧化性研究[J].天然产物研究与开发,2012,24(8):1126 -1128.
[11]闻韧.药物合成反应[M].北京:化学工业出版社,2004.
[12]李玉华,王凤山,贺艳丽.多糖化学修饰方法研究概况[J].中国生化药物杂志,2007,28(1):62-65.
