氟碳杂化表面活性剂的研究进展*
2013-03-26刘刚芝冯浦涌荣新明费晨洪王碧清王继宇冯玉军
刘刚芝,冯浦涌,荣新明,费晨洪,王碧清,王继宇,冯玉军
(1.中海油田服务有限公司油田生产事业部,天津 300450;2.中国科学院成都有机化学研究所,四川成都 610041;3.中国科学院大学,北京 100049)
表面活性剂是由亲水的极性头基和疏水的碳氢尾链通过共价键结合而成的两亲分子,能在水相表面或水—油界面铺展而降低表面或界面张力。由于具有特特殊的乳化和起泡性能,广泛应用于洗涤、印染、皮革加工、造纸、油漆、涂料、采矿、选矿和油气开采等诸多领域[1,2],因此被称为“工业味精”[3]。
通常,表面活性剂分子的疏水尾基多为碳氢链。若将这些碳氢链全部或部分以氟碳链键取代,则成为氟碳表面活性剂。氟原子电负性为4.0,是所有元素中电负性最强的原子,原子极化率低导致氟碳化合物的表面能降低,因此氟碳表面活性剂具有很高的表面活性。例如,0.1%(w/w,下同)的碳氢表面活性剂可使水溶液的表面张力由72 mN·m-1降低至30 mN·m-1,而同等条件下用量仅为0.01%的氟碳表面活性剂即可使水溶液的表面张力降低至20 mN·m-1左右[4]。
氟碳链不仅疏水,而且疏油,在有机溶剂中也具有良好的表面活性。与C-H键相比,C-F键能更大(484 kJ·mol-1),键长更短,氟原子在碳原子外围形成一层负电性的保护层,使得较弱的CC键不易受到进攻,因此氟碳表面活性剂可以抵抗强酸、强碱、强氧化剂,也可以在在较高的温度下长时间使用。因此氟碳表面活性剂具有高表面活性、高热稳定性、高化学稳定性、既憎水又憎油的“三高两憎”[5,6]的独特性质,已在化工、机械、纺织、消防、石油开采等领域得到了成功的应用[7,8]。
较之于传统的碳氢表面活性剂,氟碳表面活性剂价格昂贵,所以一般将其与碳氢表面活性剂复配使用[9,10]。复配体系虽也具有较高的表面活性,但由于氟碳链和碳氢链之间的不相容性,会分别形成氟碳表面活性剂富集的胶束和碳氢表面活性剂富集的胶束,不利于氟碳表面活性剂性能的发挥[11,12]。为了解决复配体系的分相问题以及达到成本与性能之间的平衡,Guo等[13,14]于1992年合成了一类在同一分子中既含有氟碳链也含有碳氢链的杂化表面活性剂1[CmF2m+1CH(SO3Na)(CnH2n+1),Chart 1],即氟碳—碳氢杂化表面活性剂,从而开辟了含氟表面活性剂的新领域。

Chart 1
本文将从合成路线、溶液性质、潜在应用等方面介绍氟碳杂化表面活性剂的研究进展。
1 氟碳杂化表面活性剂的类型及合成
从分子拓扑结构上看,氟碳杂化表面活性剂可以分为单头双尾型(图1a和图1b)、双头双尾(双子)型(图1c和图1d)和Bola型(图1e)。历经20余年的发展,氟碳杂化表面活性剂的种类已十分丰富,下面就几种典型氟碳杂化表面活性剂合成路线作简要介绍。
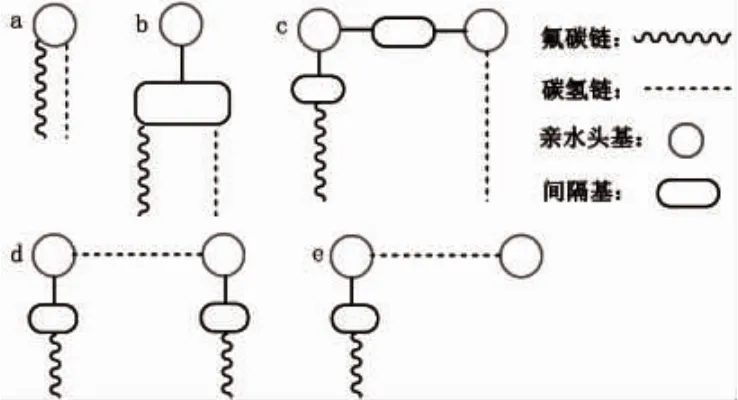
图1 氟碳杂化表面活性剂的类型Figure 1 Type of fluorocarbon-hydrocarbon hybrid surfactant
1.1 单头双链型氟碳杂化表面活性剂的合成
Guo 等[13,14]以全氟庚酸为原料,与格氏试剂C7H15MgBr反应分别引入氟碳链和碳氢链,再用NaBH4将羰基还原为羟基,然后与SO3·HCl反应,成功地合成了氟碳—碳氢杂化表面活性剂1a(Scheme 1)。但在这类表面活性剂中,氟碳链和亲水的极性基团连接到了同一个碳原子上,十分容易水解,所以必须在低温、干燥的环境中保存,并且合成后尽快使用。
为克服这些缺陷,Abe小组[15]通过碘苯对位的酰基化引入碳链,再通过Cu催化偶联反应在苯环上引入氟碳链,并在羰基的α-位与SO3反应引入磺酸基团。由此在氟碳链和亲水头基之间引入苯环作为间隔基团,合成了以磺酸基作为亲水头基的一系列氟碳—碳氢杂化表面活性剂2[CmF2m+1ΦCOCH(SO3Na)(CnH2n+1),Scheme 2],成功地抑制了其水解。
Yishino 等[19]在文献[15]方法的基础上引入氟碳链和碳氢链之后,直接用NaBH4还原羰基得到3[CmF2m+1ΦCH(OH)(CnH2n+1)]。以3为中间体合成了阴离子型氟碳杂化表面活性剂4[CmF2m+1ΦCH(OSO3Na)(CnH2n+1)][16]和 5{CmF2m+1ΦCH[OP(ONa)(OC6H5)](CnH2n+1)}[17,18],以及非离子型氟碳杂化表面活性剂6{CmF2m+1ΦCH[O(C2H4O)pH](CnH2n+1)][19](Scheme 3)。
上述以苯环作为间隔基团的合成氟碳杂化表面活性剂的策略虽然可行,但其合成步骤多数在4~5步以上,产率也仅30%左右[12]。而氟碳原料本身价格昂贵,提高产率显得优为重要。Yishino等[20]以碘代氟烷 CmF2m+1C2H4I制备格氏试剂,与长链醛反应即可同时将氟碳链和碳氢链引入,再通过羟基与SO3反应引入头基,制得以乙基作为间隔基团的氟碳杂化表面活性剂7[CmF2m+1C2H4CH(OSO3Na)(CnH2n+1)](Scheme 4),避免了在苯环上取代、偶联以及对羰基的还原反应,简化了合成步骤,产率达70%,远高于以苯环作为间隔基的表面活性剂产率(30%)。
1.2 双子型氟碳杂化表面活性剂的合成
双子型表面活性剂由于其特殊的结构,与普通的表面活性剂相比具有易于在界面吸附、易形成胶团、临界胶束浓度(cmc)低等优势,但其表面张力仍低于氟碳表面活性剂。为了降低氟碳表面活性剂的成本和提高其表面活性,Oda 等[23,28〛]率先合成了季铵盐型双子氟碳—碳氢杂化表面活性剂8[FCmC4-2-(n+4)](Scheme 5)。他们以全氟碘代烷为起始原料,通过铜催化其与3-乙烯丁醇加成再以三丁基锡化氢还原、卤代和季铵化制得8。
但上述制备过程中需要使用昂贵的三丁基锡化氢作为还原剂,且溴代反应操作困难、季铵化反应需回流3 d~4 d,总产率仅30%。为简化反应步骤、缩短反应时间和提高收率,本研究小组[29]通过全氟碘代烷与1-丁烯酸的偶联,经氢化锂铝还原脱氢、羟基保护、氨基取代、季铵化得到目标产物9(Scheme 6),既避免了三丁基锡化氢的使用,纯化方便,还将总收率提高到50%左右,有效地解决了文献[23,28]方法中所遇到的问题。
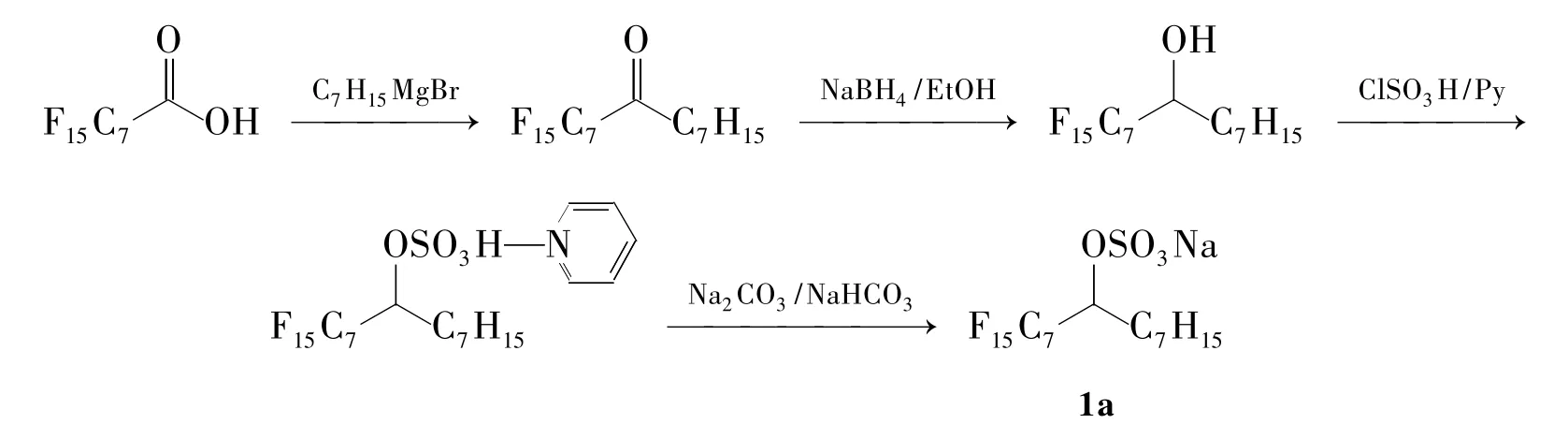
Scheme 1

Scheme 2

Scheme 3
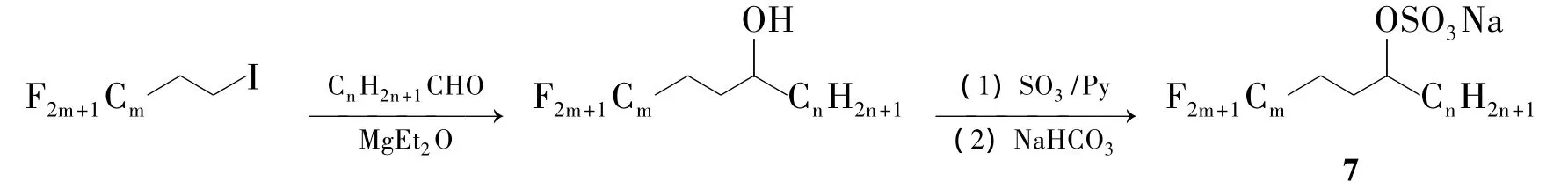
Scheme 4

Scheme 5

Scheme 6
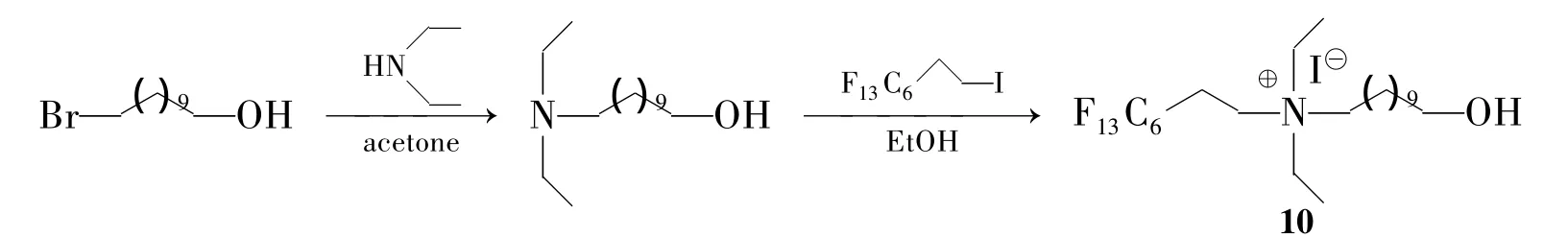
Scheme 7
1.3 Bolaform型氟碳杂化表面活性剂的合成
Aydogan等[26]设计合成了一种具有特殊不对称结构的Bolaform型氟碳杂化表面活性剂OH(CH2)11N+(C2H5)2(CH2)2(CF2)5CF3I-(10,Scheme 7)。通过二乙胺与Br(CH2)11OH反应引入烷基链和极性的羟基,所得叔胺进一步与F(CF2)6C2H4I的反应引入氟碳链,并形成另一个亲水头基—季铵盐极性头基。但作者未提及该产品是否对水稳定以及产率问题。
2 氟碳杂化表面活性剂的溶液性能
2.1 高表面活性
与氟碳表面活性剂类似,氟碳杂化表面活性剂一般都具有很高的表面活性,其cmc值一般在0.1 mM ~ 1.0 mM[12,13,16,19,20,30~32],远低于典型的碳氢表面活性剂。当氟碳链和碳氢链的长度合适时,平衡表面张力一般可以降低到20 mN·m-1左右,明显低于一般碳氢表面活性剂的30 mN·m-1的值。大部分氟碳杂化表面活性剂的Krafft点(TK)较低,表明其具有良好的水溶性。但受氟碳链和碳氢链长度的影响也较为显著,碳链的增长有使TK升高的趋势,而碳氢链的增长则有对降低cmc的有明显的影响。例如,Abe等[30]合成的FC4-HC2的TK低于0℃,cmc为8.2 mM;而FC6-HC4的TK为15℃,cmc降为0.23 mM,当碳链增长为FC6-FC6时,虽然cmc降低到0.055 mM,但TK值升至48℃。
双子型氟碳杂化表面活性剂的cmc和TK似乎更低[24,25],例如,Yishino 等[24]合成的以磺酸钠为头基的双子型表面活性剂11(Chart 2,m=4,6;n=5~8),其 TK都在0℃以下,cmc都在0.5 mM以下。

Chart 2
2.2 表面活性剂分子的慢交换
氟碳杂化表面活性剂溶液中胶束中的分子与溶液中的分子交换速率远比一般的氟碳表面活性剂慢,因此胶束寿命很长,甚至可以在核磁的时间尺度内观测[23,32,33]。Yishino 等[33]发现其所合成的C6F13ΦCH(OSO3)(C5H11)表面活性剂分子与其所形成胶束之间的交换可以在NMR时间尺度内进行观测和研究,形成的胶束寿命是一般表面活性剂所形成胶束寿命的102倍至103倍。
2.3 自组装聚集体形貌丰富
氟碳杂化表面活性剂在溶液中还更倾向于形成诸如柱状胶束和囊泡的大的聚集体。Oda等[34]在研究FC8C4-2-12在溶液中组装体形貌时发现,与对应的碳氢双子表面活性剂12-2-12相比,其溶液能形成各种形貌的组装体,包括在12-2-12中未能发现的稳定的囊泡结构。10不但具备一般氟碳表面活性剂的高表面活性,其不对称结构还显著提高了表面活性剂对盐的稳定性。相比于小尺寸的胶束,10在溶液中更倾向形成大囊泡的结构[35]。
2.4 粘弹性

图2 浓度与粘度的关系曲线Figure 2 Relation curve of concentration and viscosity

图3 温度与粘度的关系曲线Figure 3 Relation curve of temperature and viscosity
Abe 等[36,37]在研究 C6F13ΦCOCH(SO3Na)(C4H9)(FC6-HC4)时发现该表面活性剂在一定浓度下具有特殊的热增粘现象。例如,在25℃,浓度增加至10%时,其粘度达到一个极值,此后粘度逐渐下降[36,37](图 2)。依赖性,随着温度的升高粘度逐渐增大,到37℃时粘度达到最大值,约100 Pa·s-1,继续升高温度则粘度下降(图3)。作者认为在较低温度时FC6-HC4在溶液中组装形成尺寸较大的胶束,在较高温度时在溶液中会组装形成尺寸较小的胶束,而在大胶束向小胶束转变过程存在一个临界温度,大胶束和小胶束共存,此时宏观粘度达到最大[38,39]。
3 氟碳杂化表面活性剂的应用
作为一类具有高表面活性,低cmc,低TK的表面活性剂,氟碳杂化表面活性剂用于改善水表面、水/油界面张力是其主要的应用场合,与传统的表面活性相比具有显著的优势。氟碳杂化表面活性剂在传统领域之外的一些场合也展现出其应用前景。
3.1 溶解含氟油性物质
一般的碳氢表面活性剂对于含氟化合物的增容能力很差,而氟碳杂化表面活性剂可有效地解决这一问题。CmF2m+1ΦCOCH(SO3Na)(CnH2n+1)系列的FC6-HC4与非氟碳杂化的HC6-HC4相比,溶解含氟油性物质的能力前者显著地强于后者[15,40]。不仅如此,氟碳杂化表面活性剂可以通过胶束内分别形成氟碳和碳氢链聚集的微区实现同时溶解非氟油性物质和氟化的油性物质[30,41]。例如FC6-HC4对水/2-萘酚/1-三氟甲基-2-萘酚体系乳化[42],这为含氟油漆的使用提重要的技术支持。
3.2 消防
由于氟碳杂化表面活性剂具有很高的表面活性,将杂化表面活性剂2的水溶液液滴滴在苯、烃类这些密度低于水的有机物质上时,液滴其可以漂浮在有机层上[30]。若将其这样的水溶液体系应用于油库消防,水相可以在油类上层漂浮,使易燃有机物与空气隔绝,灭火效果将十分理想。
3.3 乳化水/超临界CO2体系
超临界CO2作为一种无毒、不易燃、环境友好、廉价的溶剂近年来受到广泛关注,但超临界CO2难于溶解极性物质。以 Sagisaka[43]和 Eastoe[44~46]为代表的研究者致力于制备水/超临界CO2的微乳液体系以期改善其对极性物质的溶解性能。氟碳活性剂已经被认为是制备这一体系的最为优良的乳化剂,氟碳杂化表面活性剂的使用不但可以发挥氟碳表面活性剂的超强的乳化能力,还可以减少氟用量。Eastoe 小组[44,45]已经利用 C6F13ΦCOCH(SO3Na)(CnH2n+1)体系(n=2,4,6,8)制备了水在超临界CO2中分散的微乳液体系,但产率低。因此,Yishino[12]认为其制备的产率较高的的CmF2m+1C2H4CH(OSO3Na)(CnH2n+1)是较好的替代。
3.4 牙齿表面修饰
Teranaka和 Yishino等[12]在羟基磷灰石表面修饰上 C8F17ΦCH[OP(ONa)(OC6H5)](CnH2n+1)(n=3,5)后,羟基磷灰石表面在3个月时间内都具备很高的疏水和疏油性质,在牛牙齿上修饰上该类型的表面活性剂可取得类似的效果。这意味着引入了磷酸作为亲水头基的氟碳杂化表面活性剂可以作为一种预防蛀牙的牙科材料使用。
4 结束语
氟碳杂化表面活性剂作为一类新兴的特种表面活性剂,不仅具备氟碳表面活性剂特有的高表面活性等性质,还可以避免氟碳表面活性剂与碳氢表面活性剂复配使用时的分相问题。此外还具备复配体系未有的新性质,在溶解含氟有机物、乳化水/超临界CO2体系、油库消防等领域显现出良好的应用前景,尤其是其低表面张力使其极其适合应用于油井增产作业中作业液的助排。
[1]方战强,方战胜.表面活性剂在工业中的应用[J].日用化学品科学,2000,23(1):35 -37.
[2]黄惠琴.表面活性剂的应用与发展趋势[J].现代化工,2001,21(5):6 -8.
[3]苏更林.“工业味精”——表面活性剂[J].化工之友,2001,(1):31 -31.
[4]赵春霞,徐卡秋,唐聪明.氟碳表面活性剂及其在消防领域中的应用[J].日用化学工业,2004,34(6):377-380.
[5]刘国强,张凌飞,徐祖顺.氟碳表面活性剂的合成方法研究进展[J].合成技术及其应用,2010,25(3):27-32.
[6]周大鹏,黄亚茹,葛赞,等.氟表面活性剂的研究进展[J].中国洗涤用品工业,2010,5:31 -35.
[7]冯玉军,陈权生.表面活性剂在油气开采和集输中的应用及前景[J].日用化学品科学,2007,30(5):23-26.
[8]周晓东.含氟表面活性剂的结构、特性及应用研究[J].有机氟工业,2004,2:14 -18.
[9]姚钱君,陈洪龄.一种全氟辛基两性磷酸酯氟碳表面活性剂的复配研究[J].日用化学工业,2006,36(6):348-368.
[10]王彦玲,郑晶晶,赵修太,等.低碳醇对氟碳与碳氢表面活性剂复配体系泡沫性能的影响[J].化工学报,2010,61(5):1202 -1207.
[11]Ogino K,Abe M.Physicochemical properties of mixed surfactant systems[J].ACS Sym Ser,1992,(501):142 -146.
[12]Kondo Y,Yoshino N.Hybrid fluorocarbon/hydrocarbon surfactants[J].Curr Opin Colloid Interface Sci,2005,10:88 -93.
[13]Guo W,Li Z,Fung B M.Hybrid surfactants containing separate hydrocarbon and fluorocarbon chains[J].J Phys Chem B,1992,96:6738 -6742.
[14]Guo W,Fung B M,O'Rear E A.Exchange of hybrid surfactant molecules between monomers and micelles[J].J Phys Chem B,1992,96:10068 -10074.
[15]Yoshino N,Hamano K,Omiya Y,et al.Syntheses of hybrid anionic surfactants containing fluorocarbon and hydrocarbon chains[J].Langmuir,1995,11:466 -469.
[16]Miyazawa H,Igawa K,Kondo Y,et al.Synthesis and solution properties of sulfate-type hybridsurfactants with a benzene ring[J].J Fluorine Chem,2003,124:189-196.
[17]Miyazawa H,Yokokura H,Ohkubo Y,et al.Synthesis of phosphate-type fluorocarbon-hydrocarbon hybrid surfactants and their adsorption onto calcium hydroxyapatite[J].J Fluorine Chem,2004,125:1485 -1490.
[18]Miyazawa H,Yokokura H,Ohkubo Y,et al.Synthesis of phosphate-type fluorocarbon-hydrocarbon hybrid surfactants and their adsorption onto calcium hydroxyapatite[J].J Fluorine Chem,2005,126:301 -306.
[19]Miyazawa H,Wakatsuki Y,Kondo Y,et al.Synthesis and solution properties of nonionic hybrid surfactants with a benzene ring[J].J Oleo Sci,2005,54(6):361-368.
[20]Miyazawa H,Kondo Y,Yoshino N.Synthesis and solution properties of surfate-type hybrid surfactants with an ethylene spacer[J].J Oleo Sci,2005,54(3):167-178.
[21]Abla M,Durand G,Pucci B.Glucose-based surfactants with hydrogenated,fluorinated,or hemifluorinated tails:Synthesis and comparative physical-chemical characterization[J].J Org Chem,2008,73:8142 -8153.
[22]Chaudier Y,Barthélémy P,Pucci B.Synthesis and preliminary assessments of hybrid hydrocarbon-fluorocarbon anionic and non-ionic surfactants[J].Tetrahedron Lett,2001,42:3583 -3585.
[23]Oda R,Huc I,Danino D,et al.Aggregation properties and mixing behavior of hydrocarbon,fluorocarbon,and hybrid hydrocarbon-fluorocarbon cationic dimeric surfactants[J].Langmuir,2000,16:9759 -9769.
[24]Ohno A,Kushiyama A,Kondo Y,et al.Synthesis and properties of gemini-type hydrocarbon-fluorocarbon hybrid surfactants[J].J Fluorine Chem,2008,129:577-582.
[25]Quagliotto P,Barolo C,Barbero N,et al.Synthesis and characterization of highly fluorinated gemini pyridinium surfactants[J].Eur J Org Chem,2009:3167 -3177.
[26]Aydogan N,Aldis N,Guvenir O.Interfacial and bulk properties of the new fluorocarbon-hydrocarbon hybrid unsymmetrical bolaform surfactant[J].Langmuir,2003,19:10726 -10731.
[27]Aydogan N,Aldis N.Tuning surface tension and aggregate shape via a novel redox active fluorocarbonhydrocarbon hybrid surfactant[J].Langmuir,2006,22:2028-2033.
[28]Huc I,Oda R.Gemini surfactants:Studying micellisation by1H and19F NMR spectroscopy[J].Chem Commun,1999:2025 -2026.
[29]王继宇,冯玉军,苏鑫.氟碳阳离子双子及杂化双子表面活性剂及其合成方法[P].CN 201 110 062 964.5.
[30]Ito A,Sakai H,Kondo Y,et al.Micellar solution properties of fluorocarbon-hydrocarbon hybrid surfactants[J].Langmuir,1996,12:5768 -5772.
[31]Sagisaka M,Ito A,Kondo Y,et al.Effects of fluoroalkyl chain length and added moles of oxyethylene on aggregate formation of branched-tail fluorinated anionic surfactants[J].Colloids Surf A,2001:183 - 185:749-755.
[32]Matsuoka K,Moroi Y.Micellization of fluorinated amphiphiles[J].Curr Opin Colloid Interface Sci,2003,8:227 -235.
[33]Kondo Y,Miyazawa H,Sakai H,et al.First anionic micelle with unusually long lifetime:Self-assembly of fluorocarbon-hydrocarbon hybrid surfactant[J].J Am Chem Soc,2002,124:6516 -6517.
[34]Nishida J,Brizard A,Desbat B,et al.Mixing behavior of fluorinated and hydrogenated gemini surfactants at the air-water interface[J].J Colloid Interface Sci,2005,284:298 -305.
[35]Calik P,Ileri N,Erdinc B I,et al.Novel antifoam for fermentation processes:Fluorocarbon-hydrocarbon hybrid unsymmetrical bolaform surfactant[J].Langmuir,2005,21:8613 -8619.
[36]Abe M,Tobita K,Sakai H,et al.Anomalous viscoelasticity of concentrated solutions with a fluorinated hybrid surfactant[J].Langmuir,1997,13:2932 -2934.
[37]Tobita K,Sakai H,Kondo Y,et al.Thermoresponsive viscoelasticity of sodium 1-oxo-1-[4-(tridecafluorohexyl)phenyl]-2-hexanesulfonate aqueous solutions[J].Langmuir,1997,13:5054 -5055.
[38]Tobita K,Sakai H,Kondo Y,et al.Temperature-induced critical phenomenon of hybrid surfactant as revealed by viscosity measurements[J].Langmuir,1998,14:4753 -4757.
[39]Abe M,Tobita K,Sakai H,et al.Thermoresponsive viscoelasticity of concentrated solutions with a fluorinated hybrid surfactant[J].Colloids Surf A,2000,167:47-60.
[40]Saeki A,Sakai H,Kamogawa K,et al.Solubilization of oily compounds into fluorocarbon-hydrocarbon hybrid surfactant admicelles formed on alumina surfaces[J].Langmuir,2000,16:9991 -9995.
[41]Ito A,Kamogawa K,Sakai H,et al.Micelle aggregating condition of fluorocarbon-hydrocarbon hybrid surfactants in aqueous solution[J].Langmuir,1997,13:2935-2942.
[42]Abe M,Saeki A,Kamogawa K,et al.Fluorocarbon hybrid surfactants characterization of admicelles and its solubilization[J].Ind Eng Chem Res,2000,39:2697-2703.
[43]Sagisaka M,Yoda S,Takebayashi Y,et al.Preparation of a W/scCO2microemulsion using fluorinated surfactants[J].Langmuir,2003,19:220 -225.
[44]Dupont A,Eastoe J,Martin L,et al.Hybrid fluorocarbon-hydrocarbon CO2-philic surfactants.2.Formation and properties of water-in-CO2microemulsions[J].Langmuir,2004,20:9960 -9967.
[45]Dupont A,Eastoe J,Murray M,et al.Hybrid fluorocarbon-hydrocarbon CO2-philic surfactants.1.Synthesis and properties of aqueous solutions[J].Langmuir,2004,20:9953 -9959.
[46]Mohamed A,Sagisaka M,Hollamby M,et al.Hybrid CO2-philic surfactants with low fluorine content[J].Langmuir,2012,28:6299 -6306.
