苯基碳酸烯丙酯类化合物的合成及其在手性仲胺拆分中的应用*
2013-03-26李明泽戴荣继邓玉林
丁 薇,李明泽,戴荣继,邓玉林
(北京理工大学生命学院,北京 100081)
胺类化合物具有特殊的生物活性[1]。其中光学活性的胺类化合物,特别是仲胺,由于其特殊的药理活性被广泛应用于合成天然和非天然药物[2],作为有机不对称合成的手性助剂[3]或催化剂[4,5]。目前获得光学活性仲胺的方法有化学拆分法、不对称合成法[6]和酶拆分法[7]。其中酶拆分方法由于具有活性高、专一性好、反应条件温和等优点被化学家们广泛关注。
虽然酶拆分方法适用于制备手性伯胺[8,9],但目前报导脂肪酶催化动力学拆分二级胺的文献非常少[10],可能的原因为两方面:一方面,作为底物的二级胺易于在酶的活性中心形成空间位阻[11];另一方面,大量的酶拆分酰基试剂不能用于二级胺类化合物的拆分,即使能用也只得到低对映选择性产物[12]。
本文参考文献[12]方法合成了三种苯基碳酸烯丙酯化合物[1a~1c,其中2-甲氧基苯基碳酸烯丙酯(1b)为新化合物],并考察了1a~1c作为酰基供体,在甲苯中经Novozyme 435酶催化对消旋的1-甲基-6,7-二甲氧基四氢异喹啉(2)进行拆分,得到了较高转化率(50%)的手性仲胺(S)-2和(R)-2(对映选择性>99%,Scheme 1),其结构经1H NMR和13C NMR表征。
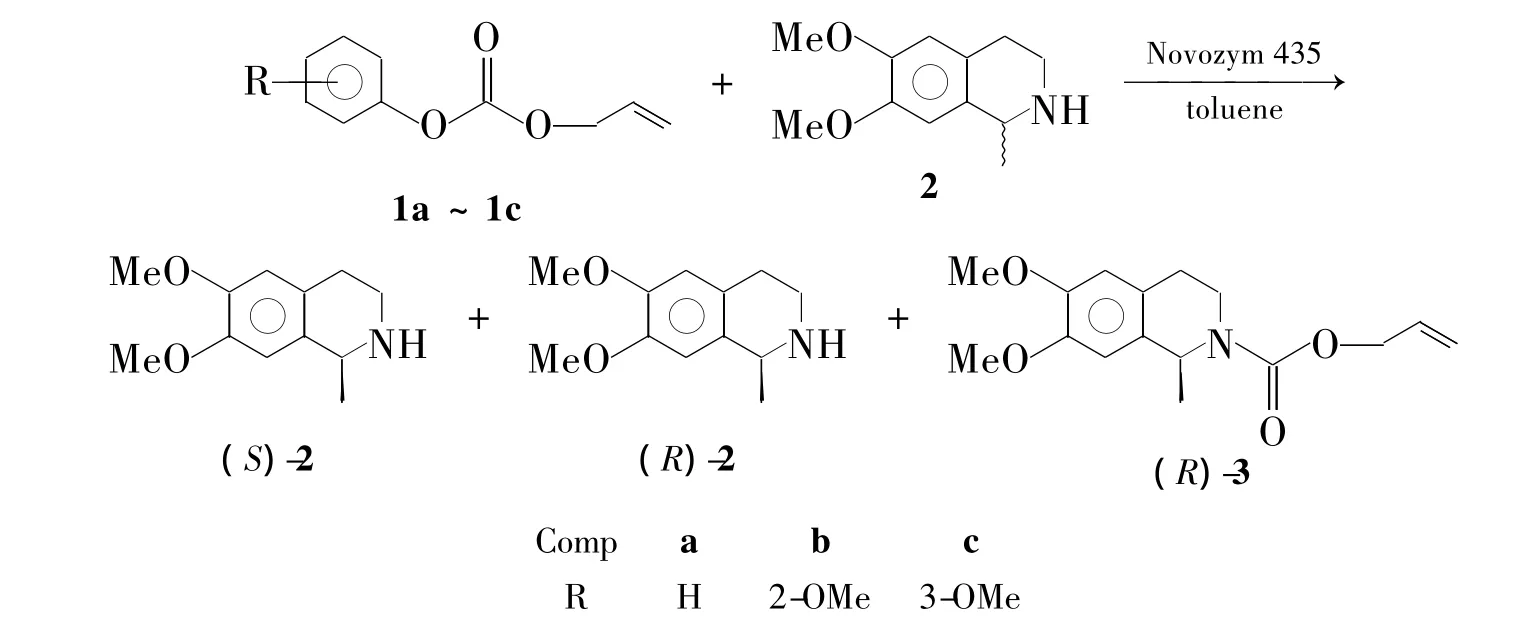
Scheme 1
1 实验部分
1.1 仪器与试剂
Ultra Shield BRUK-ER 400型核磁共振仪(CDCl3为溶剂,TMS为内标);SPD型高效液相色谱仪[SPD-20A检测器,LC-20AD梯度泵,Labsolutions1.22sp色谱工作站(Chiralpak AD-H手性柱,检测波长 254 nm,流速 1 mL·min-1,进样体积 10 μL]。
2按文献[13]方法制备(收率 95%);苯酚,2-甲氧基苯酚和3-甲氧基苯酚,北京偶合科技有限公司(>98%);四正丁基氯化铵和氯化烯丙基甲酯,北京百灵威科技有限公司;Novozyme435,Novo Nodisk公司;其余所用试剂为分析纯。
1.2 合成
(1)1a~1c的合成(以1a)为例
在反应瓶中加入苯酚5.567 g(59.22 mmol),四正丁基氯化铵118 mg(0.413 mmol),二氯甲烷40 mL和4 mol·L-1氢氧化钠溶液20 mL,冰浴冷却,搅拌下缓慢滴加氯化烯丙基甲酯7 mL(65.92 mmol),滴毕,反应2 h。分液,有机层用2 mol·L-1氢氧化钠溶液(2×20 mL)洗涤,用无水硫酸镁干燥,蒸除溶剂得淡黄色油状液体苯基碳酸烯丙酯(1a)10 g,收率 92%;1H NMR δ:4.74 ~4.76(d,2H,OCH2),5.32 ~5.48(m,2H,CH=CH2),5.95 ~6.08(m,1H,CH=CH2),7.17 ~7.29(m,3H,PhH),7.37 ~ 7.44(m,2H,PhH);13C NMR δ:68.8,119.0,120.8,125.7,129.2,130.9,150.9,153.2。
用类似的方法合成1b和3-甲氧基苯基碳酸烯丙酯(1c)。
1b:淡黄色油状液体,收率93%;1H NMR δ:3.76(s,3H,OCH3),4.73 ~4.76(d,2H,OCH2),5.30 ~5.47(q,2H,CH=CH2),5.94 ~ 6.07(m,1H,CH=CH2),6.92 ~ 7.00(q,2H,ArH),7.13 ~ 7.27(m,2H,ArH);13C NMR δ:55.5,68.8,112.2,118.7,120.4,122.0,126.9,132.0,139.8,150.9,152.9。
1c:红棕色油状液体,收率93.4%;1H NMR δ:3.805(s,3H,OCH3),4.73 ~ 4.76(d,2H,OCH2),5.32 ~5.46(q,2H,CH=CH2),5.94 ~6.07(m,1H,CH=CH2),6.75 ~6.82(m,2H,ArH),7.26 ~ 7.32(t,2H,ArH);13C NMR δ:55.1,68.9,106.9,111.7,113.0,119.1,129.6,131.0,151.8,153.1,160.3。
1.3 Novozym 435催化的动力学拆分
在反应瓶中加入2 575 mg(5 mmol),甲苯20 mL,Novozym 435 200 mg 及1a 2.6 g(12.5 mmol),搅拌下于25℃反应72 h。过滤,滤饼(Novozym 435)用甲苯(10 mL)洗涤,干燥后套用。滤液用2 mol·L-1盐酸(2 ×25 mL)洗涤,分液,水层用 10 mol·L-1氢氧化钠溶液调至 pH 12,用 TBME(甲基叔丁基醚)(2×10 mL)萃取,合并萃取液,用无水硫酸镁干燥,蒸除溶剂得淡黄色固体(S)-2,收率 46%,99.65%e.e.;1H NMR δ:1.43 ~ 1.45(d,3H,CCH3),2.61 ~ 2.69(t,1H,4-H),2.75 ~2.85(t,1H,4-H),2.95 ~3.04(t,1H,3-H),3.22 ~ 3.29(t,1H,3-H),3.92(s,6H,OCH3),3.94(t,1H,NH),6.58 ~6.64(d,2H,5,8-H)。
甲苯层用2 mol·L-1氢氧化钠溶液(25 mL)洗涤,用无水硫酸镁干燥,蒸除溶剂得无色油状液体(R)-3,收率 47%,98.4%e.e.;1H NMR δ:1.47 ~1.48(d,3H,CCH3),3.84 ~3.84(d,6H,OCH3),4.69 ~4.74(d,4H,3,4-H),4.62 ~4.65(d,2H,CH),5.19 ~5.20(t,1H,ArH),5.20 ~5.23(m,1H,ArH),5.28 ~ 5.29(t,1H,1-H),5.44 ~5.46(m,1H,CH),6.58s,2H,OCH2)。
2 结果与讨论
2.1 酰化剂对酶促拆分的影响
在酶催化醇类和脂肪胺类的酰化反应时,许多具有活性的酯被用做酰化试剂[14]。本文以Novozyme 435酶催化2的动力学拆分为模板反应,考察了不同酰基供体对拆分反应的影响,结果见表1。由表1可见,不同的酰基供体对脂肪酶的对映选择性表现不同,其中1a~1c有较好的促进作用;甲氧基乙酸甲酯、乙酸乙酯和乙酸甲酯完全没有反应性。
从表1还可见,1a~1c的反应性相似,转化率接近50%,同时产物的对映选择性和 E值(>200)均较高。
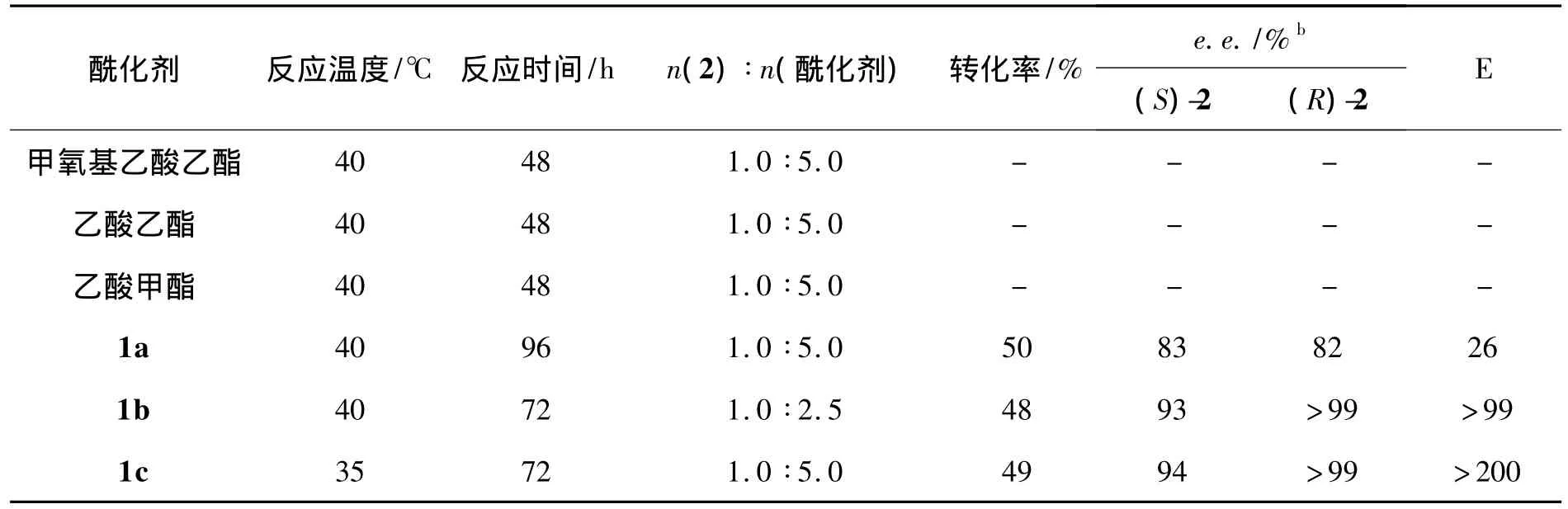
表1 酰化剂对酶促拆分的影响aTable 1 Effect of acylating reagent on enzymatic kinetic resolution
2.2 1用量对酶促拆分的影响
以Novozyme 435为酶,1a为酰化试剂,考察1a用量r[n(2)∶n(1a)]对酶促拆分的影响,结果见表2。由表2可见,当r=1.0∶1.0时,转化率只有35%;当r=1.0 ∶2.5时,转化率达到最高(50%);再增加1a的用量,转化率反而会下降。可能是由于在反应体系中酰基供体高浓度产生的抑制作用。最佳的r=1.0 ∶2.5。

表2 酰化剂用量对酶促拆分的影响aTable 2 Effect of acylating reagent amount on enzymatic kinetic resolution
3 结论
利用苯酚类化合物与氯化烯丙基甲酯一步反应合成了苯基碳酸烯丙酯类化合物,并以此为酰基供体,用固定化 Novozym 435对1-甲基-6,7-二甲氧基四氢异喹啉进行酶促的酰化拆分,得到相应的光学对映异构体(R)-酰胺,转化率50%,对映选择性良好。表明,苯基碳酸烯丙酯类化合物是脂肪酶催化拆分二级胺的有效酰化试剂。
[1]Butler M S.The role of natural product chemistry in drug discovery[J].Journal of Natural Products,2004,67:2141-2153.
[2]Berger M,Albrecht B,Berces A,et al.S(+)-4-(1-phenylethylamino)quinazolines as inhibitors of human immunoglobulin E synthesis:Potency is dictated by stereochemistry and atomic point charges at N-1[J].J Med Chem,2001,44:3031 -3038.
[3]Henderson K W,Kerr W J,Moir J H.Enantioselective deprotonation reactions using a novel homochiral magnesium amide base[J].Chem Commun,2000:479-480.
[4]Adamo M F A,Aggarwal V K,Sage M A.Epoxidation of alkenes by amine catalyst precursors:Implication of aminium ion and radical cation intermediates[J].J Am Chem Soc,2000,122:8317 -8318.
[5]Nieuwenhuijzen J W,Grimbergen R F P,Koopman C,et al.The role of nucleation inhibition in optical resolutions with families of resolving agents[J].Angew Chem,Int Ed,2002,41(22):4281 -4286.
[6]Xu L J,Lam K H,Ji J X,et al.Air-stable Ir-(P-phos)complex for highly enantioselective hydrogenation of quinolines and their immobilization in poly(ethyleneglycol)dimethyl ether(DMPEG)[J].Chem Commun,2005:1390 -1392.
[7]Dhake K P,Tambade P J,Singhal R S,et al.Promiscuous candida antarctica lipase B-catalyzed synthesis of β-amino esters via aza-Michael addition of amines to acrylates[J].Tetrahedron Lett,2010,51:4455 -4458.
[8]van Rantwijk F,Sheldon R A.Enantioselective acylation of chiral amines catalysed by serine hydrolases[J].Tetrahedron,2004,60:501 -509.
[9]Carr R,Alexeeva M Enright A,Eve T S C,et al.Directed evolution of an amine oxidase possessing both broad substrate specificity and high enantioselectivity[J].Angew Chem,Int Ed,2003,42:4807 -4810.
[10]Orsat B,Alper P B,Moree W,et al.Homocarbonates as substrates for the enantioselective enzymatic protection of amines[J].J Am Chem Soc,1996,118:712-713.
[11]Chiou T W,Cheng C C,Tar F T.Kinetic resolution of propranolol by a lipase-catalyzedN-acetylation[J].Bioorg Med Chem Lett,1997,7:433 -436.
[12]Morgan B,Zaks A,Dodds D R,et al.Enzymatic kinetic resolution of piperidine atropisomers:Synthesis of a key Intermediate of the farnesyl protein transferase inhibitor,SCH66336[J].J Org Chem,2000,65:5451-5459.
[13]Liljeblad A,Lindborg J,Kanerva A,et al.Enantioselective lipase-catalyzed reactions of methyl pipecolinate:Transesterification andN-acylation[J].Tetrahedron Lett,2002,43:2471 - 2474.
[14]Hu S H,Tat D,Martinez C A,et al.An efficient and practical chemo-enzymatic preparation of optically active secondary amines[J].Organic Letters,2005,7(20):4329-4331.
[15]Breen G F.Enzymatic resolution of a secondary amine using novel acylating reagents[J].Tetrahedron:Asymmetry,2004,15:1427 -1430.
[16]Gonzalez M A,Meyers A I.Alpha-mino carbanions and generation formamidine for facile deprotonation leading to alpha-uateraary substitution[J].Tetrahedron Lett,1989,30:47 -50.
[17]Klibanov A M.Asymmetric transformations catalyzed by enzymes in organic solvents[J].Acc Chem Res,1990,23(4):114 –120.
