新型甲磺酰基喹啉衍生物的合成*
2013-03-26朱晓东聂爱华
朱晓东,顾 为,聂爱华
(1.中南大学湘雅药学院,湖南 长沙 410013;2.军事医学科学院 毒物药物研究所,北京 100850)
喹啉和磺酰胺是两类重要的药效官能团,将两者结合在一起形成的喹啉磺酰胺类结构常见于抗菌、抗老年痴呆、抗血栓、治疗丙型肝炎和作为肾上腺受体激动剂等药物结构中[1~5]。因此合成该类化合物并将其应用到药物发现领域具有重要的意义。
本文以7-羧基喹啉(1)为原料,经硝化、酯化、硝基的还原、磺酰化和乙基化五步反应合成了7个新型的甲磺酰基喹啉衍生物(5,6,7a~7d和8a,Scheme 1),其结构经1H NMR和LC-MS表征。在合成的喹啉磺酰胺类化合物(5和6)中,有一个N原子可用来与其它分子片段结合,从而发现新的活性分子;7-位酯基也可水解成酸后,与其他分子成酰胺或者成酯形成新的活性分子。5~8分子结构中的磺酰胺基和喹啉环是具有药效作用的基团,可应用在抗菌、抗老年痴呆、抗血栓、治疗丙肝和作为肾上腺受体激动剂等药物发现领域。
该合成路线方法可靠,且操作简便。
1 实验部分
1.1 仪器与试剂
RY-1型毛细管熔点仪(温度未校正);JNMECA-400型超导核磁共振仪(DMSO为溶剂,TMS为内标);API-150EX(ESI)型质谱仪。
1,北京偶合有限公司;10%Pd/C,陕西开达化工有限公司,经无水乙醇(3×10 mL)洗涤后使用;甲基磺酰氯,天津光复化学研究所;乙醇经钠丝处理后重蒸馏纯化后使用;其余所用试剂均为分析纯。
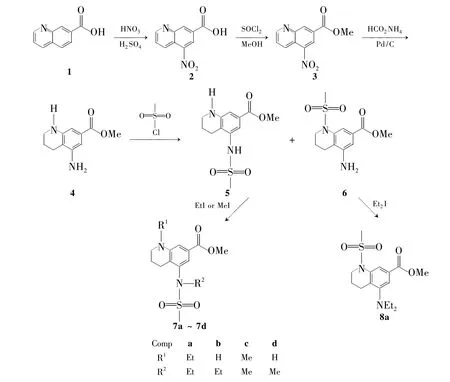
Scheme 1
1.2 合成
(1)5-硝基-7-羧基喹啉(2)的合成[6]
在反应瓶中加入1 22 g(0.127 mol),冰浴冷却,搅拌下加入浓硫酸176 mL;滴加浓硝酸88 mL,滴毕,于80℃(内温)反应3 h。冷却至室温,滴加2 mol·L-1NaOH溶液至pH 4,有白色絮状固体生成,过滤,滤饼用少量水洗涤,干燥得黄白色固体 2 18.6 g,收率67.1%,m.p.>300 ℃;1H NMR δ:8.99(s,1H,ArH),8.44(d,J=7.9 Hz,1H,ArH),7.85(t,J=7.3 Hz,6.8 Hz,2H,ArH),7.76(dd,J=17.7 Hz,8.1 Hz,1H,ArH)。
(2)5-硝基-7-羧基甲酯喹啉(3)的合成
在反应瓶中加入2 18.6 g(853 mmol)和无水甲醇200 mL(4.94 mol),搅拌使其溶解;冰水浴冷却下滴加SOCl231 mL,滴毕,回流反应2 h。冷却至室温,减压蒸除溶剂,加水 200 mL,用2 mol·L-1NaOH 溶液调至 pH 10,用乙酸乙酯(3×200 mL)萃取,合并萃取液,用无水 Na2SO4干燥,减压蒸除溶剂后经硅胶柱层析[洗脱剂:A=V(石油醚)∶V(乙酸乙酯)=10∶1]纯化得白色固体 3 15.45 g,收率 78.1%,m.p.116 ℃ ~118 ℃;1H NMR δ:9.20(s,1H,ArH),8.97(dd,J=10.8 Hz,4.0 Hz,2H,ArH),8.76(d,J=1.68 Hz,1H,ArH),9.53(dd,J=4.2 Hz,9.0 Hz,1H,ArH),4.00(s,3H,OCH3);ESIMSm/z(%):219{[M - CH2]+,100},233{[M+H]+,89},248{[M -NH3]+,26}。
(3)5-氨基-1,2,3,4-四氢喹啉-7-羧基甲酯(4)的合成[7]
在反应瓶中加入3 11.4 g(49.2 mol)和绝对乙醇200 mL,搅拌使其溶解;依次加入HCO2NH435.56 g(0.564 mol),10%Pd/C 4.0 g 及甲酸0.5 mL,氮气保护下回流反应8 h。冷却至室温,过滤,滤饼用乙酸乙酯洗涤,合并滤液与洗液,减压蒸除溶剂,加水100 mL,用饱和NaHCO3溶液调至pH 10;用乙酸乙酯(3×100 mL)萃取,合并乙酸乙酯相,用无水Na2SO4干燥,减压蒸除溶剂后经硅胶柱层析(洗脱剂:A=6∶1)纯化得黄色油状液体 4 6.5 g,收率 64.2%;1H NMR δ:6.51(s,1H,ArH),6.41(s,1H,ArH),5.59(s,1H,NH),4.84(s,2H,NH2),3.74(s,3H,OCH3),3.08(t,J=4.0 Hz,4.0 Hz,2H,CH2),2.36(t,J=4.0 Hz,8.0 Hz,3H,OCH3),1.80(m,2H,CH2);ESI-MSm/z(%):207{[M+H]+,100},191{[M -NH2]+,49}。
(4)5和6的合成
在反应瓶中加入4 6.5 g(31.6 mmol)和二氯甲烷50 mL,搅拌使其溶解;加入碳酸钾12 g和少许KI,冰水浴冷却下滴加甲基磺酰氯3.7 mL(47.8 mmol),滴毕,于室温反应6 h。蒸除溶剂,加水100 mL,用2 mol·L-1NaOH 溶液调至 pH 10;用乙酸乙酯(3×100 mL)萃取,合并乙酸乙酯相,用无水Na2SO4干燥,减压蒸除溶剂后经硅胶柱层析(洗脱剂:A=2∶1)纯化得灰色固体 5-甲磺酰胺-1,2,3,4-四氢喹啉-羧基甲酯(5)和淡黄色固体 5-氨基-1-甲磺酰基-1,2,3,4-四氢喹啉-7-羧基甲酯(6)。
5:收率 33.6%,m.p.150 ℃ ~152 ℃;1H NMR δ:8.94(s,1H,NH),7.00(t,J=4.0 Hz,4.0 Hz,2H,ArH),6.18(s,1H,NH),3.79(s,3H,OCH3),3.14(d,J=4.0 Hz,2H,CH2),2.95(s,3H,OCH3),2.70(d,J=4.0 Hz,2H,CH2),1.74(d,J=4.0 Hz,2H,CH2);ESI-MSm/z(%):285{[M+H]+}。
6:收率 8.5%,m.p.158℃ ~160℃;1H NMR δ:7.46(s,1H,ArH),7.10(s,1H,ArH),5.34(s,2H,NH),3.79(s,3H,OCH3),3.65(m,2H,CH2),2.98(s,3H,CH3),1.95(m,2H,CH2);ESI-MSm/z(%):285{[M+H]+,100},307{[M+Na]+,73}。
(5)7a~7d的合成(以7a为例)
在反应瓶中加入5 370 mg(1.30 mmol)和DMF 2 mL,搅拌使其溶解;加入碘乙烷2.1 mL(26.1 mmol),冰水浴冷却下分批加入 NaH 124 mg(期间有气泡冒出,放热),加毕,于室温反应1.5 h。用95%乙醇淬灭 NaH(有大量气泡冒出),过滤,滤饼用乙酸乙酯(3×10 mL)洗涤,合并滤液与洗液,减压蒸干,加水10 mL,用饱和柠檬酸水溶液调至pH 10,用乙酸乙酯(3×10 mL)萃取,合并乙酸乙酯相,用无水Na2SO4干燥,减压蒸除溶剂后经硅胶柱层析(洗脱剂:A=6∶1)纯化得 1-N-乙基-5-N-乙基-甲磺酰基-1,2,3,4-四氢喹啉-7-羧基甲酯(7a)。
用类似的方法合成7b~7d。
用6替代4,用类似的方法合成8a。
7a:浅黄色固体,收率 33.9%,m.p.171℃ ~173 ℃;1H NMR δ:7.73(s,1H,ArH),7.18(s,1H,ArH),3.89(s,3H,OCH3),3.43(m,6H,CH2),2.97(s,3H,CH3),2.87(m,2H,CH2),2.05(s,2H,CH2),1.21(t,J=4.0 Hz,8.0 Hz,3H,CH3),1.11(t,J=8.0 Hz,4.0 Hz,3H,CH3);ESI-MSm/z(%):341{[M+H]+,100},363{[M+Na]+,14}。
5-N-乙基-甲基磺酰胺-1,2,3,4-四氢喹啉-7-羧基甲酯(7b):灰色固体,收率50.91%,m.p.161 ℃ ~162 ℃;1H NMR δ:7.28(s,1H,ArH),7.26(s,1H,ArH),6.12(s,1H,NH),3.89(s,3H,OCH3),3.41(f,J=8.0 Hz,8.0 Hz,4.0 Hz,2H,CH2CH3),3.27(t,J=8.0 Hz,4.0 Hz,2H,CH2CH3),3.07(s,3H,CH3),2.76(t,J=8.0 Hz,8.0 Hz,2H,CH2CH3),1.71(m,2H,CH2CH2CH2),1.16(t,J=4.0 Hz,8.0 Hz,2H,CH2CH3);ESI-MSm/z(%):313{[M+H]+,100},335{[M+Na]+,28}。
1-N-甲基-5-N-甲基-甲基磺酰基-1,2,3,4-四氢喹啉-7-羧基甲酯(7c):灰白色固体,收率30.10%,m.p.163 ℃ ~165 ℃;1H NMR δ:7.21(s,1H,ArH),7.07(s,1H,ArH),3.83(s,3H,OCH3),3.24(t,J=4.0 Hz,4.0 Hz,2H,CH2CH2),3.11(d,J=4.0 Hz,3H,CH3),3.05(s,3H,CH3),2.91(s,3H,CH3),2.78(m,2H,CH2CH2),1.86(m,2H,CH2CH2CH2);ESI-MSm/z(%):313{[M+H]+,100},335{[M+Na]+,28}。
5-N-甲基-甲基磺酰胺-1,2,3,4-四氢喹啉-7-羧基甲酯(7d):灰色固体,收率23.64%,m.p.160 ℃ ~162 ℃;1H NMR δ:7.08(s,1H,ArH),7.06(s,1H,ArH),6.29(s,1H,NH),3.80(s,3H,OCH3),3.16(m,2H,CH2CH3),3.10(s,3H,CH3),3.05(s,3H,CH3),2.51(m,2H,CH2CH2),1.80(m,2H,CH2CH2CH2);ESI-MSm/z(%):321{[M+Na]+,100},299{[M+H]+,18}。
5-N-二乙基-1-甲磺酰基-1,2,3,4-四氢喹啉-7-羧基甲酯(8a):灰白色固体,收率18.70%,m.p.178 ℃ ~180 ℃;1H NMR δ:7.93(s,1H,ArH),7.44(s,1H,ArH),3.84(s,3H,OCH3),3.68(t,J=8.0 Hz,12.0 Hz,2H,CH2CH2),3.01(s,3H,CH3),2.97(dd,J=14.0 Hz,7.0 Hz,4H,CH2CH3),2.78(t,J=8.0 Hz,8.0 Hz,2H,CH2CH2),1.87(m,2H,CH2CH2CH2),0.94(t,J=7.0 Hz,7.3 Hz,3H,CH2CH3);ESI-MSm/z(%):341{[M+H]+,100},352{[M+Na]+,12},681{[2M+H]+,14}。
2 结果与讨论
在2的合成中,反应时间和温度对收率有较大影响。温度过高或时间过长会产生8-位的硝化产物。实验结果表明,于80℃(内温)反应3 h较好。
在4的合成中,文献[7]方法仅使用甲酸铵作为还原剂。由于甲酸铵在受热时易升华,遇冷后,凝结在冷凝管上,堵塞冷凝管,同时导致反应液中物料比发生变化。经过分析后认为甲酸铵中的醛基氢是起还原作用的主要基团,加入少许甲酸后,收率提高近10%。
[1]Kazunao Masubuchi,Mikio Taniguchi,Isao Umeda,et al.Synthesis and structure activity relationships of novel fungal chitin synthase inhibitors[J].Bioorg Med Chem Lett,2000,10:1459 -1462.
[2]M Antonieta Bros,Mercedes Alvarez.Synthesis of pyrrolo[4,3,2-de]quinolines from 6,7-dimethoxy-4-methylquinoline.Formal total syntheses of damirones A and B,batzelline C,isobatzelline C,discorhabdin,C,and makaluvamines A-D[J].J Org Chem,1997,62:568 -577.
[3]Boehringer Ingelheim Pharm K G.Antithrombotic phenylalkyl derivatives[P].US 6 300 342,2001.
[4]Barnes David.Uracil or thymine derivative for treating hepatitis[P].WO 2009/39 127,2010.
[5]Mccormick Kevin.Imidazole derivatives as functionally selective alpha 2c adrenoreceptor agonists[P].WO 2007/24 944,2008.
[6]Peter Sutter,Claus D Weis.Thermal framentations of nitrated 8-quinolinds[J].J Heterocyclic Chem,1986,23:29-32.
[7]Cunyu Zhang,Susan M Westaway,Jason D Speake,et al.Tetrahydroquinoline derivatives as opioid receptor antagonists[J].Bioorg Med Chem Lett,2011,21:670 -676.
