4-羟基-2-吡啶酮的合成*
2013-03-26赵圣印程少华
陈 晨,赵圣印,程少华
(东华大学化学化工与生物工程学院,上海 201620)
以冬青生菌素H和Tenellin等为代表的4-羟基-2-吡啶酮类化合物是从植物和动物等内生菌的发酵液中提取分离得到的一类新型天然生物碱,具有抗真菌、抗菌、抗病毒和抗肿瘤等多种生物活性[1,2],其全合成及结构修饰研究一直是天然产物化学和有机合成化学的研究热点之一。
4-羟基-2-吡啶酮(4)是合成该类天然产物及其衍生物的重要原料,同时也是一类重要的医药中间体[3~6]。近年来本课题组[2,3,7]一直致力于4-羟基-2-吡啶酮类化合物的合成研究,迄今为止,合成4的主要方法有两种:(1)以吡啶为原料,经H2O2氧化、硝化、与苄醇反应制得4-苄氧基-N-氧化吡啶,后者在醋酐作用下经转位和Pd/C催化氢化脱苄基合成4[8,9]。(2)以丙二腈和原乙酸三甲酯为原料,经缩合制得2-(1-甲氧基乙烯基)丙二腈,与N,N-二甲基甲酰胺缩二甲醇缩合后在醋酸中环合得4-甲氧基-3-氰基-2-吡啶酮,再经5-位氯代,最后在HBr溶液中脱甲氧基和脱羧制得5-氯-4-羟基-2-吡啶酮[10,11]。
对两种合成方法比较发现:方法(1)反应经典、操作简单、原料易得,但反应步骤较长,总收率较低,三废较多;方法(2)路线较短。
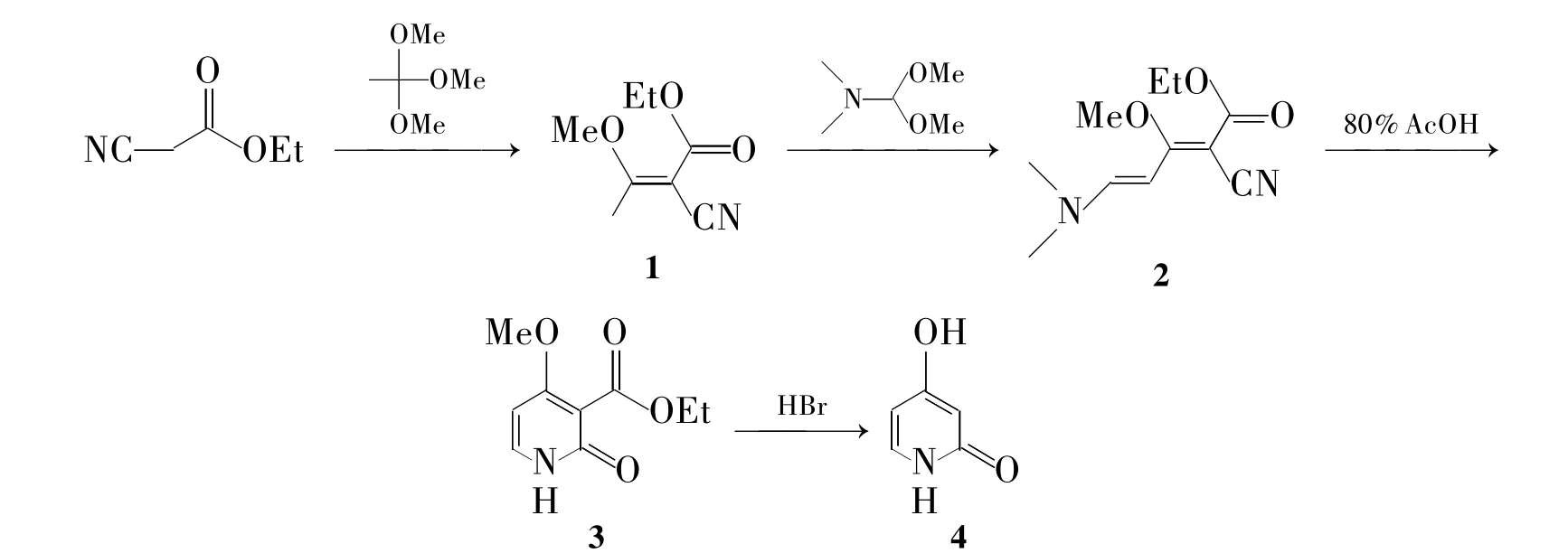
Scheme 1
本文借鉴方法(2)合成4。由于丙二腈较氰乙酸乙酯价格贵,改用氰乙酸乙酯代替丙二腈与原乙酸三甲酯缩合制得2-氰基-3-甲氧基丁烯-2-羧酸乙酯(1);1与二甲基甲酰胺缩二甲醇缩合得2-氰基-5-(二甲氨基)-3-甲氧基-2,4-戊二烯酸乙酯(2);2在80%醋酸中环合得4-甲氧基-2-吡啶酮-3-甲酸乙酯(3)[12,13];3 在 HBr中脱甲基和脱羧合成了4(Scheme 1),总收率31%,其结构经1H NMR,IR和MS确证。其中从3→4的合成方法为首次报道。
4-羟基-2-吡啶酮类化合物的合成及生物活性研究正在进行中。
1 实验部分
1.1 仪器与试剂
RY-1型熔点仪(温度未校正);Bruker AV 400 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);Nicolet 3080型红外光谱仪(KBr压片);HP 5973型质谱仪。
原乙酸三甲酯,N,N-二甲基甲酰胺缩二甲醇,上海韶远化学试剂公司;其余所用试剂均为化学纯或分析纯。
1.2 合成
(1)1的合成
在反应瓶中加入氰乙酸乙酯10.7 mL(100 mmol)和原乙酸三甲酯 12.7 mL(100 mmol),搅拌下回流(110℃)反应2 h。加入原乙酸三甲酯2.5 mL(20 mmol),于135℃反应至终点(TLC监控)。冷却,用95%乙醇重结晶得白色固体1 12.7 g,收率 75%,m.p.132 ℃ ~135 ℃ (133℃ ~134 ℃[14])。
(2)2的合成
在反应瓶中加入1 16.9 g(100 mmol),N,N-二甲基甲酰胺缩二甲醇14.6 mL(110 mmol)和二甲苯150 mL,搅拌使其溶解;回流反应2 h(TLC监控)。减压蒸除甲苯,残余物用乙醇重结晶得黄色固体2 15.5 g,收率 75%,m.p.72 ℃ ~75.0 ℃(65%,68.5 ℃ ~ 70 ℃[12]);1H NMR δ:1.28 ~1.23(s,J=8.0 Hz,3H,CH3),2.93(s,3H,CH3),3.15(s,3H,CH3),3.96(s,3H,CH3),4.14(q,J=8.0 Hz,2H,CH2),6.13(s,1H,CH=),7.46(d,J=12.5 Hz,1H,CH=)。
(3)3的合成
在反应瓶中加入2 22.4.g(100 mmol)和80%冰醋酸150 mL,搅拌下回流反应3 h。减压蒸除醋酸,残余物加水200 mL,用饱和NaHCO3溶液调至pH 8~9,用CH2Cl2(2×150 mL)萃取,合并有机层,用饱和氯化钠溶液(2×100 mL)洗涤,无水硫酸钠干燥,减压蒸除溶剂得红色固体,用乙酸乙酯重结晶得白色固体3 13.9 g,收率71%,m.p.150℃ ~152 ℃(152 ℃ ~153 ℃[13]);1H NMR δ:1.35(t,J=7.1 Hz,3H,CH3),3.89(s,3H,OCH3),4.37(q,J=7.1 Hz,2H,CH2),6.15(d,J=7.4 Hz,1H,ArH),7.48(d,J=7.4 Hz,1H,ArH),13.40(brs,1H,NH)(与文献[13]数据吻合);IR ν:3 116,2 987,1 720,1 637,1 546,1 476,1 440,1 329,1 255,1 178,1 133,1 088,761 cm-1。
(4)4的合成
在反应瓶中加入3 10.0 g(50 mmol),48%HBr 15 mL和水40 mL,搅拌下回流反应6 h。减压浓缩,残余物加水100 mL,用5 mol·L-1NaOH溶液调至 pH 8~9。抽滤,滤液用4 mol·L-1盐酸调至 pH 3~4,析出白色固体,过滤,滤饼用95%乙醇重结晶得白色固体4 4.6 g,收率83%,m.p.270 ℃ ~272 ℃(278 ℃[9]);IR ν:3 450,1 620,1 591,1 491,1 417,1 264,1 210,839,789 cm-1;1H NMR(DMSO-d6)δ:5.49(d,J=5.4 Hz,1H,ArH),5.77(q,J=5.8 Hz,1H,ArH),7.18(d,J=7.1 Hz,1H,ArH),10.46(s,1H,NH),10.92(s,1H,OH);EI-MSm/z:111(M+)。
2 结果与讨论
2.1 合成
在2的合成中,文献[13]采用将原料混合后直接加热。实验中我们发现该方法反应温度高,杂质点增多。改用二甲苯作溶剂,回流反应,不仅减少了副产物的产生,收率也提高至75%。
2经分子内环合得3,然后在HBr溶液中脱甲基和脱羧得4。实验中我们企图直接在酸性条件下将环合和脱羧两步反应通过一步反应来实现,然而薄层层析监控发现杂质点较多,分析其原因可能是在环合反应时首先是氰基部分水解为酰胺,然后酰胺N原子与双键反生反应4-甲氧基-2-吡啶酮-3-甲酸乙酯。若在HBr溶液中,氰基水解为羧酸,影响了环合反应的进行,造成副产物多,产物分离困难。为此,实验中我们采用先在醋酸中环合,而后在HBr中脱甲基和脱羧两步方法制备4,1H NMR 和 m.p.与文献[9]值相符。
[1]Jessen H J,Gademann K.4-Hydroxy-2-pyridone alkaloids:Structures and synthetic approaches[J].Nat Prod Rep,2010,27:1168 -1185.
[2]唐玉敏,李晶,赵圣印.4-羟基-2-吡啶酮类天然生物碱的研究进展[J].有机化学,2011,31:9 -21.
[3]赵圣印,黄婧,程建,等.4-羟基-2-吡啶酮类化合物的合成研究进展[J].有机化学,2012,32:651-660.
[4]Breda A,Machado P,Rosado L A,et al.Pyridin-2(1H)-ones based inhibitors of mycobacterium tuberculosis orotate phosphoribosyltransferase[J].Eur J Med Chem,2012,54:113 -122.
[5]Robins M J,Yang H,Miranda K,et al.Synthesis and biological evaluation of 3,3-difluoropyridine-2,4(1H,3H)-dione and 3-deaza-3-fluorouracil base and nucleoside derivatives[J].J Med Chem,2009,52:3018-3027.
[6]Jones I L,Moore F K,Chai C L L.Total synthesis of(±)-cordypyridones A and B and related epimers[J].Org Lett,2009,11:5526 -5529.
[7]赵圣印,李晶.N-甲基-4-羟基-5-苯基-2-吡啶酮的合成[J].合成化学,2012,20(6):740 -741.
[8]林志刚,闻韧,张建革,等.1-氨基-γ-咔啉衍生物合成方法的研究[J].中国药物化学杂志,2003,13:267-269.
[9]Shone R L,Coker V M,Moormann.A convenient synthesis of 4-hydroxy-2-pyridoine[J].J Heterocyclic Chem,1975,12:389 -390.
[10]Mttelbach M,Kastner G,Junek H.Syntheses with nitriles.LXXI.Synthesis of 4-hydroxynicotinic acid from butadienedicarbonitriles[J].Arch Pharm,1985,318:481-486.
[11]Yano S,Ohno T,Ogawa K.Convenient and practical synthesis of 5-chloro-4-hydroxy-2(1H)-pyridinone[J].Heterocycles,1993,36:145 - 148.
[12]Kasum B,Prager R H.A classical approach to the synthesis of perloline[J].Aust J Chem,1983,36:1455-67.
[13]Jessen H J,Schumacher A,Shaw T,et al.A unified approach for the stereoselective total synthesis of pyridone alkaloids and their neuritogenic activity[J].Angew Chem Int Ed,2011,50:4222 -4226.
[14]Yashii T,Hori I,Baba H,et al.Studies on geometric isomerism by nuclear magnetic resonance.I.stereochemistry of a-cyano-p-alkoxy-p-alkylacrylic esters[J].J Org Chem,1965,30:695 -699.
