Ac-SDKP对Ang II诱导的大鼠血管外膜成纤维细胞胶原合成的调节作用*
2013-03-25孔祥权王伟华
汪 婷,孔祥权,王伟华
(1.皖南医学院,安徽 芜湖241000;2.皖南医学院弋矶山医院急诊内科,安徽芜湖241000)
N-乙酰基-丝氨酰-天门冬酰-赖氨酰-脯氨酸(Ac-SDKP),是由Frindel等于1977年首次从胎牛骨髓中提取的一种生理性造血细胞生长抑制因子,是一种新的有效的抗器官纤维化的四肽。细胞外信号调节激酶(extracellular regulated protein kinase,ERK)1/2是促分裂素原活化蛋白激酶(mitogen-activated protein kinases,MAPK)系统主要的、经典的通路,近年来不断研究证实ERKl/2参与心、肝、胰、肾、肺等器官纤维化的发生发展[1-3]。然而,Ac-SDKP能否通过Ang II介导的ERKl/2信号转导途径的调节发挥其抗血管纤维化的作用,文献报道很少。本实验通过观察Ac-SDKP对Ang II诱导的血管成纤维细胞胶原合成及基质金属蛋白酶(matrix metalloproteinases,MMP)、转化生长因子β1(transforming growth factor-β1,TGF-β1)表达的影响,为探讨 AcSDKP的抗血管纤维化的可能机制提供一定的依据。
1 材料与方法
1.1 材料
6~8周雄性SD大鼠(皖南医学院实验动物中心提供),DEME培养液、胎牛血清、0.25%胰蛋白酶消化液,Ang II、Ac-SDKP、PD98059(Bachem AG公司,瑞士),Trizol,M-MLV逆转录酶(Toyobo公司,日本),Ⅰ型及Ⅲ型胶原单克隆抗体、MMP-2及MMP-9单克隆抗体、TGF-β1单克隆抗体(Sigma公司,美国),肌动蛋白单克隆抗体,波形蛋白单克隆抗体,VIII因子相关抗原多克隆抗体。
1.2 血管外膜成纤维细胞的差速贴壁分离培养及鉴定
取6~8周龄雄性SD大鼠(体质量160~180 g)颈椎脱臼法处死,分离大鼠胸主动脉外膜,切成大小约1mm大小的组织块,均匀贴于细胞培养瓶壁上,加入含20%血清的细胞培养液DMEM,置于培养箱中进行传代培养,约6~8周左右可见细胞围绕组织块生长至亚融合状态,用0.25%胰酶消化后传代[4],在倒置显微镜下观察放大的原代和消化传代后的血管外膜成纤维细胞,以波形蛋白为第一抗体染色时,培养细胞的胞浆内可见棕褐色阳性颗粒。而以肌动蛋白和Ⅷ因子作为第一抗体染色时,细胞内均无阳性颗粒表达,表明培养所得到的细胞为血管外膜成纤维细胞。将第二代培养的血管成纤维细胞调整同步化。
1.3 实验分组
将第二代细胞以1×108cells/L密度接种于放置无菌盖玻片的24孔培养板中,按照实验分组加入相应试剂,实验分为4组,即(1)对照组:为10%胎牛血清的DMEM培养液;(2)Ang II刺激组:10%胎牛血清的DMEM培养液中加入10-6mmo l/L的Ang II;(3)AcSDKP作用组:10%胎牛血清的DMEM培养液中加入 10-6mmo l/L的 Ang II,同时加入 10-9mmo l/L Ac-SDKP;(4)PD98059组:10%胎牛血清 DMEM培养液中加入 10-6mmo l/L的 Ang II、10-9mmo l/LAc-SDKP及 25μmmol/L PD98059。
1.4 血管外膜成纤维细胞胶原蛋白I、胶原蛋白III的检测
取培养液上清,用RT-PCR检测胶原蛋白I(Col I)、胶原蛋白 III(Col III)mRNA的表达。以 GAPDH内参照(202 bp),引物序列:正向引物 5’-CTCCACGACATACTCAGCA-3’;反向引物 5’-TGTTGCCATCAACGACCCCTT-3’。Col I引物序列(408 bp):正向引物 5’-AAGGCA ATGCTGAATCGTCC-3’;反向引物5’-TAGCACCTTTGATACCAAACTGC-3’;Col III引物序列 (298 bp):正 向 引 物 5’-AGAGCGGAGAATACTGGGTTG-3’;反向引物 5’-CAGTGG TATGTAATGTTCTGGGAG-3’产物经1.5%琼脂糖凝胶电泳,将电泳完毕的琼脂糖凝胶至于扫描仪上观察并照相,用图像分析软件分析,以各目的基因与GAPDH的比值表示mRNA水平。
1.5 血管外膜成纤维细胞MMP-2、TGF-β1的检测
用Western blot法将培养的血管外膜成纤维细胞裂解液裂解,离心,收集上清,按蛋白标准曲线测定上清中的蛋白含量,SDS聚丙烯酰胺凝胶电泳(每加样孔中蛋白上样量90μg),之后将凝胶进行转膜及MMP-2、TGF-β1印迹杂交(单克隆抗体稀释度均为1∶200,显色剂为 DAB)。对硝酸纤维膜上 MMP-2、TGF-β1条带进行灰度扫描(OD值),以对照组(10%FBS基础培养液组)的灰度值为1,实验组数据与对照组相比取值,经自动图像分析系统进行定量分析。
1.6 统计学分析
所有计量资料以均数±标准差(±s)表示,采用SPSS 11.0统计软件包进行分析,采用方差分析和t检验,并做相关分析。
2 结果
2.1 血管外膜成纤维细胞鉴定
在倒置显微镜下观察放大的原代和消化传代后的血管外膜成纤维细胞,波形蛋白染色为深棕色。
2.2 Col I、Col IIImRNA表达结果
如图1和表1所示Ang II孵育成纤维细胞24 h后可刺激血管外膜成纤维细胞合成分泌I、Ⅲ型胶原,与对照组相比,Ang II组 Col I、Col IIImRNA表达均明显增加,差异均有统计学意义(P<0.05)。Ac-SDKP组与 Ang II组相比,Col I、Col IIImRNA水平分别抑制 48.3%、50.5%(P<0.05),PD98059组则与Ang II组表达结果相似,两者相比差异无统计学意义。
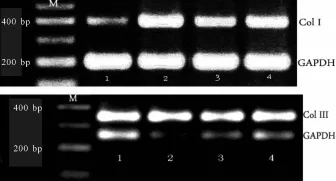
Fig.1 Expression of type I、IIIcollagenmRNA in vascular adventitial fibroblasts(RT-PCR)
2.3 Western blot测定蛋白的表达结果
2.3.1 Ac-SDKP对 MMP-2表达的影响 用 Ang II刺激24 h后,MMP-2蛋白表达水平明显下调,较对照组分别降低62%(P<0.05,图2),Ac-SDKP能显著的上调由Ang II抑制的MMP-2蛋白表达,与Ang II相比差异有统计学意义(P<0.05),PD98059组与Ang II组蛋白表达相近,差异无统计意义(P>0.05)。
Tab.1 Changes of Col Iand Col III relative expression levels in different group(±s,n=3)

Tab.1 Changes of Col Iand Col III relative expression levels in different group(±s,n=3)
Ang II:Angiotensin II;Ac-SDKP:N-Acetyl-Ser-Asp-Lys-Pro;Col:Collagen;PD98059:MAPK inhibitor*P<0.05 vs control group;#P<0.05 vs Ang IIgroup
Group Col I/GAPDH Col III/GAPDH Control 0.28±0.03 0.40±0.11 Ang II 0.87±0.21* 0.93±0.27*Ac-SDKP 0.45±0.07# 0.46±0.09#PD98059 0.69±0.12 0.76±0.18
2.3.2 Ac-SDKP对 TGF-β1蛋白表达的影响 AngII能显著刺激 TGF-β1蛋白表达水平(P<0.05,图 2),与Ang II组相比,Ac-SDKP能抑制由Ang II刺激的TGF-β1蛋白表达,其 OD值下降41%(P<0.05)。
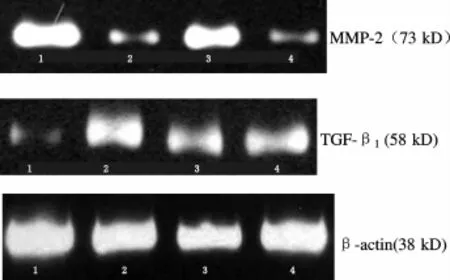
Fig.2 Expression of MMP-2,TGF-β1 protein in different group
3 讨论
肾素-血管紧张素-醛固酮系统(RAAS)在心血管疾病的发生发展以及疾病的预后和并发症的发生中,都起着重要的作用。血管紧张素II(Ang II)是RAAS的主要效应分子。Ang II及其受体在大多数疾病中表达增加,对心血管的损害作用,主要是导致心血管纤维化。
Ac-SDKP是一种多功能生理调控因子。早期报道,Ac-SDKP可以通过阻止原始造血干细胞进入S期,使其静止在Go期,而抑制造血干细胞的活性,作为癌症放疗、化疗时的造血保护剂应用于临床。后来研究发现Ac-SDKP在调节胶原的合成与代谢方面也发挥着重要作用[2、3、5-7],对抗器官纤维化有着潜在的临床应用价值。Ac-SDKP也具有显著的促血管生成作用,Liu等[8]发现Ac-SDKP可以诱导血管平滑肌的形成,在血管形成过程中起介导作用。本实验中我们通过Ang II诱导的血管外膜的研究显示,Ang II可刺激血管外膜成纤维细胞分泌胶原蛋白,增加促纤维化因子TGF-β1的表达,在体内TGF-β1可参与胶原的合成,可以不同方式增加多种细胞外基质的含量,增加成纤维细胞胶原的表达,说明Ang II可通过加强其他生长因子而起作用;而Ac-SDKP组中Col I、Col IIImRNA水平分别抑制48.3%、50.5%,MMP-2水平显著下调,说明Ac-SDKP可显著抑制Ang II刺激的Col I、Col III合成分泌,并通过上调MMP来增加胶原的降解。通过Ang II组与Ac-SDKP作用组相比较,Ac-SDKP组 TGF-β1的表达较Ang II组下调41%,可说明Ac-SDKP可下调Ang II刺激的 TGF-β1的表达,降低 Ang II与 TGF-β1的协同作用[10]。
ERKl/2信号级联通路是一条可被广泛激活的MAPK通路,它能将细胞外信号传递到细胞核内,引起胞内特异性蛋白的表达谱变化,从而影响细胞的功能和作用,是许多胞外刺激的共同途径。ET、Ang II、TGF-β1、血小板源性生长因子(PDGF)等均能激活ERKl/2信号转导通路。Rhaleb等[9]对 ERKl/2通路在Ac-SDKP抑制内皮素-1(ET-1)诱导的心脏成纤维细胞DNA和胶原蛋白表达中的作用进行了研究,推测Ac-SDKP对ET-1诱导的心脏成纤维细胞增殖及胶原表达的抑制作用部分依赖于ERKl/2通路的阻断。本实验中我们通过ERKl/2通道阻断剂来观察Ac-SDKP对ERK1/2信号转导途径的调节在血管纤维化形成过程中的作用,结果显示,PD98059组中Col I、Col IIImRNA表达,MMP-2及 TGF-β1蛋白表达均与 Ang II组相似,差异无统计学意义,表明PD98059阻断Ac-SDKP作用的信号转导通路,提示,Ac-SDKP可能抑制Ang II刺激的ERKl/2信号转导通路而发挥作用。
[1] Nagai Y,Miyata K,Sun G P,et al.Aldosterone stimulates collagen gene expression and synthesisviaactivation of ERK1/2 in rat renal fibroblasts[J].Hypertension,2005,46(4):1039-1045.
[2] 张丽娟,马文东,杨 嫣,等.细胞外信号调节激酶1/2在抗纤维化短肽AcSDKP调节大鼠心脏成纤维细胞增殖和胶原表达中的作用[J].中华心血管病杂志,2008,36(5):444-448.
[3] 杨 方,李丹丹,张丽娟,等.ERK1/2通路在AcSDKP抑制PDGF诱导的大鼠肺成纤维细胞增殖和胶原合成中的作用[J].中华劳动卫牛职业病杂志,2009,27
(7):385-389.
[4] 马彦军,林家冲,杨 絮,等.大鼠胸主动脉外膜成纤维细胞的培养方法初探[J].汕头大学医学院学报,2011,12(01):51-53.
[5] Sun Y,Yang F,Yan J,etal.New anti-fibroticmechanisms ofn-acetyl-seryl-aspartyl-lysyl-proline in silicon dioxide-induced silicosis[J].Life Sci,2010,87(7-8):232-239.
[6] Chen Y W,Liu BW,Zhang Y J,et al.Preservation of basal AcSDKP attenuates carbon tetrachloride-induced fibrosis in the rat liver[J].JHepatol,2010,53(3):528-536.
[7] Ponticos M,Holmes A M,Shi-wen X,et al.Pivotal role of connective tissue growth factor in lung fibrosis:MAPK-dependent transcriptional activation of type Icollagen[J].ArthritisRheum,2009,60(7):2142-2155.
[8] Liu JM,Lawrence F,Kovacevic M,et al.The tetrapeptide AcSDKP,an inhibitor of primitive hematopoietic cell proliferation induces angiogenesisin vitroandin vivo[J].Blood,2003,101(8):3014-3020.
[9] Rhaleb N E,Peng H,Yang X P,et al.Long-term effect of N-acety1-seryl-aspartyl-lysyl-proline on left ventricular collagen deposition in rats with 2-kidney,1-clip hypertension[J].Circulation,2001,103(25):3136-3141.
[10] Wang W,Huang X R,Canlas E,et al.Essential role of Smad 3 in angiotensinII-induced vascular fibrosis[J].Circ Res,2006,98(8):1032-1039.
