M 8046对神经病理性疼痛大鼠脊髓和背根节COX-2/PGE2表达的影响*
2013-03-25欧国昆王睿娴李佳佳连庆泉
欧国昆,王睿娴,李佳佳,曹 红,连庆泉,李 军
(温州医学院附属第二医院麻醉科,浙江温州325027)
神经病理性疼痛是一种难治性慢性疼痛,常表现为自发性疼痛、异常性疼痛及痛觉过敏,疼痛本身是一种应激因素,可以诱导疼痛的易感性增强和加重疼痛的发生发展[1]。应激反应激活下丘脑-垂体-肾上腺轴,造成糖皮质激素分泌增加,中枢神经系统的糖皮质激素受体(glucocorticoid receptor,GR)表达上调,糖皮质激素与分布于脊髓的GR结合后对神经病理性疼痛的调节起到关键的作用[2]。前列腺素E2(prostaglandin E2,PGE2)作为重要的炎症和促伤害介质,在外周和中枢敏化方面均起着十分重要的作用。环氧合酶-2(cyclooxygenase-2,COX-2)则是以花生四烯酸(arachidonicacid,AA)为底物生成前列腺素途径的关键酶。CCI(chronic constrictive injury,CCI)模型[3]是一种应用广泛、可操作性强的神经病理性疼痛动物模型。M8046是一种新型的GR拮抗剂,其对疼痛的影响及对脊髓COX-2、PGE2的影响尚未见报道。本研究拟采用CCI模型探讨M8046对神经病理性疼痛大鼠行为学及COX-2、PGE2表达的影响,旨在阐明M8046减缓神经病理性疼痛的相关机制。
1 材料与方法
1.1 材料
M8046(M8046-100MG)购自美国 Sigma公司,兔抗COX-2抗体(250609)购自美国 Abbiotec公司,兔单克隆抗体(PV-6001)购自北京中杉金桥公司,大鼠PGE2ELISA试剂盒(201105232)购自上海西唐生物科技有限公司,336爪/尾刺激痛觉测试计及2390 ELECTRO von-Frey测痛计购自美国ⅡTC公司,显微镜(CX41-12L02)购自日本 Olympus公司,显微荧光照相系统(Nikon E-800)购自日本Nikon公司。
1.2 动物选择与分组
选用清洁级雄性SD大鼠144只,体重220~250 g,由温州医学院实验动物中心提供,采用随机数字表法,将大鼠分为 4组(n=36):假手术组(Sham组)、模型对照组(CCI组)、M8046处理组(M8046组)及溶剂对照组(SC组)。
1.3 大鼠神经病理性疼痛模型的制备
参照 Bernett法[3]制备 CCI大鼠模型:腹腔注射5%水合氯醛400 mg/kg麻醉下,于大鼠右后肢切开皮肤,钝性分离肌肉,暴露坐骨神经,用4-0号铬制羊肠线在坐骨神经分叉前间隔1mm打4次松结,松紧度以大腿肌肉或足趾轻微抽动为度,CCI大鼠术后3 d机械缩足反射阈值(PMWT)和热缩足反射潜伏期(PTWL)下降30%以上,且出现术侧爪内收,后足轻度外翻和跛行,显示模型成功可进入实验,否则予以剔除。而Sham组仅暴露坐骨神经不作结扎,其余操作相同。
1.4 大鼠机械缩足反射阈值(PMWT)和热缩足反射潜伏期(PTWL)的测定
于术前 1 d及术后 1、3、7、10、14 d测定各组大鼠PMWT和PTWL。将大鼠置于机械测痛计的铁丝网架上,待30 min大鼠安静后,使用2390 ELECTRO von Frey测痛计刺激大鼠右后足掌心,加压至逃避性抬腿或右后肢抽动,记录抬腿时施加于大鼠足底的最大力度(g),重复5次,间隔5 min,取平均值即为PMWT。336爪/尾刺激测痛仪测定各组大鼠PTWL值。仪器发射辐射光照射大鼠右后足底,安静大鼠逃避性抬腿时,立刻切断热源记录开始照射至出现缩足逃避反射时间(s),重复3次,间隔10~15 min,取平均值即为PTWL,照射截止时间为25 s,以防大鼠足底灼伤。
1.5 免疫组织化学法测定脊髓和背根神经节COX-2的表达
大鼠分别于术后3、7、14 d三个时间点在麻醉下经主动脉灌注生理盐水100ml,继而灌注4%多聚甲醛400 ml处死,制作SD大鼠 L4~5脊髓背角和背根神经节(dorsal root ganglion,DRG)石蜡切片,60℃烤片后二甲苯梯度酒精脱蜡,PBS冲洗后抗原高压热修复,离开热源自来水流水冷却。3%过氧化氢封闭 30min,滴加 1∶200的一抗,4℃孵育 24 h,室温复温30min,滴加二抗37℃水浴孵育30 min后PBS冲洗,DAB显色,苏木素轻度复染5min,盐酸化酒精酸化2 s,酒精梯度脱水,二甲苯透明,中性树胶封片,晾干后光镜观察。每只动物分别取20张脊髓背角和20张背根节切片,顺序3张选1张在高倍镜下对脊髓背角及背根神经节截图,采用 Image-Pro 5.1图像分析软件对COX-2阳性细胞进行染色光密度分析。
1.6 ELISA法测定大鼠脊髓组织PGE2的表达
大鼠分别于术后3、7、14 d三个时间点取脊髓组织,按每100 mg脊髓组织加4 ml生理盐水的比例,将脊髓组织用微量研磨器磨碎制成匀浆液,将匀浆液进行30倍稀释后用ELISA试剂盒检测,按试剂盒说明进行操作,终止反应后用酶标仪在450 nm处测样本的光密度值,并绘制标准曲线,最后换算出脊髓组织中PGE2的含量。
1.7 统计学处理
所有数据以均数±标准差(±s)表示,采用SPSS 16.0统计软件分析,组间比较采用单因素方差分析(one-factor ANOVA),继以最小显著差异法(LSD)行两两比较。
2 结果
2.1 腹腔注射 M 8046对 CCI大鼠 PTWL和PMWT的影响
各组间行为学的基础值差异不显著(P>0.05)。Sham组大鼠术后未出现术侧爪内收和运动障碍,且各时间点PTWL和PMWT变化差异无显著性。CCI组PTWL和PMWT从术后第1天开始下降,在第3天降至最低值,与基础值相比较,差异显著(P<0.05),与 Sham组相比,CCI组术后各时间点PTWL和 PMWT明显降低(P<0.05);M8046组大鼠术后PTWL和PMWT亦开始下降,在术后第3天降至最低。与CCI组相比,PTWL、PMWT均从术后第3天开始有明显升高(P<0.05),表明腹腔持续注射M8046能缓解CCI大鼠热痛觉及机械痛觉过敏;SC组与CCI组各时间点PTWL与PMWL变化差异不显著(P>0.05,表 1、2)。
Tab.1 Changes of paw thermalwithdrawal(PTWL)in four groups of rats(s,±s,n=12)

Tab.1 Changes of paw thermalwithdrawal(PTWL)in four groups of rats(s,±s,n=12)
CCI:Chronic constrictive group;M8046:Glucocorticoid receptor antagonist;SC:Solvent controlled group*P<0.05 vs Sham;#P<0.05 vs CCI
Group Pre-2 d 1 d 3 d 7 d 10 d 14 d Sham 12.2±3.9 10.8±3.5 11.4±2.8 12.4±2.0 11.1±2.6 11.8±2.4 CCI 12.7±3.3 9.0±3.5* 6.3±2.0* 6.0±2.5* 5.9±1.0* 7.3±2.3*M8046 12.7±1.7 9.7±2.9 8.9±1.6*# 9.5±2.2# 10.1±1.5# 10.2±1.7#SC 12.7±4.5 8.9±3.9 7.2±3.3 6.3±1.9 6.5±2.9 6.7±3.2
Tab.2 Changes of pawmechanicalwithdrawal threshold(PMWT)in four groups of rats(s,±s,n=12)

Tab.2 Changes of pawmechanicalwithdrawal threshold(PMWT)in four groups of rats(s,±s,n=12)
CCI:Chronic constrictive group;M8046:Glucocorticoid receptor antagonist;SC:Solvent controlled group*P<0.05 vs Sham;#P<0.05 vs CCI
Group Pre-2 d 1 d 3 d 7 d 10 d 14 d Sham 42.3±10.2 34.6±8.4 31.6±7.2 32.0±7.7 32.5±10.4 35.3±9.5 CCI 43.0±7.6 26.3±8.2* 19.6±5.8* 16.2±3.2* 16.1±3.6* 15.8±3.6*M8046 44.4±5.2 28.1±7.2* 26.4±5.6*# 29.4±8.0# 34.1±8.7# 34.4±7.5#SC 43.4±9.4 24.9±9.8 16.9±3.7 17.5±4.3 14.7±3.4 16.3±4.8
2.2 腹腔注射M 8046对CCI大鼠的脊髓背角和背根节COX-2表达的影响
Sham组大鼠术侧脊髓背角有少量COX-2阳性细胞表达,与 Sham组相比,CCI组术侧COX-2阳性细胞表达显著增多(P<0.05),术后第3天表达达到高峰,随后下降,而第14天达到另一个高峰;M8046组术侧COX-2阳性细胞表达趋势与CCI组的变化一致,但与 CCI组相比,表达明显减少(P<0.05);SC组术侧 COX-2阳性细胞表达与 CCI组基本一致,两组差异不显著(P>0.05,表 3)。腹腔注射M8046对CCI引起背根神经节与脊髓背角的COX-2表达影响结果一致。
Tab.3 Changes of the number of COX-2 positive cells in spinal dorsalhorn and dorsal rootganglion in four groups of rats(s,±s,n=6)

Tab.3 Changes of the number of COX-2 positive cells in spinal dorsalhorn and dorsal rootganglion in four groups of rats(s,±s,n=6)
COX-2:Cyclooxygenase-2;CCI:Chronic constrictive group;M8046:Glucocorticoid receptor antagonist;SC:Solvent controlled group*P<0.05 vs Sham;#P<0.05 vs CCI
Group Spinal dorsal horn 3 d 7 d 14 d Dorsal rootganglion 3 d 7 d 14 d Sham 21.3±5.1 10.5±3.4 15.0±3.5 11.9±3.0 8.0±2.2 5.1±2.4 CCI 50.0±13.8* 31.3±6.1* 53.0±9.9* 16.2±3.0* 24.4±7.6* 24.5±4.9*M8046 25.0±5.8# 12.7±3.1# 25.3±5.5# 12.0±2.2# 13.0±2.6*# 9.5±2.5#SC 47.2±10.2 33.9±8.6 46.3±10.0 16.5±2.9 24.5±3.7 25.5±2.8
2.3 腹腔注射 M 8046对 CCI大鼠的脊髓组织PGE2的影响
Sham组大鼠脊髓组织有少量 PGE2表达,与Sham组相比,CCI组从第7天开始表达显著增多(P<0.05),术后第 14天表达达到高峰;与 CCI组相比,M8046组的 PGE2表达明显减少(P<0.05);SC组术侧PGE2表达与CCI组基本一致,两组差异不显著(P>0.05,表 4)
3 讨论
本研究选择Bennett法制备CCI模型,作为一种经典的神经病理性疼痛模型,大鼠可产生明显的热痛觉过敏和机械异常性疼痛,其机制为外周神经损伤和炎症反应诱发的神经病理性改变,模拟了临床上较为常见的外周神经压迫所引起的神经病理性疼痛。
Tab.4 Changes of PGE2 in spinal tissues in four groups of rats(pg,±s,n=6)
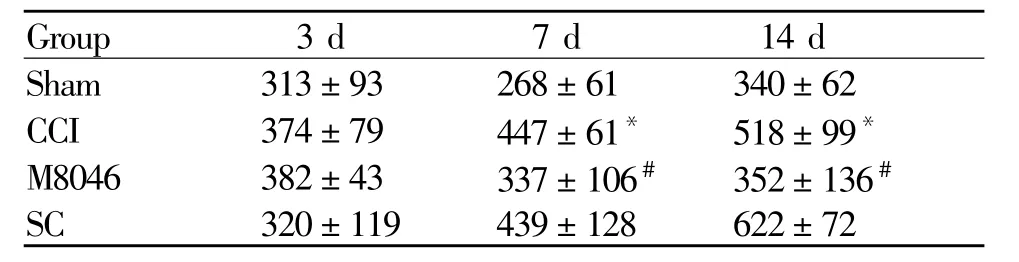
Tab.4 Changes of PGE2 in spinal tissues in four groups of rats(pg,±s,n=6)
PGE2:Prostaglandin E2;CCI:Chronic constrictive group;M8046:Glucocorticoid receptor antagonist;SC:Solvent controlled group*P<0.05 vs Sham;#P<0.05 vs CCI
Group 3 d 7 d 14 d Sham 313±93 268±61 340±62 CCI 374±79 447±61* 518±99*M8046 382±43 337±106# 352±136#SC 320±119 439±128 622±72
本实验CCI术后大鼠出现术侧跛行,自发性抬腿和舔足等行为,且对热和机械刺激产生明显的疼痛反应,实验中观察到CCI组术后第1天PTWL和PMWT已明显下降,术后第3天大鼠PTWL和PMWT都较术前下降,为基础值的49.6%和45.6%,此后继续保持痛敏状态,与文献报道[4]相似,表明模型制备成功。
前列腺素是广泛存在于动物和人体内的一组重要的组织激素,在疼痛的产生和发展过程中发挥重要作用,其中最主要的是PGE2。鞘内注射PGE2诱发痛觉过敏及触诱发痛,症状与患者神经病理性疼痛临床表现非常相似[5],而 PGES-1-/-基因敲除小鼠神经病理性疼痛症状消失[6],表明PGE2参与诱发和/或维持阶段神经病理性疼痛的形成。PGE2在DRG中能够通过激活河豚毒素抵抗的钠通道及电压依赖性钙通道直接兴奋DRG神经元,通过抑制钾通道、促进谷氨酸、P物质等的释放,PGE2还可以增强背根神经节对缓激肽和辣椒素的敏感性诱发谷氨酸、P物质等释放增多[7]。上述表明PGE2在脊髓痛信息的处理过程中以及脊髓敏化的发展和维持中起重要的作用。PGE2的合成依赖于限速酶COX-2,后者呈诱导性表达,生理状态下大多数组织不表达,在细胞外网状结构和细胞核边缘起作用,对许多炎症过程起反应。Freshwater等[8]在糖尿病所致神经病理性疼痛模型中发现脊髓COX-2表达明显增加,痛觉过敏与COX-2、PGE2的表达、释放增加有关。
本实验通过建立CCI神经病理性疼痛模型,运用免疫组织化学及ELISA技术,发现CCI组术后第3、7、14天脊髓背角及背根神经节中COX-2的表达明显升高,而PGE2于术后第7天表达明显增加,说明大鼠坐骨神经结扎所致疼痛引起PGE2的表达相对于COX-2的表达有一定的滞后性。
有研究发现,GR在周围神经损伤后表达上调,用GR的拮抗剂RU486可以减轻神经病理性疼痛中出现的异常性疼痛和痛觉增敏,梯度给予糖皮质激素受体拮抗剂RU486可剂量依赖地减缓CCI所致神经病理性疼痛[2]。
本实验使用新型糖皮质激素受体拮抗剂M8046腹腔注射具有与RU486相似的减缓大鼠CCI神经病理性疼痛的作用。目前一般认为GR与神经病理性疼痛的形成有关。在脊髓,GR存在于背角神经元,这个区域负责疼痛的传递。GR在神经病理性疼痛的机制尚不完全清楚,但一些现象值得注意:(1)大鼠外周神经损伤可增加糖皮质激素浓度,肾上腺切除可消除神经损伤诱导的神经病理性疼痛样的行为;(2)皮质酮可延长海马神经元的N-甲基-D-天门冬氨酸(N-methyl-D-aspartic acid,NMDA)受体中介的Ca2+升高;(3)在脊髓索NMDA受体中介神经病理性疼痛,鞘内注射NMDA受体激动剂剂量依赖性地上调COX-2的表达,而NMDA受体拮抗剂MK801处理后COX-2的表达显著减少[9],进一步表明NMDA受体能够直接调节COX-2在脊髓中的表达。然而,上调的NMDA受体则因鞘内注射GR拮抗剂而下降[10],提示NMDA受体作为GR的下游因子并受其调节。
本研究证实糖皮质激素受体拮抗剂M8046处理后COX-2及其催化产物PGE2的表达均明显降低,推测COX-2参与神经病理性疼痛的应激过程。
综上所述,腹腔注射M8046可减轻CCI大鼠热痛觉过敏和机械痛觉过敏,其机制可能与抑制疼痛引起的应激反应,通过拮抗 GR受体后,GR下调NMDA受体表达,进而减少致痛物质COX-2/PGE2的产生有关。
[1] Nicholson K,MartelliM F.The problem of pain[J].JHead Trauma Rehabil,2004,19(1):2-9.
[2] Wang S,Lim G,Zeng Q,etal.Expression of centralglucocorticoid receptors after peripheral nerve injury contributes to neuropathic pain behaviors in rats[J].JNeurosci,2004,24(39):8595-8605.
[3] Bennett G J,Xie Y K.A peripheralmononeuropathy in rat that produces disorders of pain sensation like those seen in man[J].Pain,1988,33(1):87-107.
[4] Kurpius D,Wilson N,Fuller L,et al.Early activation,motility,and homing of neonatalmicroglia to injured neurons does not require protein synthesis[J].Glia,2006,54(1):58-70.
[5] ParrisW C,Janicki PK,Johnson B,et al.Intrathecal ketorolac tromethamine produces analgesia after chronic constriction injury of sciatic nerve in rat[J].Can J Anaesth,1996,43(8):867-870.
[6] Mabuchi T,Kojima H,Abe T,et al.Membrane-associated prostaglandin E synthase-1 is required for neuropathic pain[J].Neuroreport,2004,15(9):1395-1398.
[7] Vanegas H,Schaible H G.Prostaglandins and cycloxygenases in the spinal cord[J].Prog Neurobiol,2001,64(4):327-363.
[8] Freshwater JD,Svensson C I,Malmberg A B,et al.Elevated spinal cyclooxygenase and prostaglandin release during hyperalgesia in diabetic rats[J].Diabetes,2002,51(7):2249-2255.
[9] Li SQ,Xing Y L,Chen W N,et al.Activation of NMDA receptor is associated with up-regulation of COX-2 expression in the spinal dorsal horn during nociceptive inputs in rats[J].Neurochem Res,2009,34(8):1451-1463.
[10] Wang S,Lim G,Zeng Q,et al.Central glucocorticoid receptorsmodulate the expression and function of spinal NMDA receptors after peripheral nerve injury[J].JNeurosci,2005,25(2):488-495.
