巨核细胞蛋白质酪氨酸磷酸酶2的克隆表达及其与骨质疏松症的关系
2013-03-23张师桃曾晛阳张小平郝凡凡李婉南付学奇
张 蕾,张师桃,曾晛阳,张小平,郝凡凡,王 丰,李婉南,付学奇
(1.吉林大学生命科学学院Fischer细胞信号转导实验室,吉林 长春 130012;2.吉林大学中日联谊医院妇产科,吉林 长春 130033)
蛋白质酪氨酸磷酸酶(protein tyrosine phosphatases,PTPs)与蛋白质酪氨酸激酶(protein tyrosine kinases,PTKs)协同作用控制着蛋白质酪氨酸的磷酸化过程,调节细胞生长发育,并在细胞信号传导过程中发挥重要作用[1-2],许多生理及病理现象均与二者的异常表达相关[3]。巨核细胞蛋白质酪氨酸磷酸酶2(megakaryocyte protein tyrosine phosphatase 2,PTPMEG2)也称为PTPN9,是一种在细胞内广泛分布的酶,最初从人的巨核细胞MEG-01和脐静脉内皮细胞cDNA文库中克隆获得[4]。PTPMEG2与其他的细胞质PTP有所不同,PTPMEG2的表达使其在分泌小泡中积累。研究[5]表明:分泌小泡的融合和增殖均依赖于PTPMEG2的活性调节,说明PTPMEG2在分泌小泡的生物发生过程中发挥重要作用。虽然PTPMEG2在细胞中广泛分布,但到目前为止对PTPMEG2功能的研究还很少。
骨质疏松症(osteoporosis,OP)是以低骨量及骨组织微结构退变为特征的一种全身性代谢性骨疾病,伴有骨脆性增加和骨强度降低,易发生骨折等现象。目前已有研究[6]表明:PTPs的活性对破骨细胞的形成和功能有重要作用。PTPs是参与骨代谢中破骨细胞和成骨细胞活动的一个重要因素,低相对分子质量的PTPs对成骨细胞活动发挥重要作用[7]。但是目前尚未见有关PTPMEG2与骨质疏松症关系方面的研究报道。PTPMEG2主要调控某些免疫细胞及造血细胞的功能,而这些细胞在骨髓内的功能发挥均依赖于骨髓基质细胞(bone marrow stromal cells,BMSCs),这正是骨组织的来源及骨质疏松症的发病根源。因此本文作者推测PTPMEG2与骨质疏松症间可能存在着一定的联系。本研究探讨PTPMEG2的表达及其与骨质疏松症的关系,旨在为骨质疏松症的治疗提供理论依据。
1 材料与方法
1.1 实验动物和主要试剂 新西兰大白兔购于吉林大学基础医学院动物中心,动物合格证号:SCXK-(吉)2008-0005。雌性SD大鼠购于吉林省中医研究所动物实验中心,动物合格证号:SCXK-(吉)2007-0003。对硝基苯磷酸二钠(pNPP)、Tryptone、Yeast Extract、Q-Sepharose Fast Flow和SP-Sephadex购于Sigma公司。二硫苏糖醇(DTT)、(不)完全弗氏佐剂、碱性磷酸酶(ALP)试剂盒和酸性磷酸酶(ACP)试剂盒购于鼎国生物技术公司。
1.2 PTPMEG2催化结构域的分离纯化 编码PTPMEG2蛋白催化结构域重组体质粒由美国俄克拉荷马大学赵志壮博士惠赠,将其连接到含有EcoRⅠ酶切位点的表达载体pT7上,重组体pT7-PTPMEG2质粒转化到大肠杆菌DE3细胞中进行高效表达,并于LB+Amp培养基中扩大培养。PTPMEG2重组蛋白的可溶性部分通过Q-Sepharose Fast Flow和SP-Sephadex 2种离子交换柱层析进行分离纯化。其主要过程为PTPMEG2蛋白的菌液上清Q-Sepharose Fast Flow离子交换柱后,用不同浓度的NaCl Buffer Q溶液洗脱,同时以pNPP作为底物活性跟踪收集洗脱液。收集这部分洗脱液上SP-Sephadex离子交换柱,用不同浓度的NaCl Buffer S溶液洗脱,以pNPP作为底物活性跟踪收集蛋白洗脱液。测定蛋白纯度及酶的比活力。
1.3 多克隆抗体制备 将纯化后的PTPMEG2催化结构域冻干粉用0.2mol·L-1、pH 7.0的PBS溶解,蛋白浓度调节为1g·L-1,与等体积的完全弗氏佐剂混合、乳化,乳化时间约为30min,通过家兔背部皮下多点注射法进行免疫,在基础免疫的2周后,每隔7d进行1次加强免疫,共进行3次,最后一次免疫7d后采集血清样本。采血前家兔需禁食12h,但不禁水。将抗体血清分别按体积比稀释,于PVDF膜上点样,采用ECL显色实验检测抗体效价。抗原蛋白浓度调节到10g·L-1,10倍梯度稀释,于PVDF膜上点样,采用ECL显色实验检测抗原对抗体的灵敏度。
1.4 建立骨质疏松症动物模型 30只雌性SD大鼠,体质量约为200g,随机分为模型组(n=15)和对照组(n=15),记录体质量。对照组大鼠采用生理盐水灌胃,灌胃量为10mL·kg-1·d-1;模型组大鼠采用7g·L-1维甲酸溶液灌胃,灌胃量为10mL·kg-1·d-1,持续给药3周,其间每天记录大鼠的形态并称量体质量。如果大鼠骨脆性增加,ACP和ALP表达水平超出正常范围,说明建模成功。
1.5 检测大鼠血清中ACP和ALP水平 对照组及模型组大鼠建模前后均进行12h断食,然后采集血清,用试剂盒检测大鼠血清中ACP和ALP表达水平,比较2组大鼠在建模前后血清中ACP和ALP表达水平的变化。
1.6 骨组织提取、培养BMSCs 处死大鼠,将其浸入75%酒精中消毒10min,在无菌条件下分别取大鼠的股骨及胫骨,去除周围肌肉及软组织,于75%酒精中保存,比较2组大鼠腿骨形态上的差异并记录。提取大鼠其他组织(肝、脾、肾、肺、大脑、肌肉及卵巢),PBS清洗外周残余血,加入适量Buffer A溶液研磨,于4℃、15000r·min-1离心15min,取上清备用,沉淀部分于-70℃冻存。取大鼠股骨置于平皿中,DMEM培养基对其进行冲洗,用灭菌的剪刀剪去股骨两端,再向股骨中注射培养基,使BMSCs被冲至另一平皿中,收集细胞液。1000r·min-1离心5min,加入3mL 0.83%的氯化铵溶液,用于红细胞裂解。振荡10min,1000r·min-1离心5min,PBS清洗2次,1000r·min-1离心5min,取上清备用。沉淀部分加入10mL DMEM,转移中至培养皿中,于37℃、5%CO2细胞培养箱中培养。每天记录细胞形态,定期更换培养基,21d后,取细胞用胰酶进行消化,并用Buffer A处理后备用。
1.7 检测PTPMEG2的表达水平 取大鼠上述组织用Buffer A提取组织细胞,将蛋白浓度调至2g·L-1,进行SDS-PAGE电泳,转膜后进行Western blotting检测。比较2组大鼠各组织中PTPMEG2表达水平的差异。
1.8 检测骨髓细胞(BMCs)、骨髓红细胞及BMSCs中PTPMEG2的表达水平 将提取的BMSCs的蛋白浓度调整为1g·L-1,经SDS-PAGE电泳,转膜后进行Western blotting检测。比较2组大鼠BMCs、骨髓红细胞及BMSCs中PTPMEG2表达水平的差异。
1.9 统计学分析 采用SPSS 17.0统计学软件进行数据分析。大鼠血清中ACP和ALP表达水平以表示,组间比较采用t检验。
2 结 果
2.1 PTPMEG2催化结构域蛋白的分离纯化 经Q-Sepharose Fast Flow离子交换柱后,活性跟踪发现目的蛋白主要存在于0.05~0.10mol·L-1NaCl Buffer Q的洗脱液中。收集这部分洗脱液上SP-Sephadex离子交换柱,活性跟踪发现目的蛋白主要存在于0.2mol·L-1NaCl Buffer S的洗脱液中。将各纯化步骤的收集液进行SDS-PAGE电泳检测,凝胶成像分析显示:在0.2mol·L-1NaCl Buffer S的洗脱液中目的蛋白的纯度为94.8%。见图1。
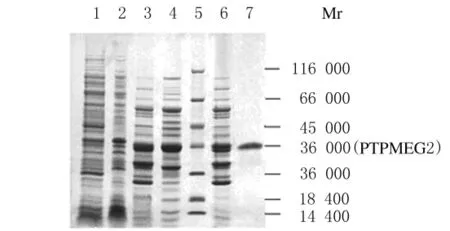
图1 PTPMEG2催化结构域蛋白的纯化Fig.1 Purification of PTPMEG2
2.2 PTPMEG2多克隆抗体效价及抗原对抗体的灵敏度 PTPMEG2免疫前效价很低,仅在稀释比为1∶1时可见特异性结合(图2A)。经PTPMEG2免疫后,效价明显升高,抗体效价可达到1∶10000(图2B)。当PTPMEG2抗原量为10ng时,仍可与抗体特异性结合(图2C)。
2.3 骨质疏松症模型大鼠大体观察 模型组大鼠维甲酸灌胃给药后表现出行动迟缓、食欲下降、脱毛等现象,体质量增长幅度也表现出下降的趋势;对照组大鼠平均体质量增加47.44g,模型组大鼠平均体质量增加21.12g(2只死亡)。见图3(封二)。
2.4 大鼠血清中ACP和ALP表达水平 模型组大鼠血清中ACP及ALP表达水平在建模后均明显升高(P<0.01),而对照组无明显变化。建模后模型组大鼠血清ACP和ALP表达水平均高于对照组(P<0.01)。见表1。
2.5 2组大鼠股骨和胫骨形态及脆度 在相同条件下,建模后大鼠的股骨和胫骨破碎数量较多,与其ACP和ALP表达水平的显著升高相对应。见图4(封二)。
2.6 大鼠BMSCs的形态学改变 取建模前后大鼠股骨及胫骨的骨髓,培养BMCs,培养3d左右,开始有贴壁的纺锤形细胞出现(图5,见封二),继续培养21d后,可出现大量贴壁的BMSCs。
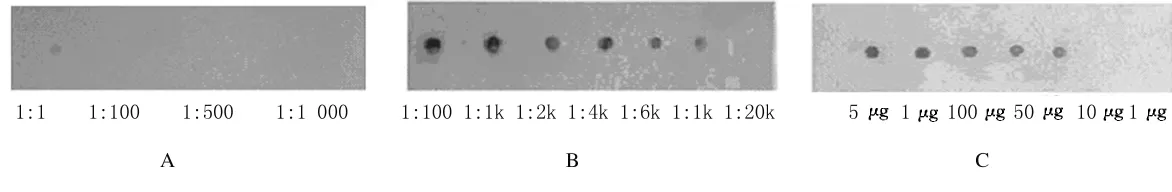
图2 免血清PTPMEG2免疫前(A)、免疫后(B)效价和PTPMEG2蛋白灵敏度(C)Fig.2 Titers of rabbit serum PTPMEG2before immunization(A)and after immunization(B)and sensitivity of PTPMEG2 protein(C)
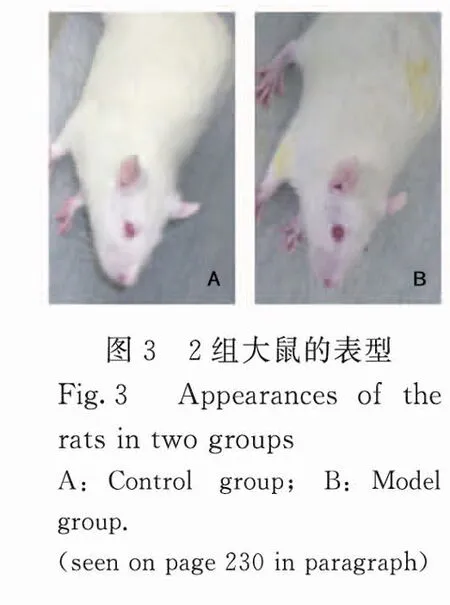
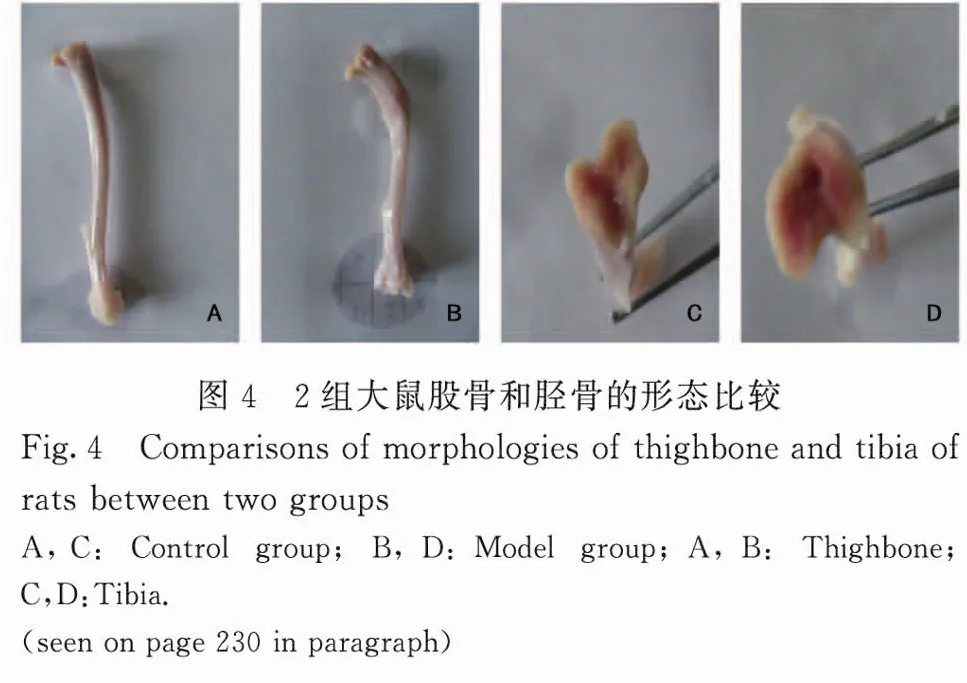
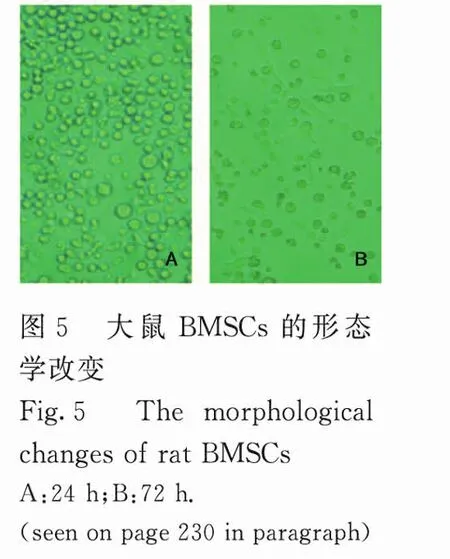
表1 2组大鼠血清ACP和ALP表达水平比较Tab.1 Comparison of rat serum ACP and ALP expression levels between two groups[n=5,,λB/(U·L-1)]

表1 2组大鼠血清ACP和ALP表达水平比较Tab.1 Comparison of rat serum ACP and ALP expression levels between two groups[n=5,,λB/(U·L-1)]
*P<0.01compared with control group;△P<0.01compared with before modelling.
Group ACP Before modelling After modelling ALP Before modelling After modelling Control 175.1±1.5178.6±1.6162.3±1.1132.5±1.0*△Model 179.3±1.4247.6±1.7*△171.9±1.3295.6±1.4*△
2.7 PTPMEG2在大鼠各组织中的表达水平 将提取到的大鼠各组织进行SDS-PAGE电泳,并进行Western blotting法检测,PTPMEG2在大鼠的各种组织中均有表达,其中模型组大鼠肾脏组织中PTPMEG2的表达水平明显高于对照组,而其在肌肉组织中的表达水平明显低于对照组。见图6。
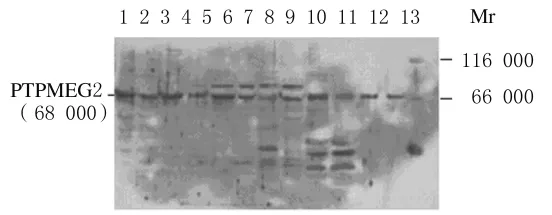
图6 PTPMEG2在大鼠不同组织中表达的电泳图Fig.6 Electrophoregram of PTPMEG2 expressions in various tissues of rats
2.8 PTPMEG2在BMCs、骨髓红细胞和BMSCs中的表达水平 与对照组比较,模型组大鼠BMCs中PTPMEG2表达量明显增加,而在BMSCs中其表达量无明显改变(图7)。模型组大鼠骨髓红细胞中PTPMEG2表达量与对照组比较亦无明显改变。见图8。
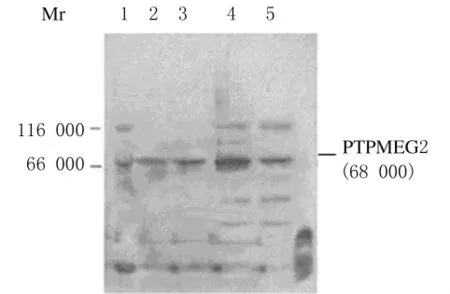
图7 PTPMEG2在大鼠BMCs和BMSCs中表达的电泳图Fig.7 Electrophoregram of PTPMEG2 expressions in BMCs and BMSCs of rats
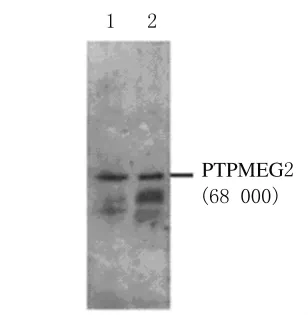
图8 PTPMEG2在大鼠骨髓红血胞中表达的电泳图Fig.8 Electrophoregram of PTPMEG2 expression in bone marrow red cells of rats
3 讨 论
本研究中经2种离子交换柱层析后,获得纯度为94.8%、比活力为54606U·mg-1的PTPMEG2蛋白纯品,并制备了效价为1∶10000的多克隆抗体。
本研究参考Hassan等[8]关于骨质疏松症动物模型建立的标准,成功建立了大鼠骨质疏松症动物模型。因ACP和ALP水平是骨质疏松症表征的一个重要指标[9],本研究结果显示:骨质疏松症模型组大鼠血清ALP及ACP表达水平和骨脆性均高于对照组,骨质疏松症成骨细胞可向成纤维细胞样细胞形态转化,骨钙素、ALP和Ⅰ型胶原的分泌功能部分丧失,使ALP水平降低[10]。本研究中模型组大鼠肾脏组织中PTPMEG2的表达水平明显高于对照组,而其在肌肉组织中的表达水平却低于对照组。可见PTPMEG2有可能与参与肌肉活动的调节并与肾功能相关。BMSCs可以通过体外培养纯化的方法获得,本文作者参考闫冬梅等[11]有关BMSCs的培养方法成功获得大鼠股骨及胫骨的BMSCs,结果表明:与对照组比较,模型组大鼠BMCs中PTPMEG2表达量显著增多,而在骨髓红细胞和BMSCs中其表达量无明显差异。说明PTPMEG2主要表达于成熟的BMCs中,而在红细胞和未分化的BMSCs中则表达较少。Pittenger等[12]研究表明:近30%的骨髓贴壁细胞具有分化为成骨细胞和软骨细胞的特性。说明PTPMEG2主要表达于成熟的BMCs中,而在红细胞和未分化的BMSCs中则表达较少[13]。骨质疏松症大鼠BMCs中PTPMEG2表达量增加,且多发生在骨髓内分化成熟的骨细胞中,说明PTPMEG2可能在骨质疏松症的发展过程中发挥重要的调节作用。
[1]Hunter T.Signaling-2000and beyond[J].Cell,2000,100(1):113-127.
[2]李婉南,姜轶群,范晓迪,等.蛋白质酪氨酸磷酸酶及相关疾病[J].吉林大学学报:医学版,2008,34(6):1106-1108.
[3]Tonks NK.Protein tyrosine phosphatases:from genes,to function,to disease[J].Nature Rev Mol Cell Biol,2006,7(11):833-846.
[4]Wang Y,Vachon E,Zhao ZJ,et al.Tyrosine phosphatase MEG2modulates murine development and platelet and lymphocyte activation through secretory vesicle function[J].J Exp Med,2005,202(11):1587-1597.
[5]Cho CY,Koo SH,Wang Y,et al.Identification of the tyrosine phosphatase PTP-MEG2as an antagonist of hepatic insulin signaling[J].Cell Metab,2006,3(5):367-378.
[6]Schmidt A,Rutledge SJ,Endo N,et al.Protein-tyrosine phosphatase activity regulates osteoclast formation and function:inhibition by alendronate[J].Proc Natl Acad Sci USA,1996,93(7):3068-3073.
[7]Zambuzzi WF,Milani R,Teti A.Expanding the role of Src and protein-tyrosine phosphatases balance in modulating osteoblast metabolism:lessons from mice[J].Biochimie,2010,92(4):327-332.
[8]Hassan HA,El Wakf AM,El Gharib NE.Role of phytoestrogenic oils in alleviating osteoporosis associated with ovariectomy in rats[J].Cytotechnology,2012,Nov 18.[Epub ahead of print]
[9]尚德志,王大章,郑 虎,等.抗骨质疏松药XW630对成骨细胞碱性磷酸酶mRNA表达的影响[J].中国骨质疏松杂志,2000,8(6):1-4.
[10]张兴凯,杨庆铭,邓廉夫,等.骨质疏松成骨细胞生物学特征的体外研究[J].中国骨质疏松杂志,2004,10(1):48-51.
[11]闫冬梅,徐开林,杜 冰,等.人骨髓基质细胞的培养及鉴定[J].临床血液学杂志,2009,22(3):144-146.
[12]Pittenger MF,Machay AM,Beck SC,et al.Multilineage potential of adult human mesenchymal stemcells[J].Science,1999,284(5411):143-147.
[13]Egermann M,Heil P,Tami A,et al.Influence of defective bone marrow osteogenesis on fracture repair in an experimental model of senileosteoporosis[J].J Orthop Res,2010,28(6):798-804.
