干扰素β1a基因真核表达质粒的构建和表达
2013-03-23黄志立李艳晖张丽君解桂秋
王 妍,黄志立,李艳晖,张丽君,解桂秋
(1.深圳职业技术学院应用化学与生物技术学院,广东 深圳 518055;2.吉林大学生命科学学院分子酶学工程教育部重点实验室,吉林 长春 130012;3.吉林大学药学院基因工程教研室,吉林 长春 130021)
天然干扰素β(interferon-β,IFN-β)是糖蛋白,而重组人IFN-β分为真核表达和原核表达2种,分别称为IFN-β1a和IFN-β1b。原核表达系统由于翻译后无修饰加工的功能,所以表达的蛋白质没有糖基化,而哺乳动物有高级的修饰加工功能,表达的蛋白质与天然的蛋白质十分接近,生物学作用和安全性也明显增加[1]。国外上市的分别由大肠杆菌和CHO表达的2种产品的应用效果显示:用CHO真核系统表达的重组人IFN-β1a产品其蛋白与天然的蛋白(带有糖基化)一样,疗效好且副反应更少[2]。目前国内外有关IFN-β的研究多集中于临床治疗上[3-5],国内有少量IFN-β表达方面的研究报道[6-8],目前国内临床试验上只有用大肠杆菌表达的IFN-β,由于原核表达系统信号肽加工不完全、修饰功能不完善以及内部降解等问题,使得表达产物的生物比活性尚需提高,因此,采用真核表达系统CHO表达IFN-β具有更好的临床疗效和市场前景。本实验为了提高表达后蛋白质的稳定性,将IFN-β1a的17位半胱氨酸进行修饰,采用化学合成法得到重组人IFN-β1a基因。将合成的IFN-β1a基因插入pSV2-dhfr质粒中,构建重组真核表达质粒pSV2-dhfr-IFN-β1a,转染CHO-dhfr-细胞,经筛选获得IFN-β1a活性较高的单克隆细胞株,并鉴定表达产物的活性,旨在为进一步对IFN-β1a进行纯化用于制备产品及其生产工艺的研究奠定基础。
1 材料与方法
1.1 细胞、菌株、质粒及病毒 CHO-dhfr-细胞购自ATCC;大肠杆菌JM109由吉林大学生命科学学院分子酶学工程教育部重点实验室保存;质粒pSV2-dhfr、人羊膜细胞(Wish)和水泡性口炎病毒(VSV)均由深圳职业技术学院保存。
1.2 主要试剂及仪器 限制性内切酶BamHⅠ、EcoRⅠ和M Buffer购自TOYOBO公司;10×PCR Buffer、Taq DNA聚合酶、Pfu DNA聚合酶、DNA marker DL 2000、λDNA Hind Ⅲ marker和超纯dNTPs(分别含2.5mmol·L-1dATP、dTTP、dCTP和dGTP)购自北京鼎国生物技术有限公司;氨苄西林(Amp)和二甲基亚砜购自美国Sigma公司;DV801A质粒提取试剂盒、DV805ADNA纯化、回收试剂盒购自TaKaRa Biotech公司;IMDM培养基和RPMI1640培养基购自Invitrogen公司;新生牛血清购自杭州四季青生物工程材料有限公司;氨甲基喋呤(MTX)购自CALBIOCHEM公司;胸苷(thymidine)购自上海华舜生物工程有限公司;次黄嘌呤(hypoxanthine)购自广州展晨生物科技公司;干扰素国家标准品购自中国食品药品质量研究院;PolyFect Transfection Reagent转染试剂购自QIAGEN公司;Bio-Rad凝胶成像系统购自Bio-Rad公司。
1.3 引物设计及合成 根据pSV2-dhfr质粒多克隆位点的序列和IFN-β1a基因序列,采用Primer 5.0软件设计引物:上游引物P1,5′-AgT CgA TAT ggA TCC ATg AgC TAC AAC TTg CTT g-3′;下游引物P2,5′-CCT ACA Cgg AAT TCT TCA gTT TCg gAg gTA ACC Tg-3′。引物由上海生工生物工程技术服务有限公司合成。
1.4 目的基因的合成 检索NCBI GenBank数据库获取IFN-β1a的cDNA全基因序列,为了提高表达后蛋白质的稳定性,本研究将IFN-β1a的17位半胱氨酸进行修饰,并由上海生工生物工程技术服务有限公司合成,得到重组人IFN-β1a基因。
1.5 IFN-β1a基因的扩增及测序 将重组IFN-β1a基因克隆到载体pUC57,插入位点为SmaⅠ,受体菌为大肠杆菌DH5α菌株。培养含有IFN-β1a基因的大肠杆菌DH5α菌株,使用质粒提取试剂盒提取出pUC57-IFN-β1a。用DV801A质粒提取试剂盒抽提质粒DNA,稀释100倍,以其为模板,P1、P2为引物进行PCR扩增。反应条件:94℃预变性3min,94℃变性1min,50℃退火1min,72℃延伸1min,36个循环,72℃延伸10min,4℃保存。PCR扩增产物经2%琼脂糖凝胶电泳进行鉴定。用BamHⅠ和EcoRⅠ双酶切PCR扩增产物,并送上海生工生物工程技术服务有限公司测序。
1.6 重组真核表达质粒pSV2-dhfr-IFN-β1a的构建和鉴定 将pSV2-dhfr质粒转化感受态大肠杆菌JM109扩增,挑取单菌落,提取质粒,用BamHⅠ和EcoRⅠ双酶切后再纯化回收,并进行磷酸化,通过Gel Extraction Kit纯化回收目的基因片段。用连接试剂盒将纯化回收的目的基因IFN-β1a和磷酸化的载体pSV2-dhfr在16℃下连接1h,连接产物转化感受态大肠杆菌JM109,涂布500×氨苄西林平板,30℃过夜培养,挑取单菌落,接种于5mL 2YT培养液中培养过夜,提取质粒,经琼脂糖凝胶电泳进行鉴定,并进行PCR及双酶切(BamHⅠ/EcoRⅠ)鉴定。鉴定正确的重组质粒命名为pSV2-dhfr-IFN-β1a。
1.7 细胞转染及筛选 将CHO-dhfr-细胞(来自ATCC)接种于6孔细胞培养板,8×10个/孔,待细胞长至40%~80%融合时(约需24h),用转染试剂将经NdeⅠ单酶切线性化的重组质粒pSV2-dhfr-IFN-β1a转染至CHO-dhfr-细胞中,操作按试剂盒说明书进行。以空载体pSV2-dhfr转染的细胞和未转染的细胞作为对照。转染后第2天,吸弃培养基,用PBS洗涤2次后,每孔分别加入含1×10-8mol·L-1MTX的培养基培养;3周后,将MTX浓度提高至3×10-7mol·L-1继续加压筛选,并对MTX浓度与IFN活力关系进行优化。
1.8 IFN-β1a抗病毒活性的检测 按照《中国药典》三部(2010版)方法,采用Wish细胞病变抑制法,以IFN-β国家标准品作为对照品,参考文献[9]进行。用自动酶标仪测定样品的效价值,参比波长为630nm,检测波长为570nm。以保护半数细胞免受病毒损害的最高干扰素稀释度为1个IFN活性单位。
1.9 转染细胞的鉴定 取对数生长期的转染细胞,采用酚/氯仿法提取其基因组DNA,按照1.4项中的反应条件进行PCR扩增,确定IFN-β1a基因是否克隆进CHO-dhfr-细胞。
2 结 果
2.1 IFN-β1a基因扩增产物的序列测定 IFN-β1a基因扩增产物经2%琼脂糖凝胶电泳分析,特异片段大小与预期相符。见图1。基因测序结果表明:人IFN-β基因序列正确以及插入序列正确。
2.2 重组真核表达质粒的鉴定 按照质粒提取的方法将5个单菌落进行提取质粒,对提取的质粒进行琼脂糖凝胶电泳鉴定,实验结果表明:5个单菌落提取的质粒经IFN-β的引物PCR扩增均可见目标电泳带,大小与预期相符。见图2。质粒pSV2-dhfr-IFN-β1a的双酶切及PCR产物经2%琼脂糖凝胶电泳分析,均可见目的基因条带,大小与预期相符。见图3。表明重组真核表达质粒pSV2-dhfr-IFN-β1a构建正确。
2.3 转染细胞的鉴定 琼脂糖凝胶电泳分析显示:以转染细胞基因组DNA为模板,可扩增出约500bp的特异条带,表明IFN-β1a基因已成功克隆入CHO-dhfr-细胞。见图4。
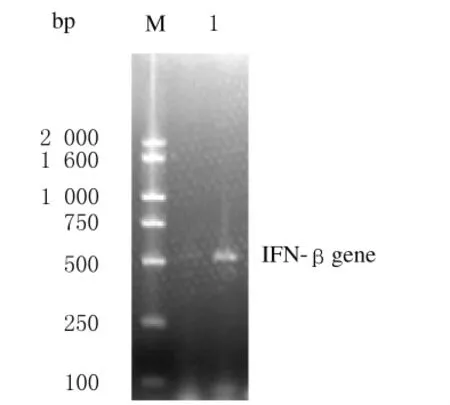
图1 IFN-β1a基因PCR扩增产物电泳图Fig.1 Electrophoregram of PCR product of IFN-β1agene
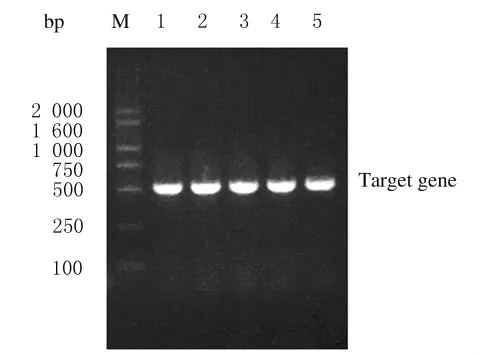
图2 从质粒pSV2-dhfr-IFN-β1a扩增目的基因的电泳图Fig.2 Electrophoregram of amplification of target gene from plasmid pSV2-dhfr-IFN-β1a
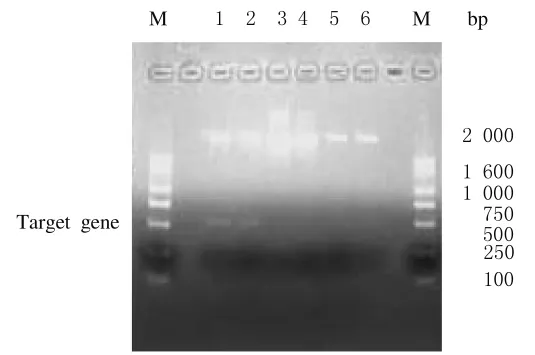
图3 重组真核表达质粒pSV2-dhfr-IFN-β1a的PCR及酶切鉴定Fig.3 Identification of recombinant plasmid of pSV2-dhfr-IFN-β1aby PCR and restriction enzyme digestion
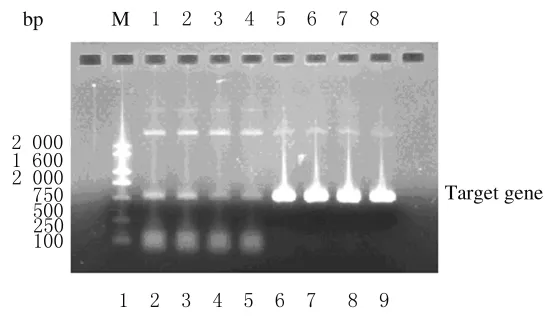
图4 转染细胞的PCR鉴定Fig.4 Identification of transfected cells by PCR
2.4 MTX有效浓度的确定 由于CHO-dhfr-细胞的生长需要添加胸苷和次黄嘌呤,因此完全培养基中都加入了这2种营养,当将培养基换成普通培养基时细胞也能继续分裂数次,但在随后的持续培养过程中,活细胞并不死亡,只是在慢慢衰老,但当培养基中加入1×10-7mol·L-1的MTX后该缺陷型细胞全部死亡,因此在初筛过程中选择的MTX浓度为1×10-7mol·L-1。见表1。
2.5 MTX浓度的优化 将转化细胞培养至60%~80%密度后加入不同浓度的MTX进行初步优化,MTX浓度为5×10-8、1×10-7、2×10-7、4×10-7、1×10-6和2×10-6mol·L-1。IFN表达水平见图5。

表1 CHO-dhfr-细胞对MTX的耐受程度测定Tab.1 Tolerance test of CHO-dhfr-cells against MTX
根据活性测定值以及显微镜检查细胞生长状况,初步确定MTX浓度为5×10-8~4×10-7mol·L-1(图5A),再次选择5×10-8、1×10-7、1.5×10-7、2×10-7、2.5×10-7和3×10-7mol·L-1。最终确定最佳MTX浓度为(1~2)×10-7mol·L-1(图5B),转瓶表达时使用1.5×10-7mol·L-1浓度的MTX取得了最好的表达效果。
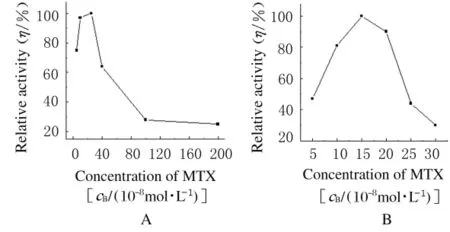
图5 MTX浓度筛选图Fig.5 Screening of MTX concentration
3 讨 论
目前IFN-β1a已经广泛用于病毒性感染、恶性肿瘤以及自身免疫性疾病的治疗或实验性治疗。1993年FDA批准了先灵公司制造的IFN-β1b(E.coli表达)上市销售,用于治疗多发性硬化症和神经系统疾病,后来先灵公司又开发了由CHO细胞表达的IFN-β1a。用CHO真核系统表达的重组人IFN-β1a产品其蛋白与天然的蛋白(带有糖基化)一样,疗效好且副反应更少,具有糖基化,更接近天然的蛋白,疗效更好,尤其副反应低[10]。
哺乳动物细胞表达系统所表达的重组蛋白与天然蛋白在结构和功能上均高度一致,该系统是能够通过临床要求的具有蛋白质修饰作用的外源蛋白表达系统。目前可用于哺乳动物细胞的筛选标记有多种,虽然许多细胞系可用于扩增基因,但最常用的还是CHO细胞[11]。常用的CHO细胞包括CHO-K1和CHO-dhfr-,K1为原始细胞系,dhfr-为二氢叶酸缺陷型。目前最常用的也是最成功的系统为氨甲基喋呤用于二氢叶酸还原酶基因的扩增,本研究通过二氢叶酸还原酶缺陷型的CHO细胞,在氨甲基喋呤筛选扩增下,使外源蛋白得到高效表达。
IFN-β1a为由166个氨基酸组成的糖基化蛋白,相对分子质量为23000,肽链中含3个半胱氨酸,分别在17、31和141位,第31和141位的半胱氨酸之间形成的二硫键对IFN-β的生物学活性非常重要。第141位的Cys被Tyr替代后则完全丧失抗病毒作用,第17位的Cys对保持IFN-β的空间结构无明显的作用,该Cys被Ser替代后不但对其生物学活性无影响,反而使其分子更加稳定,同时也减少其与第141位Cys形成二硫键的几率。本研究采用Ser替代17位的Cys,使表达的产物在稳定性方面占有优势[12]。
一般情况下用动物细胞表达体系来表达外源基因,其表达水平通常比采用大肠杆菌表达体系低,速度慢,因此,表达策略的选择就显得十分重要。本研究选择CHO-dhfr-作为表达系统,质粒pSV2-dhfr作为表达载体表达IFN-β1a基因。为了保证dhfr基因和Amp基因的完整,结合pSV2-dhfr-IFN-β1a质粒的多克隆位点,根据pSV2-dhfr的基因图谱和IFN-β1a的基因序列,选择BamHⅠ和EcoRⅠ作为基因插入位点。
外源基因在不同表达体系中的表达水平差异很大[13],而在细菌、酵母和动物细胞中又有糖基化水平不同的问题,导致相对分子质量也不同。本研究经NdeⅠ单酶切线性化重组质粒pSV2-dhfr-IFN-β1a,采用不同于美国专利的连接方法[14],改变了原来用筛选的方法最后确定载体和构建的实验方案。另一技术关键点是线性化处理的酶不同,这对于构建很重要,可通过转化后的细胞克隆看出明显的区别。本研究筛选到5个单克隆细胞株,其中2个细胞株的IFN-β1a表达后纯化产物的活性与国外上市产品及美国FDA产品标准相近。因基因整合随机性较大(CHO细胞染色体上约有1500个位点可整合基因),对目的基因的表达影响较大(10多个可高效表达的位点),为了获得高水平表达株,至少需要筛选几百个有活性的克隆株;而线性化情况和整合位点的不同影响基因的表达水平,因此在在整个筛选过程中均需使用MTX维持,将未转化的细胞株淘汰。而适当的MTX浓度压力将使IFN的表达始终维持在较高水平,并对细胞无明显负面作用。在一定范围内,细胞表达IFN的量和加入的MTX浓度密切相关,在<1.5×10-7mol·L-1的浓度下,IFN的表达量和MTX的浓度几乎成线性关系,这是由于dhfr基因和IFN基因是串连关系,在抗生素的压力下,dhfr基因大量表达,由于基因的顺式表达,导致IFN基因也大量表达,因此此时MTX的浓度对IFN表达的影响是正面的。但当MTX浓度太高,超过细胞的承受极限时MTX就抑制了细胞的新陈代谢,阻止了细胞的分裂,甚至加速细胞死亡。因此高浓度MTX作用下IFN表达水平持续下降。通过MTX增压,IFN的表达水平从1.9×104IU·L-1提高到1.3×105IU·L-1。经过转瓶培养优化后IFN表达水平达到3×105IU·L-1。本实验所获得细胞表达的IFN-β1a的生物活性比本文作者先前采用CHO细胞表达的IFN-α2b[15]高10倍,是国内相关研究[8]的2倍多。
综上所述,本研究成功构建重组表达质粒pSV2-dhfr-IFN-β1a,并在CHO细胞中表达IFN-β1α蛋白,且表达的蛋白生物活性较高,为下一步采用真核表达系统在我国进行产业化开发该蛋白奠定基础。
[1]刘运龙,程远国,刘学龙.干扰素研究进展[J].动物医学进展,2008,29(2):85-89.
[2]Walsh G.Biopharmaceutical benchmarks[J].Nat Biotechnol,2006,24(7):769-776.
[3]Tuna Y,Ba瘙塂ar O,Dikici H,et al.Rapid onset of ulcerative colitis after treatment with interferon β1a in a patient with multiple sclerosis[J].J Crohn’s Colitis,2011,5(1):75-76.
[4]Lindsey JW,Scott TF,Lynch SG,et al.The CombiRx trial of combined therapy with interferon and glatiramer acetate in relapsing remitting MS:Design and baseline characteristics[J].Multi Sclerosis Relat Disor,2012,1(2):81-86.
[5]Neetu A,Edward K.Cost-effectiveness of early initiation of fingolimod versus delayed initiation after 1year of intramuscular interferon beta-1ain patients with multiple sclerosis[J].Clin Ther,2012,34(7):1583-1590.
[6]雷键勇,张莲芬,杨健良,等.人β干扰素血清白蛋白融合蛋白在毕氏酵母中的分泌表达[J].中国生物工程杂志,2006,26(7):13-18.
[7]来大志,陈 薇,付 玲,等.人β干扰素基因的改构及其融合表达和纯化[J].军事医学科学院院刊,2002,26(1):21-23.
[8]史艳秋,陈 畅,顾 黎,等.重组人β干扰素在DHFR--CHO细胞中的高效表达[J].中国生化药物杂志,2006,27(3):129-133.
[9]刘长暖,张 翊,饶春明,等.重组人干扰素-β制品的质量标准研究[J].中国肿瘤生物治疗杂志,2000,7(3):212-215.
[10]刘建源,孔 健.β-干扰素及其临床应用[J].微生物学免疫学进展,2000,28(3):91-94.
[11]董文博,陈洪栋,郝建国,等.用于药用蛋白生产的外源表达系统[J].基因组学与应用生物学,2009,28(4):793-802.
[12]Mark DF,Lu SD,Creasey AA,et al.Site-specific mutagenesis of human fibroblast interferon gene[J].Proc Natl Acad Sci,1984,81(18):5662-5666.
[13]陈 峰,朱 祯.具有重要应用价值的真核表达系统[J].生物工程进展,1998,18(1):31-35.
[14]Mc Cormick FP,Innis MA,Ringold MA.United States Patent 5376567[P].Dec.27,1994.
[15]陈奋则,王 妍,朱一松,等.干扰素α2b基因真核表达质粒的构建及表达[J].中国生物制品学杂志,2010,23(11):1210-1213.
