伏隔核脑深部电刺激对大鼠肥胖症的治疗作用
2013-03-23魏乃礼胡文瀚
张 弨,张 凯,魏乃礼,王 尧,胡文瀚
(1.首都医科大学附属北京天坛医院神经外科,北京 100050;2.首都医科大学北京市神经外科研究所功能神经外科研究室,北京 100050)
中枢神经系统(central nervous system,CNS)通过能量平衡系统和认知奖赏平衡系统实现对体质量的调节[1]。2个系统内多种神经结构与肥胖症的形成有关,各神经结构间的纤维联系极其复杂,构成了复杂的神经调节网络[2-4]。伏隔核(nucleus accumbens,NAc)属于腹侧纹状体主要部分,又分为壳和核,为CNS认知奖赏平衡系统的核心结构,其中壳部作用更为突出。研究[5]表明:NAc兴奋性的改变或神经递质水平变化均会对食物摄取产生明显影响,从而影响肥胖症的病理生理。相关的实验报道较多,如NAc壳内部注入谷氨酸对食物摄取具有负性调节作用,NAc内注射阿片类激动剂和拮抗剂、多巴胺拮抗剂等均可影响食物的摄取。早在半个多世纪前即有文献报道毁损动物的下丘脑外侧部(lateral hypothalamus,LH)造成拒食和拒水。脑深部电刺激(deep brain stimulation,DBS)相对于核团毁损具有微创、可调节、可逆和效果持久等优点,已逐步取代了毁损手术,目前已有学者[6]进行了LH电刺激治疗肥胖症的动物实验。与LH-DBS比较,NAc-DBS可能具有潜在的优势。首先,NAc是参与体质量调控的神经调控网络中更高级的中枢。其次,肥胖是一种具有明确神经心理基础的慢性疾病,与食物摄取相关的奖赏系统与肥胖的发生密切相关,而NAc是脑内奖赏系统调节通路上最重要的结构,因此NAc-DBS还可能通过对食物心理依赖的阻断治疗肥胖症。本实验通过对大鼠NAc行DBS,并分析实验大鼠摄食量、饮水量和体质量的改变,探讨NAc壳部DBS对大鼠肥胖症的治疗作用。
1 材料与方法
1.1 实验动物 SD大鼠30只(8周龄),雄性,体质量300~350g,由北京维通利华实验动物技术有限公司提供,电极固定装置植入前进行为期7d的高脂饲料(能量配比为脂肪含量45%,碳水化合物含量35%,蛋白质含量20%,北京市军事医学科学院实验动物中心提供)喂养,余实验过程均自由摄食(高脂饲料)饮水。
1.2 仪器与试剂 脑立体定位仪(德国KOPF公司),Master 8刺激器(以色列AMPI公司),ISO-Flex刺激隔离器(以色列AMPI公司),观察箱[东西仪(北京)科技有限公司],刺激电极固定装置(北京浦菲特精密模具有限公司),四通道电滑环(深圳市森瑞普电子有限公司),刺激电极(美国FHC公司),牙托水、自凝牙托粉(上海新世纪齿科材料公司)。
1.3 电极固定装置植入 大鼠以10%水合氯醛(3mL·100g-1)腹腔注射麻醉,备皮,固定于脑立体定位仪上,消毒,利多卡因局麻后逐层切开头皮、骨膜,固定皮瓣。确认前囟点后,根据Paxinos &Watson大鼠脑图谱确定左侧NAc壳部坐标范围:前囟前1.2mm,旁开0.7mm,深7.4mm。电钻钻一骨孔,借助推进装置将电极固定装置缓慢插至核团旁,牙托水泥固定,严密缝合头皮,术毕放归饲养笼内,术后3d每天腹腔注射青霉素预防感染。
1.4 实验动物分组和处理 电极固定装置植入术后14d,按照随机对照原则将实验动物分为DBS组(n=15)和对照组(n=15),DBS组大鼠借固定装置与刺激电极相连,刺激电极借导线、电滑环、观察箱与刺激器相连,进行为期7d的清醒条件下高频电刺激(刺激参数:电压2.0V,波宽100ms,频率180~200Hz);对照组实验动物同样连接电极、导线、电滑环、观察箱和刺激器,但不进行电刺激。7d后2组大鼠均拔除刺激电极,继续单笼喂养28d。
1.5 数据监测 实验全程共57d,包括电极固定装置植入术前7d,植入术当日,术后恢复期14d,电刺激7d,刺激电极拔除后28d。全程每日监测大鼠体质量、摄食量和饮水量,其中将每日的体质量增长率标准化为与电刺激开始当日(第23天)体质量的比值。每日体质量增长率(%)=[每日体质量(g)-电刺激开始日体质量(g)]/电刺激开始日体质量(g)×100%。
1.6 病理确认靶点 实验完成后对2组大鼠进行病理确认靶点,对电极位置不正确的大鼠从相应组别中弃去,重新补做相应组别的实验内容。
1.7 统计学分析 采用SPSS 16.0统计软件进行数据分析,体质量增长率、摄食量和饮水量均以表示,不同时间比较采用两独立样本的秩和检验(Wilcoxon rank-sum test);组间比较采用重复测量资料的方差分析(rANOVA)。
2 结 果
2.1 2组大鼠体质量的变化 2组大鼠在电刺激开始前,体质量增长率情况基本一致(P>0.05);电刺激开始后第5天,每日2组数据比较开始出现差异(P<0.05),统计学差异持续至电刺激结束,并在电刺激结束后28d内继续存在。见表1。在电刺激这段时间内,2组大鼠体质量增长率均降低,但DBS组下降更为明显(P<0.05)。电刺激结束后28d2组大鼠体质量增长率均上升,DBS组上升更为缓慢,差异有统计学意义(P<0.05)。至实验结束,与电刺激开始日比较,对照组大鼠体质量平均增长幅度为35.7%,DBS组为10.2%,两者间相差25.5%。
表1 电刺激1~7d后2组大鼠体质量增长率Tab.1 The weight gain rates of rats in two groups 1-7dafter stimulation(n=15,,η/%)
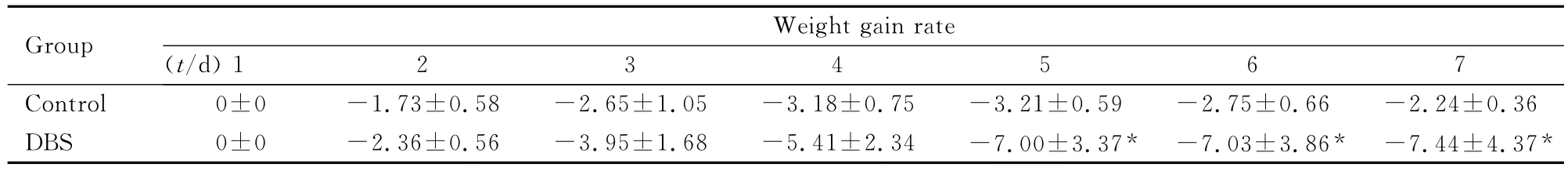
表1 电刺激1~7d后2组大鼠体质量增长率Tab.1 The weight gain rates of rats in two groups 1-7dafter stimulation(n=15,,η/%)
*P<0.05compared with control group.
1234567 Control 0±0-1.73±0.58-2.65±1.05-3.18±0.7 GroupWeight gain rate(t/d)5-3.21±0.59-2.75±0.66-2.24±0.36 DBS 0±0-2.36±0.56-3.95±1.68-5.41±2.34-7.00±3.37*-7.03±3.86*-7.44±4.37*
2.2 2组大鼠摄食量的变化 电刺激开始前、结束后2组大鼠摄食量差异无统计学意义(P>0.05)。电刺激7d内DBS组与对照组比较差异有统计学意义(P<0.05),DBS组大鼠每日摄食量均低于对照组。见表2。
2.3 2组大鼠饮水量的变化 在电刺激前、中和后各个阶段内,2组大鼠饮水量比较差异均无统计学意义(P>0.05)。
表2 电刺激1~7d后2组大鼠摄食量Tab.2 The food intakes of rats in two groups 1-7dafter stimulation(n=15,,m/g)
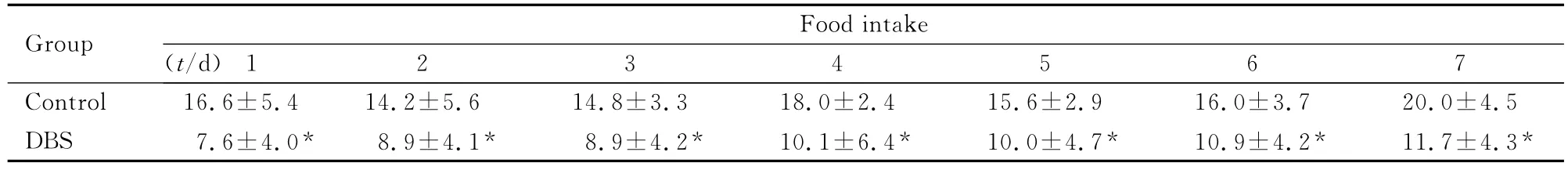
表2 电刺激1~7d后2组大鼠摄食量Tab.2 The food intakes of rats in two groups 1-7dafter stimulation(n=15,,m/g)
*P<0.05compared with control group.
1234567 Control 16.6±5.414.2±5.614.8±3.318.0±2.4 Group Food intake(t/d)15.6±2.916.0±3.720.0±4.5 DBS 7.6±4.0*8.9±4.1*8.9±4.2*10.1±6.4*10.0±4.7*10.9±4.2*11.7±4.3*
3 讨 论
食物是具有优势的天然奖赏和条件化刺激,特殊食物尤其是高糖高脂饮食是天然奖赏中最具优势的奖赏,可以促进饮食和激发联系条件刺激与奖赏之间的学习行为[7]。高糖高脂饮食可能是决定摄食量的最重要单一因素,而在现今社会中食物普遍容易获取,摄食量增加[8],这就增加了肥胖症的易感性。可口食物(高脂高糖)影响相关脑区活跃性,这类区域包括中脑腹侧被盖区、NAc、腹侧苍白球和杏仁核[9],该类区域构成了奖赏系统的主要部分。脑中的奖赏系统被分别定义为“渴求”和“喜爱”,“渴求”表现为激发对食物的渴望;“喜爱”表现为对食物的喜爱情绪[10]。多巴胺系统主要作用于“渴求”,NAc壳相关的内源性阿片类物质和内源性大麻素系统主要作用于“喜爱”,在天然奖赏作用中发挥关键作用。药物奖赏与以食物为核心的天然奖赏系统同属奖赏系统,相关研究[11]表明:NAc壳部高频电刺激可以有效缓解药物成瘾模型的觅药行为,降低依赖性。基于以上理论及研究进展,在进行本研究前预测实验动物经NAc壳部电刺激后可能出现持续性体质量下降表现,同时出现摄食高脂饲料量下降。
本实验结果验证了上述假设,即在电刺激期间,2组大鼠的体质量变化逐渐出现差异,这一差异一直保持至刺激结束后28d,同时电刺激期间DBS组与对照组大鼠摄食量差异有统计学意义。体质量方面,电刺激开始阶段,DBS组大鼠体质量下降趋势快于对照组,2组大鼠除是否打开高频电刺激开关外,其他干扰因素完全一致,这一结果印证了NAc-DBS打开状态对体质量维持较低水平具有明显优势。DBS组大鼠DBS结束后体质量增长速度低于对照组,表明短期NAc壳部电刺激对实验大鼠体质量保持在较低水平具有一定远期作用。摄食方面,理论上损害奖赏系统的任一部分,可能引起实验动物对可口食物的“渴求”和“喜爱”的改变,行为学上表现为摄食的动机降低,摄食量降低。本实验结果显示:电刺激期间DBS组大鼠摄食量较对照组保持较低水平,而在电极拔除后,DBS组和对照组大鼠摄食量无明显差异。饮水方面,NAc-DBS未显示出明显影响作用。
电极拔除后摄食量和体质量发生变化,出现了电刺激结束后摄食量恢复至术前水平而体质量上升缓慢的矛盾现象。对这一矛盾现象可有多种解释,但是体质量的维持依赖CNS内能量平衡和认知奖赏平衡两大系统的调控,具体表现在能量的摄取、排泄和消耗的改变上,因此最为合理的解释可能为NAc壳部电刺激对实验大鼠的能量排泄和消耗产生了影响。可能机制为:下丘脑弓状核与下丘脑其他核团以及下丘脑以外区域存在广泛的神经联系,被认为是能量平衡系统中最关键的区域[12-13]。弓状核含有2类神经元,其中一类神经元位于弓状核外侧部,可以合成前阿片黑素细胞皮质激素(proopiomelanocortin,POMC)衍生激素,这类神经元被称为POMC神经元,分泌黑皮质素和β内啡肽。黑皮质素通过与表达于室旁核、背内侧核、腹内侧核、下丘脑外侧核上的黑皮质素受体-3/4结合进而起到降低摄食、增加能量消耗的生理作用[14-15]。当进行NAc电刺激时,很可能引起其下游激素瘦素的释放增加,而下丘脑弓状核内的POMC神经元对瘦素敏感,POMC神经元活动度增加,通过黑皮质素作用增加了实验动物的能量消耗,同时这一作用在电刺激结束后继续维持至少4周。
本实验验证了NAc壳部高频电刺激治疗肥胖症的可行性,但本实验仅是第一步,关于NAc-DBS过程中CNS内相关核团的神经递质的改变以及各类激素(如瘦素)变化的研究仍在进行中,更进一步的研究将有助于提高对CNS参与体质量调节的认识,同时为NAc-DBS治疗肥胖症建立更为可靠的理论基础。
[1]Volkow ND,Wang GJ,Baler RD.Reward,dopamine and the control of food intake:implications for obesity[J].Trends Cogn Sci,2011,15(1):37-46.
[2]Adan RA,van de rschuren LJ,la Fleur SE.Anti-obesity drugs and neural circuits of feeding[J].Trends Pharmacol Sci,2008,29(4):208-217.
[3]Williams G,Cai XJ,Elliott JC,et al.Anabolic neuropeptides[J].Physiol Behav,2004,81(2):211-222.
[4]Fulton S,Richard D,Woodside B,et al.Food restriction and leptin impact brain reward circuitry in lean and obese Zucker rats[J].Behav Brain Res,2004,155(2):319-329.
[5]van der Plasse G,Schrama R,van Seters SP.Deep brain stimulation reveals a dissociation of counsummatory and motivated behviour in the medical and lateral nucleus accumbens shell of the rat[J].PloS One,2012,7:e33455.
[6]Sani S,Jobe K,Smith A,et al.Deep brain stimulation for treatment of obesity in rats[J].J Neurosurg,2007,107(4):809-813.
[7]Lenoir M,Serre F,Cantin L,et al.Intense sweetness surpasses cocaine reward[J].PLoS One,2007,2(8):e698.
[8]Wardle J.Eating behaviour and obesity[J].Obes Rev,2007,8(Suppl):173-175.
[9]Lutter M,Nestler EJ.Homeostatic and hedonic signals interact in the regulation of food intake[J].J Nutr,2009,139(3):629-632.
[10]Berridge KC.‘Liking’and‘wanting’food rewards:brain substrates and roles in eating disorders[J].Physiol Behav,2009,97(5):537-550.
[11]胡文瀚,张颖,孟凡刚,等.高频电刺激吗啡精神依赖大鼠伏隔核后相关脑区细胞外氨基酸类神经递质的变化[J].首都医科大学学报,2010,31(5):600-603.
[12]Coll AP,Farooqi IS,O'Rahilly S.The hormonal control of food intake[J].Cell,2007,129(2):251-262.
[13]Goldstone AP.The hypothalamus,hormones,and hunger:alterations in human obesity and illness[J].Prog Brain Res,2006,153:57-73.
[14]Cone RD.Studies on the physiological functions of the melanocortin system[J].Endocr Rev,2006,27(7):736-749.
[15]Hillebrand JJ,Kas MJ,Adan RA.To eat or not to eat;regulation by the melanocortin system[J].Physiol Behav,2006,89(1):97-102.
