线粒体凋亡途径在高糖刺激的小鼠足细胞凋亡中的作用*
2013-03-19曹延萍潘风军李亚林段惠军
曹延萍,王 莎,刘 杰,李 航,潘风军,李亚林,段惠军△
(1.河北医科大学病理教研室,石家庄050017;2.邯郸市第一医院肾内科,3.邯郸市第一医院神经内科,河北邯郸056002)
糖尿病肾病(diabetic nephropathy,DN)是临床常见和多发的糖尿病(diabetesmellitus,DM)微血管并发症。足细胞是高度特异、终末分化的上皮细胞,其丢失是蛋白尿形成的启动机制之一。凋亡是其丢失的重要因素,在DN的发病机制中起着关键作用。线粒体损伤途径是经典凋亡途径之一,本实验模拟糖尿病的体外环境,探讨线粒体功能障碍在糖尿病肾病足细胞凋亡中的可能作用。
1 材料与方法
1.1 材料
H-2Kb-tsA58转基因小鼠条件永生型小鼠足细胞(北京协和医学院基础医学细胞中心)。兔抗caspase-3多克隆抗体、小鼠抗cytochrome C多克隆抗体、兔抗β-actin多克隆抗体(北京博奥森生物技术有限公司),TUNEL试剂盒(Promega公司)。
1.2 方法
1.2.1 足细胞的分组 复苏细胞,将实验细胞分成2组:正常糖对照组(normal glucose group,NG):D-葡萄糖 1 g/L;高糖培养组(high glucose group,HG):D-葡萄糖 4.5 g/L,经细胞同步化、分组干预刺激48、72 h后收集细胞及上清液。
1.2.2 TUNEL法检测细胞凋亡 收集细胞并固定,蛋白酶K消化,TDT酶反应液 37℃孵育 1 h,Streptavidin-HRP室温 5 min,DAB显色,苏木精复染(阴性对照用无酶标记液代替TDT酶反应液)。
1.2.3 流式细胞术检测细胞凋亡 (1)收集细胞,固定。(2)离心(1 000 r/min,5min),洗涤,加入 DNA染液(PI 50μg/ml,RNA酶 10μg/ml及1%的 Triton-X100)1ml,4℃染色30min,上机检测。(3)应用Expo32ADC软件分析,二倍体细胞峰前出现一个亚二倍体峰判定为凋亡细胞峰,根据亚二倍体峰的分布组方图计算细胞凋亡率。
1.2.4 流式细胞术检测线粒体跨膜电位(ΔΨm) 收集细胞,制成1~2×106cells/ml细胞悬液,加入 Rh123探针(终浓度为 10μg/ml),避光孵育 10min,离心(1 000 r/min,4min),洗涤,检测荧光强度,激发波长为470~490 nm,发射波长为515~565 nm。
1.2.5 Western blot检测 cyt-c、caspase-3蛋白的表达 收集细胞,洗涤,加入裂解液 300μl,冰浴 1 h,4℃、12 000 r/min离心20min,吸取上清。考马司亮蓝法测定上清蛋白浓度,分装后-80℃保存。每个样品取50μg蛋白,SDS聚丙烯酰胺凝胶电泳,浓缩胶电压100 V,进入10%分离胶改为120 V,约2.5 h停止,60 V电转移1 h,取出PVDF膜,脱脂奶粉37℃封闭2 h,加入一抗兔抗 caspase-3,小鼠抗 cyt-c多克隆抗体(1∶500),兔抗β-actin多克隆抗体(1∶1 000),4℃孵育过夜。洗涤后辣根过氧化物酶标记的山羊抗兔或小鼠IgG(1:5 000稀释),37℃孵育1.5 h。洗涤,将ECL试剂盒中A液和B液等量混合,滴于膜上,暗室中压片,显影,定影,扫描仪透扫后,用美国UVP公司LabWorks 4.5软件对Western条带进行定量分析,读取积分光密度值(IOD),以管家基因β-actin作为内参照校正。
1.3 统计学分析
数据均以均数±标准差(±s)表示,采用 SPSS 13.0统计软件包进行数据分析,显著性差异采用t检验。
2 结果
2.1 TUNEL及流式细胞术检测足细胞凋亡
与正常对照组相比,高糖刺激组细胞凋亡率在48 h时明显高于正常对照组,并呈时间依赖性(图1、图2,表1)
2.2 足细胞线粒体跨膜电位的改变
高糖组自48 h起较正常对照组各时间点ΔΨm明显下降(图 3)。

Fig.1 Apoptotic cells in podocyte at 72 h after situmulation(TUNEL×200)

Fig.2 Apoptosis rate change of podocyte at72 h after situmulation(flow cytometry)
Tab.1 Apoptosis rate of podocyte after NG and HG situmulation detected by flow cytometry(%,±s,n=6)

Tab.1 Apoptosis rate of podocyte after NG and HG situmulation detected by flow cytometry(%,±s,n=6)
NG:Normal glucose group;HG:High glucose group*P<0.05 vs NG
G r o u p A p o p t o s i s r a t e 2 4 h 4 8 h 7 2 h N G 1.6 5±0.4 0 4.2 9±1.8 7 5.6 3±0.4 9 H G 2.5 8±0.7 1 9.1 8±0.2 6*1 5.5 1±1.0 8*

Fig.3 ΔΨm change of podocyte at72 h detected by flow cytometry
2.3 Western blot结果
Western blot半定量分析结果显示,高糖刺激组各时间点cyt-c、caspase-3表达较正常糖对照组增强(图4)。
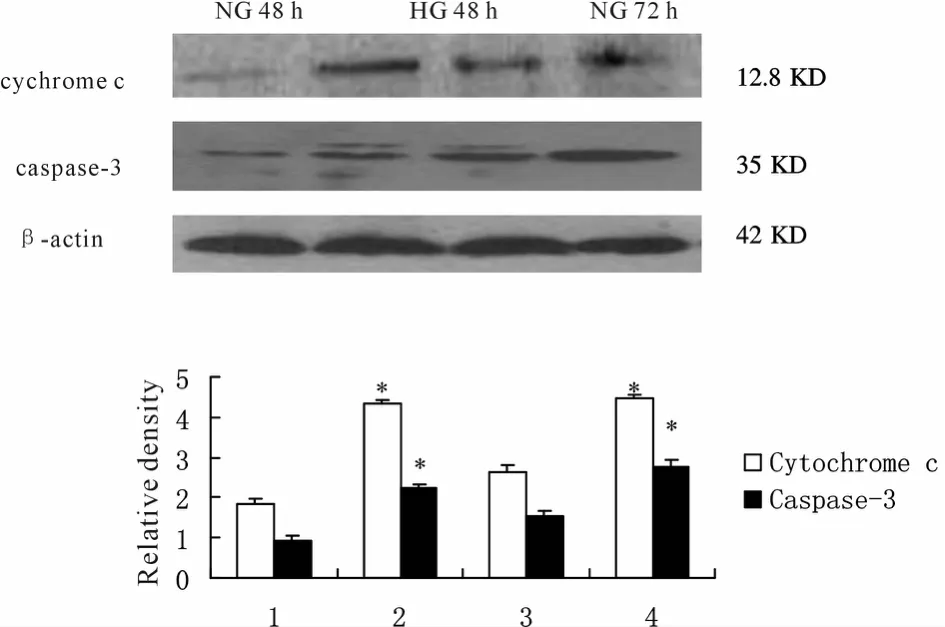
Fig.4 Expression of cytochrome C and caspase-3 protein in podocyte detected byWestern blot
3 讨论
糖尿病肾损害是糖尿病严重并发症之一,随着对肾小球滤过屏障结构、功能改变研究的深入,其主要组成部分足细胞在DN发生发展中的作用,逐渐成为研究热点。过多丢失足细胞会导致肾小球基底膜(glomerular basementmembrane,GBM)外露,与肾小球壁层上皮细胞黏连,形成肾小球硬化[1],并与 DN蛋白尿及肾功能损害密切相关[2]。足细胞是终末分化上皮细胞,缺乏再生能力,其损伤在肾小球疾病的起始与发展中发挥着重要作用。
凋亡是足细胞数量减少的重要原因之一,线粒体损伤途径是经典凋亡途径[3]。研究认为线粒体功能障碍起源的死亡信号在凋亡发生过程中起核心作用[4]。正常情况下,线粒体内膜上生物呼吸链的发生,使内膜两侧质子不均匀分布产生质子梯度,形成线粒体膜内负外正的电位差,即线粒体膜电位(mitochondrial transmembrane pitentials,ΔΨm),是维护其内外物质平衡,保持功能正常活动所必需的。ΔΨm的下降或者消失,使呼吸链断裂导致细胞死亡[4]。细胞色素 C(cytochrome C,cyt-c)是线粒体内第一个被鉴定出的细胞凋亡因子,cyt-c从线粒体释放后,不仅使线粒体呼吸链、电子传递受阻,细胞能量供应减少,还可水解caspase-9酶原成caspase-9,进一步水解 caspase-3酶原[5]。caspase-3是 caspase级联“瀑布”下游最关键的凋亡执行蛋白酶,活化的caspase-3激活核因子、细胞骨架蛋白及DNA裂解酶等,引起细胞形态的变化,最终导致细胞凋亡,研究认为caspase-3在各种因素启动的凋亡程序中起最后的枢纽作用[7]。
脑缺血/再灌注损伤中,线粒体跨膜电位崩解,呼吸链解耦联,线粒体基质渗透压升高,线粒体肿胀,外膜破裂,cyt-c进入胞质与Apaf-1和procaspase-9结合连同ATP构成凋亡体,激活procaspase-9后随之活化下游的caspase-3,最终导致依赖cyt-c和caspase途径的细胞凋亡[7]。在糖尿病大鼠肾损害过程中,DM组大鼠肾组织抗氧化防御能力受损,肾脏ΔΨm明显降低,提示高糖可导致线粒体损伤。我们的研究结果显示,高糖刺激的足细胞凋亡率于48 h较正常对照组明显升高,并随时间延长呈增多趋势。同时我们用罗丹明Rh123标记两组细胞,用流式细胞仪检测线粒体膜电位变化,结果显示高糖刺激组较正常糖对照组足细胞线粒体膜电位下降,且各时间点cyt-c、caspase-3表达较对照组增强,提示高糖刺激足细胞后可能通过引起线粒体功能障碍,cyt-c的释放,促发caspase细胞凋亡级联反应,caspase-3凋亡途径被激活并参与高糖诱导的足细胞凋亡机制。尽管这种作用机制尚未完全清楚,推测可能与下列因素有关:线粒体是结构和功能复杂而敏感的重要细胞器之一,很多因素如氧化应激过度、能量耗竭等均会引起线粒体功能受损,凋亡基因激活等级联反应,这些环节互为因果,相互联系,形成恶性循环,最终可导致细胞受损或凋亡,体内外实验均证实,高糖可引起氧化反应簇(reactive oxygen specie,ROS)产生增多,线粒体既是 ROS产生的主要部位,也是ROS攻击的首要靶点,高血糖时,ROS增多可能是线粒体损伤的主要原因,而线粒体功能障碍引起细胞凋亡又可能在糖尿病肾脏损害的发生和发展中起着关键作用。因此,保护肾脏线粒体功能,防护线粒体氧化损伤,可成为防治DN的新策略,并为临床新型药物的研发提供重要思路。
【参考文献】
[1] Pavenstadt H,Kriz W,Kretzler M.Cell biology of the glomerular podocyte[J].PhysiolRev,2003,83(1):253-307.
[2] Reddy G R,Kotlyarevska K,Ransom R F,etal.The podocyte and diabetes mellitus:is the podocyte the key to the origins of diabetic nephropathy?[J].CurrOpinNephrol Hypertens,2008,17(1):32-36.
[3] Lopez-Neblina F,Toledo A H,Toledo-Pereyra LH.Molecular biology of apoptosis in ischemia and reperfusion[J].InvestSurg,2005,18(6):335-350.
[4] Zhan R Z,Wu C,Fujihara H,etal.Both caspase-dependent and caspase-independent pathwaysmay be involved in hippocampal CA1 neuronal death because of loss of cytochrome c from mitochondria in a rat forebrain ischemia model[J].JCerebBloodFlowMetab,2001,21(5):529-540.
[5] Zhu S,Stavrovskaya IG,Drozda M,etal.Minocycline inhibits cytochrome c release and delays progression of amyotrophic lateral sclerosis in mice[J].Nature,2002,417(6884):74-78.
