β片层阻断肽联合人脐带间充质干细胞对APP转基因鼠的治疗作用*
2013-03-19孙凤仙徐艳玲林来祥徐淑梅
孙凤仙,王 曼,徐艳玲,林来祥,徐淑梅△
(1.天津医科大学生理学教研室,2.内分泌研究所,天津 300070)
老年痴呆症即阿尔茨海默病(Alzheimer’s Disease,AD),是一种发生于老年和老年前期以进行性认知障碍和记忆力损害为主的中枢神经系统退行性疾病。其病理变化主要表现为β-淀粉样蛋白(βamyloid peptide,Aβ)沉积于脑内所形成的老年斑(senile plaque,SP)、过度磷酸化的tau蛋白缠结形成的神经元纤维缠结(neurofibrillary tangle,NFT)及细胞凋亡等。
Aβ由β-淀粉样前体蛋白(β-amyloid precursor protein,APP)经β分泌酶和γ分泌酶水解产生,Aβ1-42错误折叠聚集可形成老年斑。众多证据表明Aβ的神经毒性作用是在多种因素导致AD发病的共同通路上,Aβ的神经毒性与其沉积有关,而Aβ二级结构中β-折叠的形成是聚集必需的,因此抑制Aβ的聚集成为治疗AD的一个重要途径。β片层阻断肽是一类专门针对Aβ设计并合成的多肽,能够抑制Aβ错误折叠和聚集,阻断其神经毒性,是一类新型的治疗老年痴呆的候选药物。
AD患者脑中胆碱能神经元大量丢失,乙酰胆碱受体数目减少,造成认知功能障碍[1]。因此补充脑内丢失的神经元也是治疗AD的一条途径。有研究表明,脐带间充质干细胞(human umbilical cord mesenchymal stem cell,hUCMSC)体外诱导可分化形成神经元细胞[2],从而解决了从脑组织分离神经干细胞所遇到的临床操作问题,更能避免免疫排斥反应,使得自体移植治疗阿尔茨海默病成为可能。有实验证实细胞凋亡是AD模型脑内神经元死亡丢失的主要方式[3],当补充神经元后,可能会反馈调节细胞凋亡的相关蛋白。在本实验研究了β片层阻断肽H102联合hUCMSC移植对APP转基因鼠的行为学、细胞凋亡、脑内tau蛋白中磷酸化及相关酶的影响。
1 材料与方法
1.1 材料
14月龄APP695V7171转基因小鼠32只,14月龄C57BL/6J小鼠8只,雌雄随机提供,购自中国医学科学院中国协和医科大学实验动物研究中心。H102用由上海吉尔生化有限公司固相合成法合成,高效液相色谱法纯化,经质谱仪(MS)分析鉴定纯度均>95%,DAB显色试剂盒、即用型SABC免疫组化试剂盒购自武汉博士德生物公司;NP-40购自Sigma-Aldrich公司;Bcl-2、Bcl-x1、Bax、Bad抗体及磷酸化微管相关蛋白抗体anti-P-Tau(Thr231)、糖原合酶激酶(GSK-3β)抗体、蛋白磷酸酯酶(PP-1)抗体、蛋白磷酸酯酶(PP-2A)抗体购于北京博奥森生物科技有限公司。MT-200 Morris水迷宫视频跟踪分析系统购自成都泰盟科技有限公司。
1.2 hUCMSC的分离及培养
取足月妊娠剖宫产健康胎儿的脐带,用 DHank’s缓冲液充分冲洗后,剪成大小约1 mm3的组织块,移至0.1%胶原Ⅳ中,搅拌消化并用10%FBS终止消化,用细胞筛过滤离心,加入DMEM/F12(含10%胎牛血清、25 mmol/L谷氨酰胺、100 U/ml青霉素及 100μg/ml链霉素培养液)。将培养皿置于37℃含有5%CO2的饱和湿度培养箱中培养。隔3~4 d更换培养基一次,连续培养10~13 d。当细胞贴壁生长至80%~90%融合后原代培养结束,离心收集分装单细胞悬液,传代培养。收集第三代细胞,每106个细胞加2μl的CM-Dil进行标记,37℃孵育5min,4℃冰箱放置15min后继续培养细胞。
1.3 给药方法
将32只AD小鼠随机分为4组,分别是:模型组,hUCMSC组,H102组,H102+hUCMSC组(n=8)。并设同月龄同背景C57BL/6J小鼠8只为正常对照组。10%水合氯醛(4 ml/kg)腹腔注射麻醉动物后,固定于脑立体定位仪上,参照George′s小鼠脑立体定位图谱,定位侧脑室(坐标 P-0.58,R1,H-1.5),植入不锈钢导药管套管,用牙科粉固定套管,缝合皮肤。手术1周后,用微量注射器自导药管给药,H102组及H102+hUCMSC组每天侧脑室注射80μmol/L的H102生理盐水溶液3μl,hUCMSC组及 H102+hUCMSC组,在给药的第1天经侧脑室注射hUCMSC(5×105cells/μl)3μl,对照组和模型组侧脑室注射等体积生理盐水,给药后管芯封闭套管。
1.4 Morris水迷宫测试 (Morris Water Maze,MWM)
给药2周和4周后,行Morris水迷宫实验。(1)定位航行实验:将平台置于水迷宫的第三象限中央,每天相同时段小鼠游泳训练2次,每次90 s,记录小鼠寻找并爬上平台所需时间即逃避潜伏期。若小鼠在90 s内未找到平台,则将其引至平台停留20 s,逃避潜伏期记为90 s,历时5 d。(2)空间探索实验:于水迷宫的第6日撤去平台,在相同时段每只小鼠游泳1次(每次90 s)。记录小鼠在平台所在象限停留时间(Residence time in the third quadrant,RTQ)、跨越隐匿平台的次数及游泳朝向角等指标,测试小鼠的记忆能力。
1.5 免疫组化染色
第4周Morris水迷宫实验结束后,小鼠断头取脑,一半脑组织放入4%多聚甲醛溶液内固定,一半脑组织分离海马与皮层放入液氮中备用。
组织切片常规脱蜡至水,枸橼酸缓冲液微波沸腾抗原修复,3%H2O2室温孵育10 min,阻断内源性过氧化物酶活性,正常山羊血清室温孵育15 min,滴加稀释的一抗(1∶200,),4℃过夜,生物素化二抗工作液室温避光孵育15 min,辣根酶标记物工作液室温避光孵育15min,DAB显色剂显色,镜下控制染色程度,苏木素复染,封片观察。阴性对照组用0.01 mol/L磷酸盐缓冲液(PBS)代替一抗进行免疫组化染色,其余步骤同上。
1.6 Western blot分析
于液氮中取出分离的小鼠海马和皮层组织,加入适量的裂解液匀浆,BCA法测定蛋白后调定各组蛋白为等浓度,加适量上样缓冲液,煮沸变性3 min。10%聚丙烯酰胺凝胶电泳分离蛋白后湿转到硝酸纤维素膜上,膜用5%脱脂奶粉室温封闭2 h,加入稀释的一抗(1∶400),4℃过夜,加入稀释的二抗(1∶2 000),室温下孵育1 h,然后化学发光法曝光。
1.7 统计学分析
所有数据以均数 ±标准差(±s)表示,利用SPSS 13.0数据处理系统,各组采用单因素方差分析法进行统计学分析。
2 结果
2.1 行为学测试结果
2.1.1 逃避潜伏期的比较 模型组小鼠的逃避潜伏期(82.95±6.73)s显著长于正常组(46.38±14.32)s(P<0.01);hUCMSC 2周组小鼠(80.65±12.80)s与模型组相比无差异;hUCMSC 4周组(56.01±10.37)s、H102组(49.92±9.72)s及 H102+hUCMSC组(49.37±8.74)s显著缩短了模型组的逃避潜伏期(P<0.01);H102组、H102+hUCMSC组效果显著好于 hUCMSC 4周组(P<0.01,图 1A)。
2.1.2 第三象限停留时间(RTQ) 模型组小鼠在第三象限停留的时间(16.5±4.57)s明显少于正常组(31.79±5.75)s(P<0.01);hUCMSC 2周组(21.13±2.85)s较模型组略有延长(P>0.05);hUCMSC 4周组(22.29±3.75)s、H102组(30.56±7.58)s及 H102+hUCMSC组(33.80±7.06)s与模型组比较延长较为显著(P<0.01);H102组、H102+hUCMSC组较hUCMSC 4周组延长更为明显(P<0.01,图 1B)。
2.1.3 小鼠跨越隐匿平台的次数及入水朝向角的比较 正常组小鼠跨越隐性平台的次数是模型组的9.5倍(P<0.01);与模型组相比,hUCMSC 2周组略有增加(P>0.05),hUCMSC 4周组(7.38±1.41)次、H102组(10.38±3.25)次及 H102+ hUCMSC组(10.75±2.60)次显著增多(P<0.01);H102组与H102+hUCMSC组较hUCMSC 4周组增多的更为显著(P<0.01,图 1C)。
模型组小鼠的入水朝向角(81.33±6.35)°显著大于正常组(25.90±8.0)°(P<0.01);hUCMSC 2周组(80.87±10.80)°较模型组略有减小(P>0.05);hUCMSC 4周组(52.54±8.71)°、H102组(33.20±8.22)°及 H102+hUCMSC组(31.00±10.83)°较模型组显著减小(P<0.01),其中 H102组及 H102+hUCMSC组较hUCMSC 4周组减小得更为明显(P<0.01,图 1D)。
2.2 免疫组化法测定细胞凋亡相关蛋白及tau蛋白磷酸化相关蛋白的表达
2.2.1 Bad、Bax的免疫组化检测 由结果可以看出模型组小鼠脑内Bad、Bax阳性细胞面积比值(皮层:0.35±0.05,0.34±0.02;海马:0.39±0.02,0.46±0.04)显著高于正常组(皮层:0.13±0.04,0.09±0.01;海马:0.18±0.032,0.21±0.01(P<0.01);hUCMSC 4周组(皮层:0.23±0.093,0.12±0.002;海马:0.28±0.02,0.34±0.02)、H102组(皮层:0.13±0.04,0.10±0.01;海马:0.18±0.02,0.21±0.05)及H102+hUCMSC组(皮层:0.13±0.05,0.10±0.01;海马:0.17±0.03,0.21±0.01)小鼠脑内 Bad、Bax阳性细胞比值显著降低(P<0.01);H102组、H102+hUCMSC组与hUCMSC 4周组相比降低的更为显著(P<0.01,图 2见彩图页Ⅳ)。
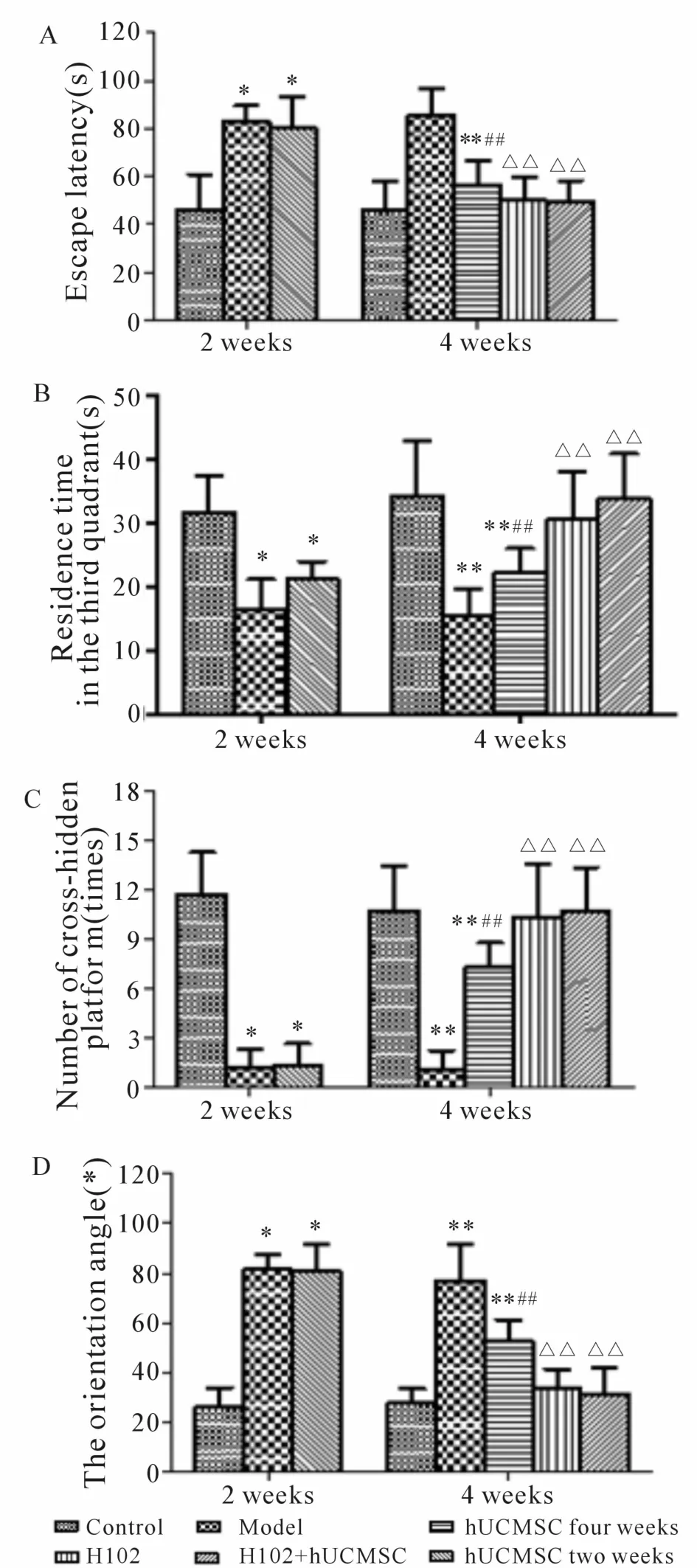
Fig.1 Effect of drugs on behavior ofmice in morris watermaze test(±s,n=8)
2.2.2 Bcl-2、Bcl-xl的免疫组化检测 模型组小鼠脑内 Bcl-2、Bcl-xl阳性细胞面积比值(皮层:0.08±0.02,0.11±0.01;海马:0.21±0.02,0.21±0.12)显著低于正常组(皮层:0.33±0.05,0.34±0.02;海马:0.41±0.02,0.43±0.02)(P<0.01);hUCMSC 4周组(皮层:0.24±0.02,0.22±0.02;海马:0.32±0.03,0.35±0.04)、H102组(皮层:0.32±0.04,0.33±0.01;海马:0.38±0.05,0.42±0.01)、H102+hUCMSC组(皮层:0.33±0.02,0.34±0.02;海马:0.41±0.02,0.42±0.02)较模型组蛋白表达显著增加(P<0.01),其中 H102组及 H102+hUCMSC组蛋白表达明显多于 hUCMSC 4周组(P<0.01,图2见彩图页Ⅳ)。

Fig. 2 Expressions of apoptosis relevant proteins in brain after four weeks(DAB ×400)
2.2.3 磷酸化 tau蛋白及GSK-3β的免疫组化检测模型组小鼠脑组织中P-tau蛋白及GSK-3β的阳性细胞面积比(皮层:0.41±0.06,0.44±0.04;海马:0.48±0.05,0.45±0.05)显著高于正常组(皮层:0.11±0.01,0.11±0.15;海马:0.11±0.02,0.11±0.01)(P<0.01);H102组(皮层:0.23±0.05,0.20±0.02;海马:0.19±0.02,0.12±0.01)及 H102+hUCMSC组(皮层:0.20±0.01,0.19±0.02;海马:0.18±0.02,0.11±0.01)脑组织中 P-tau蛋白及 GSK-3β的阳性细胞面积比较模型鼠明显降低(P<0.01,图3见彩图页Ⅳ)。

Fig. 3 Expressions of P-tau relevant proteins in brain after four weeks(DAB ×400)
2.2.4 PP-1及PP-2A的免疫组化检测 模型组小鼠脑内PP-1及PP-2A蛋白的阳性细胞面积比(皮层:0.09±0.02,0.10±0.01;海马:0.12±0.02,0.10±0.02)较正常组(皮层:0.34±0.04,0.42±0.05;海马:0.50±0.02,0.50±0.02)明显降低(P<0.01);H102组(皮层:0.29±0.02,0.26±0.04;海马:0.49±0.01,0.46±0.03)及 H102+hUCMSC组(皮层:0.30±0.01,0.46±0.03;海马:0.50±0.01,0.47±0.03)较模型组显著提高(P<0.01,图 3见彩图页Ⅳ)。
2.3 Western blot测定细胞凋亡相关蛋白及tau磷酸化相关蛋白的表达
2.3.1 Bad、Bax及 Bcl-2蛋白表达 模型组小鼠脑内Bad及Bax蛋白表达量分别是正常组的9.6倍、8.5倍(P<0.01);H102组 Bad及 Bax表达较模型组显著减少(P<0.01),为模型组的 11.8%、14.1%;H102+hUCMSC组也明显降低了模型鼠Bad及Bax表达(P<0.01),分别为模型组的 10.7%、12.1%(图4)。模型组小鼠脑内Bcl-2蛋白含量显著少于正常组(P<0.01),为正常组的 20.2%;H102组及H102+hUCMSC组较模型组Bcl-2表达显著增加(P<0.01),分别为模型组的 3.9倍、4.4倍(图 4)。
2.3.2 磷酸化tau蛋白及PP-2A蛋白表达 与正常组相比较,APP转基因模型组小鼠脑内P-tau蛋白表达明显增加(P<0.01),为正常组的 2.8倍;H102组、H102+hUCMSC组较模型组P-tau水平均显著降低(P<0.01),分别为模型组的 42.5%、41.0%;与H102组相比,H102+hUCMSC组脑内 P-tau略有减少(P>0.05,图5)。模型组小鼠脑内 PP-2A的表达显著低于正常组(P<0.01),为正常组的 42.4%;H102组、H102+hUCMSC组较模型组明显提高了模型鼠脑内 PP-2A的表达(P<0.01),为模型组的2.1倍、2.3倍(图 5)。
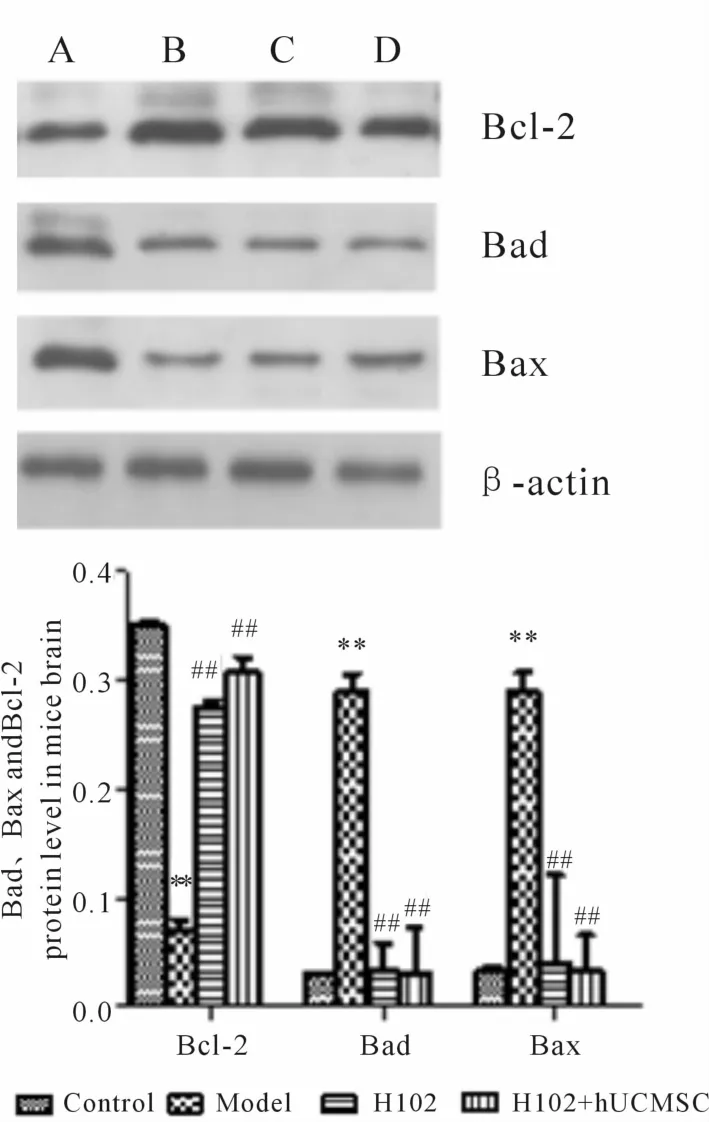
Fig.4 Expressions of Bcl-2,Bad and Bax in brain after four weeks(±s,n=8)

Fig.5 Expressions of P-tau and PP-2A in brain after four weeks(±s,n=8)
3 讨论
老年痴呆的一个重要的病理学特征就是老年斑。老年斑是由Aβ错误折叠聚集而形成,Aβ聚集在AD的发病机制中起着关键性的作用,因此抑制Aβ的聚集是治疗AD的一个重要途径。β片层阻断肽H102可与Aβ1-42的疏水氨基酸结合形成复合物,抑制了Aβ内部β-折叠的形成和β-折叠间的相互结合,减少Aβ聚合物的沉积,从而抑制其下游病理过程。本实验中H102给药组的学习记忆能力、Bcl-2、Bcl-xl、PP-2A及 PP-1的含量明显高于模型组,Bad、Bax、P-tau及 GSK-3β的含量明显低于模型组,说明β片层阻断肽H102有治疗AD的作用。
在AD患者脑内tau蛋白发生异常高度磷酸化,聚集形成不可溶的纤维状缠结,进而引起神经损害,最终导致AD患者神经系统退行性病变,智能广泛退化、记忆力缺失等一系列行为学的改变,因此tau蛋白在神经退行性病变过程中同样起着重要作用。tau蛋白的异常磷酸化主要与糖原合酶激酶 3β(glycogen synthase kinase-3β,GSK-3β)和蛋白磷酸酶(protein phosphatase,PP-1及 PP-2A)的调节失衡有关。已知在体外,GSK-3β可使tau蛋白中某些位点异常磷 酸 化,如 Ser199、Ser396、Ser400、Ser404、Ser422,特别是 Thr231磷酸化[4,5],而蛋白磷酸酯酶PP-2A、PP-1可以使磷酸化的tau蛋白在不同位点去磷酸化。AD患者的脑组织中,GSK-3β的活性明显增加[6],PP-1、PP-2A活性下降,且 PP-2A还可通过使GSK-3β去磷酸化而激活 GSK-3β,因此 PP-2A在tau蛋白磷酸化反应上起着重要作用[7]。
有学者证明,Aβ的低聚物可激活GSK-3β、促进tau蛋白的过度磷酸化[8]。本实验中我们通过APP转基因小鼠侧脑室注射药物H102及联合干细胞移植检测了P-tau蛋白、GSK-3β、PP-2A及 PP-1酶类的变化,由实验结果可知,H102注射组、H102与干细胞联合应用组脑组织中的P-tau、GSK-3β较模型组小鼠明显降低,而PP-2A、PP-1显著增多,说明通过抑制Aβ聚集可以减少NFT的形成。因此,本研究丰富与补充了Aβ级联假说与tau蛋白学说,为临床上以tau蛋白、GSK-3β、PP-2A、PP-1为靶点,治疗某些神经退行性疾病和精神性疾病以及筛选自主研制创新生物药提供了广阔的前景。
与认知、记忆有关的中枢胆碱能神经元主要分布在基底前脑的Meynert核和内侧隔核,通过边缘系统和大脑皮层调节学习记忆过程。在AD患者脑内的胆碱能神经元减少,导致乙酰胆碱的合成、储存和释放减少,造成学习记忆能力的减退,从而造成了认知功能障碍。若将能合成乙酰胆碱的细胞植入前脑基底核或海马,理论上讲是可以起到明显的治疗作用。且有大量实验已经证明某些部位的神经母细胞或分裂后的年幼神经元能够部分重建神经环路和功能。
2000年,Woodbury等[9]首次报道了人和啮齿类动物脐带MSC可在体外分化形成神经元表型的细胞。谢岷等研究表明,正常鼠和缺氧缺血性脑病损伤新生大鼠的脑组织上清液均能在体外诱导脐带MSC发生神经分化,为脐带MSC治疗神经退行性疾病带来了希望和曙光。进一步的研究表明脐带MSC体外诱导可分化形成胆碱能神经元表型的细胞,Mohsen Marzban等通过静脉注射hUCMSC治疗大鼠脑损伤模型,发现治疗组脑内神经营养因子分泌增多[10]。
神经元凋亡普遍存在于各种脑神经系统疾病的病理过程中。老年痴呆患者脑内存在大量凋亡的神经元,这是神经元减少、认知记忆功能减退的主要原因之一。在调节神经元凋亡的相关蛋白中,Bad、Bax两种蛋白可促进细胞凋亡;Bcl-2、Bcl-xl是抗凋亡分子,具有抑制细胞凋亡的作用。Aβ对神经元有直接导致凋亡的作用,也可能通过促进自由基的形成、破坏细胞内的钙离子稳态,降低K+通道的功能,增强活性分子的介导作用诱导神经元凋亡。
在本次实验中,注射hUCMSC 4周后明显改善了AD小鼠的记忆能力,降低了促细胞凋亡的相关蛋白Bad、Bax含量,增加了抑制细胞凋亡的相关蛋白Bcl-2、Bcl-xl的含量,这有力地说明了hUCMSC发挥了作用,其机制可能是hUCMSC在脑中分化为成熟的有功能的细胞,而且在细胞之间建立了联系,可以协同参与信号的传递,也可能是通过分泌神经生长因子等营养因子来发挥作用。实验结果也显示抑制凋亡的相关蛋白如Bcl-2,Bcl-xl蛋白在模型组显著减少,在H102组、H102+hUCMSC组明显的增加,而促进细胞凋亡的相关蛋白如Bad,Bax蛋白在模型组显著增加,在H102组、H102+hUCMSC组明显的减少。这有力地说明了H102在阻止细胞凋亡的过程中起到了明显的作用,H102与hUCMSC组联合应用较单独给药组在抑制细胞凋亡作用上略有提高。
由于hUCMSC定向分化成胆碱能神经元的量较少,如果在体外将脐带间充质干细胞诱导分化形成胆碱能神经元再进行移植可能会取得更为理想的效果。移植干细胞治疗AD的方法有待进一步研究。
【参考文献】
[1] Oddo S,LaFerla FM.The role of nicotinic acetylcholine receptors in Alzheimer’s disease[J].JPhysiolParis,2006,99(2-3):172-179.
[2] Dalous J,Larghero J,Baud O.Transplantation of umbilical cord-derived mesenchymal stem cells as a novel strategy to protect the central nervous system:technical aspects,preclinical studies,and clinicalperspectives[J].PediatrRes,2012,71(4Pt2):482-490.
[3] Yang D S,Kumar A,Stavrides P,etal.Neuronal apoptosis and autophagy cross talk in aging PS/APPmice,amodel of Alzheimer’s disease[J].AmJPathol,2008,173(3):665-681.
[4] De Felice F G,Wu D,Lambert M P,etal.Alzheimer’s disease-type neuronal tau hyperphosphorylation induced by a beta oligomers[J].NeurobiolAging,2008,29(9):1334-1347.
[5] Ma Q L,Yang F,Rosario E R,etal.Beta-amyloid oligomers induce phosphorylation of tau and inactivation of insulin receptor substrate via c-Jun N-terminal kinase signaling:suppression by omega-3 fatty acids and curcumin[J].JNeurosci,2009,29(28):9078-9089.
[6] Boonen R A,van Tijn P,Zivkovic D.Wnt signaling in Alzheimer’s disease:up or down,that is the question[J].AgeingResRev,2009,8(2):71-82.
[7] Planel E,Yasutake K,Fujita SC,etal.Inhibition of protein phosphatase 2A overrides Tau protein kinase I/glycogen synthase kinase 3βand cyclin-dependent kinase 5 inhibition and results in Tau hyperphosphorylation in the hippocampus of starvedmouse[J].JBiolChem,2001,276(36):34298-34306.
[8] HoshiM,Sato M,Matsumoto S,etal.Spherical aggregates ofβ-amyloid(amylospheroid)show high neurotoxicity and activate tau protein kinase I/glycogen synthase kinase-3β[J].ProcNatlAcadSciUSA,2003,100(11):6370-6375.
[9] Woodbury D,Schwarz E J,Prockop D J,etal.Adult rat and human bonemarrow stromal cells differentiate into neurons[J].JNeurosciRes,2000,61(4):364-370.
[10] Mohsen Marzban,Mehrdad Bakhtiary,Mehdi Mehdizadeh,etal.Intravenous injection of human umbilical cord matrix stem cell(Wharton Jelly Stem Cell)provides functional recovery in a ratmodel of traumatic brain injury[J].Yakhteh MedicalJ,2010,12(1):87-96.
