内毒素血症大鼠膈肌iNOS活性和凋亡相关基因表达的变化*
2013-03-19方迎艳关宿东郭晓磊叶红伟汪华学
方迎艳,关宿东,郭晓磊,叶红伟,汪华学,高 琴△
(1.蚌埠医学院生理学教研室,安徽 蚌埠233030;2.蚌埠医学院第一附属医院ICU,安徽 蚌埠233004)
内毒素的主要成分脂多糖是细菌致病的主要物质之一,进入机体可引起内毒素血症或脓毒血症,导致机体多器官损伤和功能障碍。呼吸功能障碍是内毒素血症最常见、致命的并发症之一,内毒素血症休克病程中膈肌收缩功能严重损伤,与结构型一氧化氮合酶(constitutive nitric oxide synthase,cNOS)和诱导型 NOS(inducible nitric oxide synthase,iNOS)显著激活有关[1,2]。近年来研究观察到,内毒素引起的膈肌损伤与局部炎性细胞因子产生过多、氧自由基明显增加和蛋白质水解途径(钙蛋白酶和半胱天冬酶 caspase)的激活密切相关[3],caspase-3可引起肌动蛋白和肌球蛋白释放,诱导膈肌无力[4]。本实验研究内毒素血症大鼠膈肌iNOS活性和细胞凋亡相关基因Bcl-2、Bax和caspase-3mRNA表达的变化,探讨内毒素血症膈肌损伤的细胞凋亡机制。
1 材料与方法
1.1 药品、主要试剂
沙门氏菌属精制内毒素L-2880购自Sigma公司;总RNA提取试剂(Trizol)购自Invitrogen公司;反转录试剂盒和PCR扩增试剂盒购自Fermentas公司;NOS(分型)、琥珀酸脱氢酶(succinate dehydrogenase,SDH)和蛋白定量检测试剂盒购自南京建成生物工程研究所。Bax、Bcl-2和caspase-3引物序列均由上海生工生物工程有限公司合成,引物序列如下:βactin(630 bp),上游:5'-GATGGTG GGTATGGGT CAGAAGGAC-3',下游:5'-GCTCATTGCCGA TAGTGATGACT-3';Bax(494 bp),上游:5'-GGATCGAGCAGAGAGGA TGG-3',下游:5'-TGGTGAGTGA GGCAGTGAGG-3’;Bcl-2(227 bp)上游:5'-CTGGTGGA CAACATCGCT CTG-3',下 游:5'-GGTCTGCTGACCTCA CTTGTG-3';caspase-3(349 bp),上 游:5'-AAGCC GAAACTCTTCA TC-3',下游:5'-TCAGCA TTGACAC AATACAC-3'。
1.2 实验动物及模型制备
成年雄性SD大鼠32只,体重为200~250 g,清洁级,由蚌埠医学院实验动物中心提供。随机分成4组(n=8):生理盐水对照组和内毒素24 h组,48 h组,96 h组,即内毒素腹腔注射12 mg/kg,分别于注射内毒素后 24 h、48 h、96 h处死大鼠[5],处死前称量各组大鼠体重。
1.3 膈肌标本的采集
水合氯醛麻醉后断头处死大鼠,速取膈肌并称重,计算膈肌重/体重比。在冰生理盐水漂洗后秤膈肌100 mg,液氮冻存后-80℃低温冰箱保存行 RTPCR检测备用,剩余部分-80℃低温冰箱保存生化指标检测备用。
1.4 膈肌组织iNOS、cNOS和SDH检测
取膈肌组织制成10%的组织匀浆,分别检测i-NOS、cNOS和SDH活性,严格按试剂盒说明书操作。
1.5 RT-PCR检测 Bcl-2、Bax和 caspase-3 mRNA的表达
取100 mg膈肌组织,采用Trizol一步法提取组织总RNA 3μg为模板,随机引物逆转录合成cDNA。一次 cDNA 1.5μl为模板 PCR扩增。扩增条件:95℃预变性 3 min后,以(1)95℃ 50 s变性;(2)βactin退火温度59.5℃,50 s;Bcl-2退火温度 61.7℃,50 s;Bax退火温度 62.3℃,50 s;Caspase-3退火温度55.6℃,50 s;(3)72℃ 60 s,反应 30个循环。取 5μl扩增产物用1.5%琼脂糖凝胶电泳,溴化乙锭显色。GIS凝胶处理系统拍摄记录,使用图像分析软件对条带进行光密度扫描做半定量分析,以目的基因与内参对照的积分吸光度比值(Bcl-2/β-actin;Bax/βactin;caspase-3/β-actin)表示 mRNA相对表达量。
1.6 统计分析
实验数据以均数±标准差(±s)表示。应用SPSS 16.0统计软件处理数据,各组采用单因素方差(one-way ANOVA)分析,并用 Newman-Keuls检验进行组间比较。
2 结果
2.1 大鼠体重和膈肌重/体重比
与正常对照组比较,内毒素血症大鼠96 h组体重和膈肌重/体重比值明显降低(P<0.05,P<0.01,表 1)。
Tab.1 Body weight and diaphragm/body weight ratio of rats(±s,n=8)

Tab.1 Body weight and diaphragm/body weight ratio of rats(±s,n=8)
*P<0.05,**P<0.01 vs control group
Group Body weight(g)Diaphragm weight/body weight(×10-3)Control 286.86±11.00 3.20±0.22 Endotoxin 24 h 285.63±12.66 3.22±0.22 Endotoxin 48 h 275.63±7.76 3.13±0.14 Endotoxin 96 h 253.13±7.99** 2.93±0.23*
2.2 膈肌组织NOS和SDH活性变化
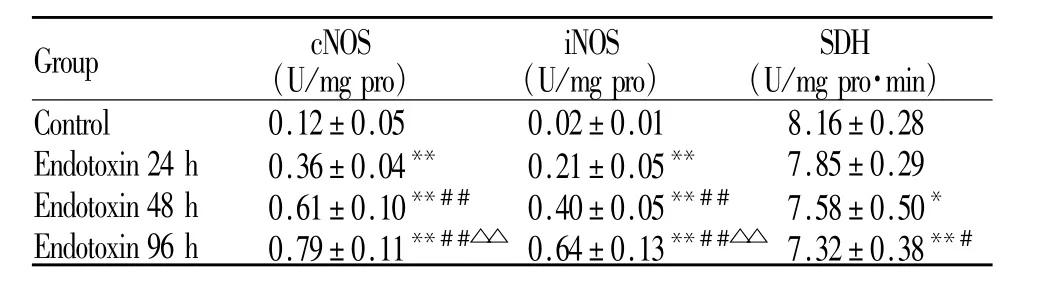
与正常对照组比较,内毒素血症大鼠膈肌cNOS和iNOS活性明显增强,48 h、96 h组较24 h组明显升高(P<0.01),24 h组较正常对照组显著升高(P<0.01);内毒素血症96 h和48 h组 SDH活性明显降低,96 h组较24 h组降低明显(P<0.05),24 h组与正常对照组无明显差别(表2)。
Tab.2 NOSand SDH activities of diaphragm tissue in rats(±s,n=8)
Tab.2 NOSand SDH activities of diaphragm tissue in rats(±s,n=8)
cNOS:Constitutive nitric oxide synthase;iNOS:Inducible nitric oxide synthase;SDH:Succinate dehydrogenase*P<0.05,**P<0.01 vs control group;#P<0.05,##P<0.01 vs endotoxin 24 h;△△P<0.01 vs endotoxin 48 h
G r o u p c N O S(U/m g p r o)i N O S(U/m g p r o)S D H(U/m g p r o·m i n )C o n t r o l 0.1 2±0.0 5 0.0 2±0.0 1 8.1 6±0.2 8 E n d o t o x i n 2 4 h 0.3 6±0.0 4** 0.2 1±0.0 5** 7.8 5±0.2 9 E n d o t o x i n 4 8 h 0.6 1±0.1 0**## 0.4 0±0.0 5**## 7.5 8±0.5 0*E n d o t o x i n 9 6 h 0.7 9±0.1 1**##△△ 0.6 4±0.1 3**##△△ 7.3 2±0.3 8**#
2.3 膈肌组织Bcl-2、Bax和caspase-3的变化
与正常对照组比较,内毒素血症大鼠膈肌Bax mRNA的表达显著升高,内毒素48 h、96 h组较24 h组明显升高,且96 h组较48 h组明显升高;Bcl-2mRNA的表达及Bcl-2/Bax mRNA比值明显降低,48 h、96 h组较24 h组有明显降低,且96 h组较48 h组明显降低(P<0.01,图 1A和图 1B,表 3);caspase-3 mRNA表达显著增强,48 h、96 h组较24 h组明显增强,且 96 h组较48 h组明显增强(P<0.01,图 1,表 3)。
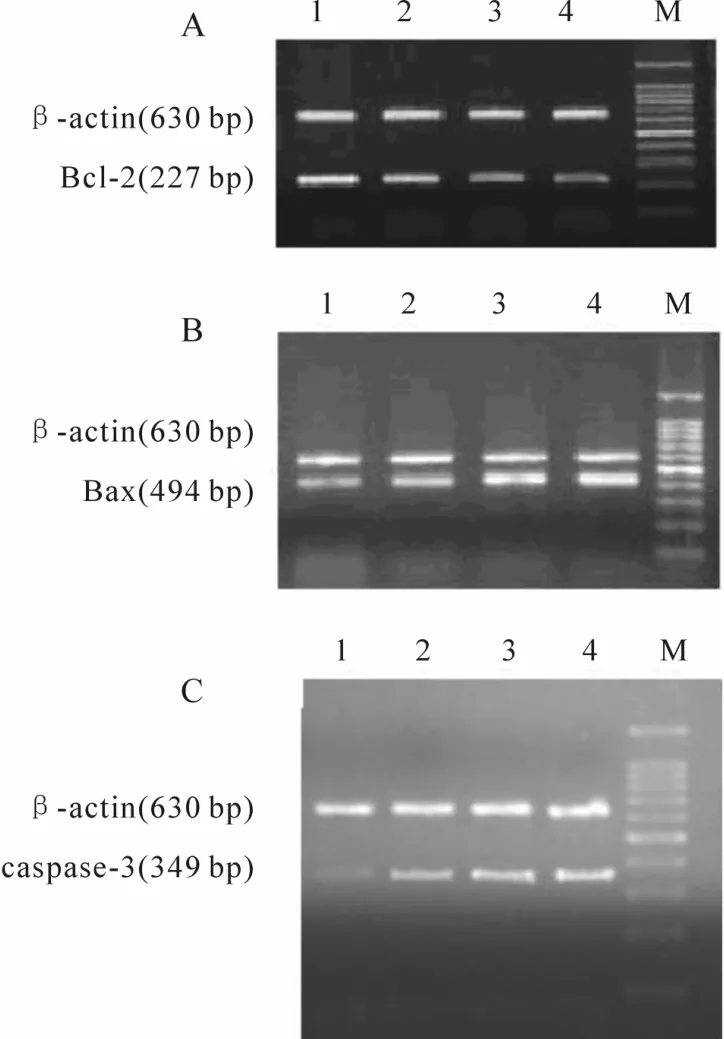
Fig.1 Changes of Bcl-2(A),Bax(B)and caspase-3(C)mRNA expressions of diaphragm tissue in rats
3 讨论
内源性一氧化氮主要是由NOS催化L-精氨酸生成。NOS主要包括三种:iNOS、内皮型 NOS(endothelial NOS,eNOS)和神经型 NOS(neuronal NOS,nNOS)。其中 eNOS与 nNOS合称为结构型 NOS(cNOS)。正常生理情况下,iNOS基因不表达,只有在内毒素和某些细胞因子的刺激下才能产生和表达,并在辅助因子和还原型辅酶Ⅱ的作用下生成大量一氧化氮(nitric oxide,NO)。脂多糖诱导的败血症休克大鼠模型,直接呈休克晚期症状,总NOS、iNOS和 cNOS表达增加[6],内毒素血症大鼠膈肌以cNOS为主要构型,iNOS显著激活,但NO途径可能不参与内毒素血症膈肌肌浆网释放Ca2+障碍[1],也不调控神经肌肉接头的信息传递,在膈肌收缩功能障碍中不发挥重要作用[2]。经 iNOS产生的NO发挥毒性作用,高浓度的NO在体内形成ONOO-,破坏线粒体结构的完整性,诱导线粒体膜通道开放,释放出细胞色素 C,引起 caspase的激活[7],同时还可上调肿瘤抑制蛋白p53,后者可上调促凋亡蛋白Bax和下调抗凋亡蛋白 Bcl-2[8],Bcl-2/Bax的比值影响细胞凋亡的发生。Bax可以导致凋亡促进因子从线粒体中被释放、下游caspase被活化和线粒体功能丧失,促进细胞发生凋亡[9]。目前 caspase-3是公认的凋亡过程中最重要的蛋白酶,是多条凋亡途径的共同下游效应部分,与多种细胞发生凋亡变化有密切关系。Caspase-3既是一种最重要的执行酶,同时也是凋亡发生的标志酶。脂多糖干预的大鼠心脏Bcl-2表达下降,Bax表达进一步增加,Bcl-2/Bax比值下降,随干预的时间延长,器官受损程度逐渐加重,细胞凋亡增加[10]。大鼠腹腔注射内毒素96 h后caspase-3活性显著增强,激活经caspase介导的膈肌无力[5]。SDH是所有需氧的细胞线粒体三羧酸循环(糖代谢途径)酶系中的一种脱氢酶,即线粒体标志酶和三羧酸循环的限速酶。
本实验中检测到:内毒素血症大鼠96 h组膈肌质量和SDH活性明显降低,说明膈肌萎缩和线粒体损伤;膈肌组织iNOS活性明显增强,并随干预时间的延长,激活明显增强;Bax和caspase-3 mRNA表达显著增加,Bcl-2 mRNA表达和 Bcl-2/Bax比值明显降低,并随着干预的时间延长,变化明显加剧,提示Bcl-2抑制凋亡的作用明显降低,Bax促凋亡作用增强,激活caspase-3,导致膈肌细胞凋亡,随着干预时间的延长,促凋亡的作用加强,启动膈肌细胞凋亡,促成膈肌萎缩。
Tab.3 Expressions of Bcl-2,Bax and caspase-3mRNA of diaphragm tissue in rats(±s,n=8)

Tab.3 Expressions of Bcl-2,Bax and caspase-3mRNA of diaphragm tissue in rats(±s,n=8)
**P<0.01 vs control group;##P<0.01 vs endotoxin 24 h;△△P<0.01 vs endotoxin 48 h
Group Bcl-2/β-actin Bax/β-actin Bcl-2/Bax Caspase-3/β-actin Control 0.88±0.04 0.49±0.06 1.18±0.26 0.14±0.01 Endotoxin 24 h 0.78±0.02** 0.68±0.07** 1.17±0.15** 0.29±0.03**Endotoxin 48 h 0.58±0.05**## 0.84±0.12**## 0.71±0.10**## 0.42±0.03**##Endotoxin 96 h 0.47±0.03**##△△ 1.07±0.12**##△△ 0.44±0.05**##△△ 0.54±0.05**##△△
综上所述,内毒素血症大鼠随病程的延长,膈肌组织iNOS活性显著增强,诱导产生NO的毒性作用损伤线粒体,上调促凋亡基因Bax和下调抑凋亡基因Bcl-2,启动经caspase-3的细胞凋亡途径,导致膈肌损伤和萎缩。
【参考文献】
[1] Liu SH,Lai JL,Yang R S,etal.Nitric oxide is not involved in the endotoxemia-induced alterations in Ca2+and ryanodine responses in mouse diaphragms[J].Naunyn SchmiedebergsArchPharmacol,2002,366(4):327-334.
[2] Sara Y,Ertunc M,Onur R.The role of nitric oxide on contractile impairment during endotoxemia in rat diaphragm muscle[J].EurJPharmacol,2004,505(1-3):177-186.
[3] Callahan L A,Supinski G S.Sepsis-induced myopathy[J].CritCareMed,2009,37(10 Suppl):S354-367.
[4] Supinski G S,Callahan L A.Caspase activation contributes to endotoxin-induced diaphragm weakness[J].JApplPhysiol,2006,100(6):1770-1777.
[5] SupinskiG S,Vanags J,Callahan L A.Effect of proteasome inhibitors on endotoxin-induced diaphragm dysfunction[J].Am JPhysiolLungCellMolPhysiol,2009,296(6):L994-1001.
[6] 叶挺梅,徐 策,高 琴,等.两种败血症休克模型大鼠心肌细胞一氧化氮合酶活性的改变[J].中国应用生理学杂志,2007,23(2):194-197.
[7] Brüne B,Zhou J,von Knethen A.Nitric oxide,oxidative stress,and apoptosis[J].KidneyIntSuppl,2003,(84):S22-24.
[8] Kolb JP.Mechanisms involved in the pro-and anti-apoptotic role of NO in human leukemia[J].Leukemia,2000,14(9):1685-1694
[9] 李永杰,王朝霞,高旭光,等.程序化细胞死亡分子5及其他凋亡调控蛋白在线粒体病患者骨骼肌中的表达[J].中华医学杂志,2009,89(23):1593-1596.
[10]肖铁卉,王士雯,陈艳明,等.内毒素血症时大鼠心肌细胞凋亡与血管紧张素受体表达关系的研究[J].中国应用生理学杂志,2012,28(3):275-279.
