发达国家及地区罕见病/罕用药界定策略分析
2013-03-17李春潇谢婧胡欣
李春潇谢婧胡欣
(1沈阳药科大学工商管理学院,辽宁沈阳110016;2卫生部北京医院临床药理室,北京100730)
发达国家及地区罕见病/罕用药界定策略分析
李春潇1,2谢婧1,2胡欣2
(1沈阳药科大学工商管理学院,辽宁沈阳110016;2卫生部北京医院临床药理室,北京100730)
目的:通过广泛研究发达国家及地区罕见病/罕用药政策,为我国相关政策制定提供参考。方法:应用文献研究法对发达国家及地区罕见病政策进行检索,发达国家及地区的筛选标准为联合国开发计划署发布的人文发展指数。结果和结论:多数发达国家及地区对罕见病制定了专门政策,各国罕见病界定策略大体分成三类:依照患病人数确定;依照发病率确定;无定量界定,接受民间自发呈报罕见病。罕见病/罕用药制定过程需综合考虑其自身社会发展程度、罕用药可及性、人口因素。人口较多的国家倾向采用患病人数作为定量标准界定罕见病,建议我国适当借鉴并采纳。
罕见病;罕用药;人口;人文发展指数
罕见疾病简称罕见病,又称孤儿病、罕见遗传病,常见特点为:遗传相关、严重影响生活质量、生命预期较短。世界卫生组织(WHO)定义,发病率为0.65‰~1‰的疾病可称为罕见病,目前已确认的罕见病近6 000种。我国部分专家建议,成人发病率低于1/500 000;儿童发病率低于1/10 000,可认定为罕见病[1]。药物是治疗罕见病的常用手段,人们通常将用于治疗、诊断、预防罕见疾病或罕见状态的药物、疫苗、诊断试剂等称为罕用药。罕用药的消费人群有限,获益预期较低,制药企业不愿开发或经营,罕用药因此又得名孤儿药。20世纪80年代,罕用药可及性问题受到关注,罕见病/罕用药政策已经成为体现国家公民健康权益的举措,是国家卫生政策必须考虑的部分。
我国罕用药几乎依赖进口,罕见病患者现状堪忧,加上我国人口众多,疾病谱复杂;医药企业无心关注罕见病种药物研发与生产;我国尚未定义罕见病,也未出台相应法规。上述国情构成我国罕见病认定和扶持政策制定环节的挑战,因此广泛借鉴主要发达国家及地区罕见病管理经验对我国具有重大意义。本文拟对国民健康水平、经济发展水平皆优的发达国家及地区的罕见病/罕用药界定策略进行汇总,以此作为借鉴。
本文借助人类发展指数(Human Development Index,HDI)作为筛选国民健康水平、经济发展水平皆优国家及地区的标准。HDI由联合国开发计划署(UNDP)设计发布,是用以衡量各国社会经济发展程度的指标体系,HDI根据平均预期寿命、识字率、国民的教育和生活水平赋权重计算出[2]。1990年以来,UNDP每年都发布世界各国的HDI,HDI可以一直作为国家综合发展水平的判断标准,支持国家间比较,在全球范围内颇有影响[3]。
1 资料与方法
1.1 信息检索
信息源:高HDI国家及地区出台相关罕见病政策,以及政府、药监部门、社会保险部门发布与罕见病或罕用药界定有关的网络资源和纸质材料;公共检索引擎提供的相关资源链接。
以“(Rare/orphan+disease/disorder/condition)”、“罕见病”、“罕有遗传病”;“(Orphan drug/orphan medicine/orphan medical product)”、“罕用药”、“孤儿药”作为检索词,进行单独或联合检索;检索语言:英语、汉语简体、汉语繁体。
1.2 纳入和排除标准
1.2.1 纳入标准 ①《人文发展报告 2011》[4]中HDI排序前15位国家及地区公布的罕见病政策,入选国家及地区依序分别为:挪威、澳大利亚、荷兰(欧盟)、美国、新西兰、加拿大、爱尔兰(欧盟)、列支敦士登、德国(欧盟)、瑞典(欧盟)、瑞士、日本、香港、冰岛(欧盟)、韩国;
②上述国家及地区中罕见病和罕用药界定政策;
③政策发布时间为1980年至今。
1.2.2 排除标准 ①《人文发展报告2011》公布的HDI排序前15位之外的国家及地区公布的罕见病政策;
②《人文发展报告2011》公布的HDI排序前15位之内国家及地区,但其相关材料语言不通,且无英语、汉语译本;
③公共搜索引擎提供信息或链接,但信息可信性差(不可追溯、非官方权威网站发布、第三方评论)。
1.3 资料提取与可信性评价
依据《人文发展报告2011》初步提取HDI排名前15位的国家及地区,由2名研究者独立检索阅读资料并提取相关信息,对提取的信息存有不同看法时通过协商达成一致。
为保证检索信息的充分和可信,对信息进行可信性分级:①一级:研究范围内政府或联合体常务部门制定和发布的通知、联邦(省、州)政府发布的政策通知、国家医药卫生监管机构官方主页发布的信息、国家保险机构官方主页发布的信息;②二级:研究范围内国家及地区主要的罕见病相关非政府组织(NGO)发布的通知或执行文件、研究范围内国家及地区政府发布材料中转述的他国罕见病政策、科研文献(同行评议)中对于相关国家及地区政策的客观评论;③三级:国家或地区权威报纸发布信息、各种论著书籍。
2 结果与分析
研究初期依据研究纳入和排除标准,对HDI前15位国家及地区进行信息初筛,简要信息见表1。依据资料可信性评价原则展开检索和汇总。
各国经过汇总,罕见病/罕用药界定策略大致可归纳为3种类型:①使用病例数界定罕见病;②使用发病率界定罕见病;③定性描述罕见病。
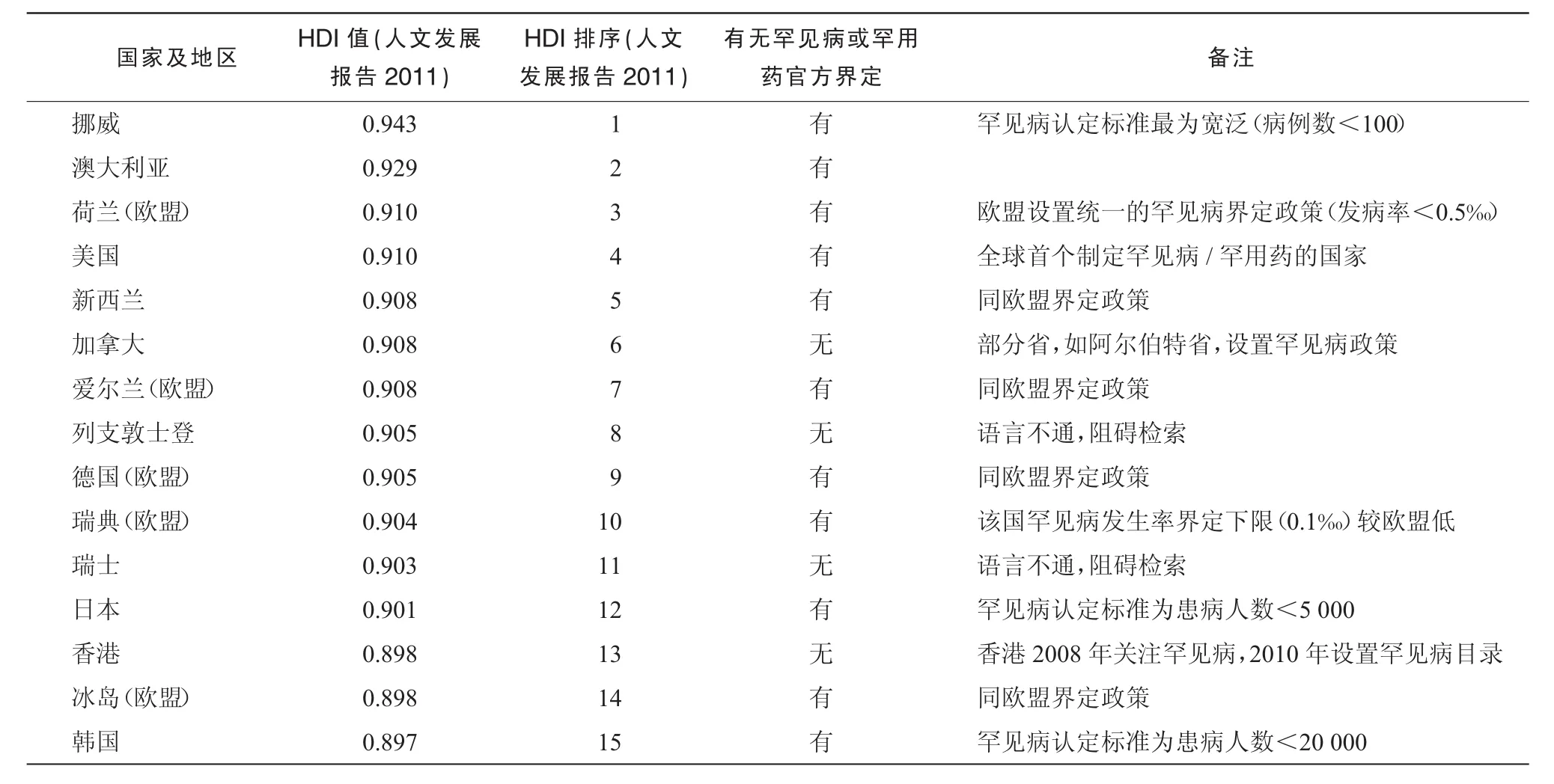
表1 检索结果简表
2.1 使用病例数界定罕见病
以病例数界定罕见病/罕用药的代表国家及地区是美国、挪威、澳大利亚、日本、韩国。
美国是最早对罕用药进行界定的国家,始于1981年。最初美国P.L.97-414法案规定,众多疾病例如亨廷顿综合征、Lou Gehrig综合征等,仅影响少部分美国公民,可认为罕见。适用于罕见疾病的药物即称为罕用药,药物的微薄收益不敷研发投入,政府需要对此类药物研发给予激励。后经过 1984、1985年的两次修订[5],该法案已十分健全,罕用药新增限定条件为:适应证为美国国内发病人数少于20万例的疾病;美国国内发病人数超过20万例,但该药品在美国的销售额根本不可能抵偿该药品研发和上市的成本[6]。
《罕用药法案》是美国最成功的法案之一,在其推动下世界开始关注罕用药研发。高HDI国家及地区中,挪威、澳大利亚、日本、韩国也借鉴了其定义策略。挪威定义病例数低于100即为罕见病[7]。澳大利亚于1998年修订“Therapeutic Goods Regulation 1990”,加入对罕用药的界定[8],虽然大部分为定性要求,但对于疫苗和体内诊断试剂产品,须证明使用患者少于2 000人/年。日本的罕用药需要达到 Article 77-2《药事法(Pharmaceutical Affairs Law)》要求,适用患者数低于5 000人,并且医疗需求较高,研发成功可能性较高[9]。韩国2003年颁布罕用药法案,推动研发的政策与美国相似,罕见病方面要求病例数不大于2万[10]。
2.2 使用发病率界定罕见病
以发病率界定罕见病的代表国家是上述欧盟成员国、新西兰。
2000年欧盟出台罕用药法案(141/2000 EC),其中规定罕见病为与遗传有关、致命性或为慢性消耗性疾病,通常其发病率较低,需要给予特别关注,按照欧盟指导意见,在欧盟地区内其发病率低于0.5‰即为罕见病。罕用药为适用于罕见病的药物[11]。上述高HDI欧盟成员国原则上均采纳欧盟意见[12-13],但是也可适当结合国情进行细化,如瑞典罕见病发病率限制为 1/10 000[14]。新西兰虽属大洋洲,但却采纳欧盟定义模式,定义发病率低于1/2 000者即可为罕见病[15]。
此外,虽然目前加拿大政府对罕见病的界定尚无定论,但是该国部分省份及有影响力的非政府组织采用发病率界定罕见病。Alberta省确定,罕见病发病率低于1/50 000或者患者数低于50;Ontario省确定,发病率为1/100 000至1/150 000的疾病可称为罕见病;非政府组织加拿大罕见病组织(The Canadian Organization for Rare Disorders)认为罕见病的发病率应低于1/2 000[16]。
2.3 将特异病种定义为罕见病
我国香港地区的罕见病界定策略是将特异病种定义为罕见病。
香港对于罕见病及罕用药并未确定实质定义,通常称类似疾病为“罕有遗传病”。罕见病主要是民间自发呈报,代表性的组织为“香港黏多糖症暨罕有遗传病互助小组”。在接到民间呈报后,医院管理局组织相关专业人员就药物有效性、经济性展开系统评价,而后统一报由特别行政区商定。香港特別行政区当局自2008年度起向医院管理局提供额外拨款一千万元,资助罕有遗传性溶酶体病患者进行特定激素替代药物治疗[17],至2010年制定 《2010-11年度政府财政预算案》,首次将6种罕用药纳入《医院药品目录》,品种分别为拉罗尼酶、艾度硫酸酯酶、加硫酶、阿糖苷酶α、阿加糖酶β、伊米苷酶,行政区对上述品种使用费用实行大额减免[18-19]。
3 讨论
3.1 高HDI国家及地区罕用药社会保障政策缺位原因探讨
就现有资料,除列支敦士登由于语言不通的原因无法确证外,仍有部分国家及地区罕用药界定政策存在缺位,原因可能是多方面的,由于概念界定直接关系罕用药研发激励措施,因此如果该国新药创制能力强或罕用药可及性较好,则无需界定。以加拿大为例,在美国出台《罕用药法案》后,加拿大即开始关注罕用药研发相关政策,但是1997年加拿大政府拒绝建立罕用药政策,其原因是63%的美国罕用药都可以在加拿大国内获得,而且现有法律条件并未限制罕用药开发[20]。
3.2 发达国家及地区罕见病/罕用药的界定策略与其国情相关
文中发达国家及地区筛选标准为HDI,其参考收入水平、期望寿命和教育程度这三个指标,可以较为全面反映一国富裕程度、健康水平。但是罕见病政策同样与该国人口直接相关,因此有必要补增各国人口信息,以对各国罕见病界定进行综合分析(见表2)。

表2 发达国家及地区国情及罕见病界定对比
采用病例数或发病率界定罕见病的国家及地区HDI排序均值接近,分别为6.8和8,但是人口数量差异巨大,均值相差近4倍(103.6/19.1)。由此可见,人口数量与国家及地区罕见病界定政策有关,即如果富裕程度相当,人口数量大的国家及地区倾向于以病例数界定罕见病。
香港地区的情况较为特殊:其HDI与日、韩、冰岛相似,人口众多而且同源性强,香港人口中超过90%都是华人,其中祖籍广东华人占据大部分。由此推测,将特异病种定义为罕见病的策略的必备要素是人口学特征相似。
综上所述,高HDI国家及地区通常会设置罕见病界定策略,在富裕程度和健康水平相似的情况下,人口多少通常影响界定策略的制定,人口大国更倾向选择以病例数定义罕见病。此外对于人口学特征相似、疾病谱相对简单的地区可以定义特异的病种为罕见病。
4 结语
罕见病的界定是建立在一定国家及地区富裕程度上的行为,文中涉及的HDI国家及地区都建立或拟定了罕见病政策。上述国家及地区对罕见病/罕用药的界定方面存有差异,人口基数大的发达国家及地区普遍采用患病人数作为罕见病认定标准。将特异病种作为罕见病的策略可能仅适用于人口学特征相对简单的地区。
与国际上高HDI国家及地区相比,人口多、底子薄的现状是我国罕见病界定工作的最大挑战。高HDI国家及地区代表着未来我国健康领域的前进方向。我国需要在广泛研究的基础上,以科学发展观的理念为指导,合理制定相关政策,保证罕见病患者有药可医。
[1] 中华慈善总会罕见病救助基金会.罕见病定义[EB/OL]. [2012-02-28].http://www.chinararedisease.cn/1-5-dingyi.html.
[2] UNDP.Calculating the human development indices[EB/OL].[2012-09-25].http://hdr.undp.org/en/media/HDR_20072008_Tech_Note_ 1.pdf.
[3] UNDP.History of the Human Development Report 2011[EB/OL]. [2012-02-09].http://hdr.undp.org/en/humandev/reports/.
[4]UNDP.Human development index and component[R].UNDP,2011:130.
[5] Redington L.The Orphan Drug Act of 1983:a case study of issue framing and the failure to effect policy change from 1990-1994 [R].Department of Health Policy and Management,School of Public Health,2009:30-36.
[6] FDA.Orphan Drug Act Excerpts[EB/OL].(2011-10-19)[2012-02-09].http://www.fda.gov/RegulatoryInformation/Legislation/FederalFoodDrugandCosmeticActFDCAct/SignificantAmendmentstothe-FDCAct/OrphanDrugAct/default.htm.
[7] Desser AS,Gyrd-Hansen D,Olsen JA,et al.Societal views on orphan drugs:cross sectional survey of Norwegians aged 40 to 67 [J].BMJ,2010,341:c4715.
[8] OLDP.Therapeutic Goods Regulations 1990[S/OL].(2009-09-10) [2012-03-01].http://www.comlaw.gov.au/Details/F2009C00561/ Html/Text#param74.
[9] MHLW.Overview of Orphan Drug/Medical Device Designation System[EB/OL].[2013-01-27].http://www.mhlw.go.jp/english/policy/health-medical/pharmaceuticals/orphan_drug.html.
[10] 刘炳林.国外孤儿药政策概述及启示[J].中药新药与临床药理,2002,13(5):332-333.
[11] European Parliament.Regulation (EC)No 141/2000 of the European Parliament and of the Council of 16 December 1999 on orphan medicinal products[S].2000-01-22.
[12] WGM.Orphan drug brochure(English version)[EB/OL].[2013-01-12].http://www.weesgeneesmiddelen.nl/?id=468.
[13] The Federal Ministry of Health.Rare disease (English version)[EB/OL].[2012-03-12].http://www.bmg.bund.de/praevention/ gesundheitsgefahren/seltene-erkrankungen.html.
[14] The Swedish Information Centre for Rare Diseases.Rare diseases [EB/OL].[2012-02-11].http://www.socialstyrelsen.se/rarediseases.
[15] National Health Committee.2011 referral template on new model of care[EB/OL].[2012-02-11].http://www.nhc.health.govt.nz/sites/ www.nhc.health.govt.nz/files/documents/pages/023%20-%20Rare% 20Disorders%20Plan.pdf.
[16] Priest L.National drug policy for rare diseases has fallen between the cracks [EB/OL].[2013-01-27].http://www.theglobeandmail.com/news/national/time-to-lead/national-drug-policy-forrare-diseases-has-fallen-between-the-cracks/article1970960/ page2/.
[17] 香港政府新闻处.立法会九题:罕有遗传病患者的治疗需要[EB/OL].(2009-05-06)[2012-03-01].http://www.info.gov.hk/gia/ general/200905/06/P200905060132.htm.
[18] 香港政府新闻处.财政预算案增拨12.4亿加强医疗服务[EB/OL].(2010-02-24)[2012-05-03].http://archive.news.gov.hk/isd/ebulletin/tc/category/healthandcommunity/html/39be4ca9-04b0-44d5-bda3-87610ab217a3.htm.
[19] 香港政府财政司.2010-11财政年度政府财政预算案[Z/OL].(2010-02-24)[2012-01-23].http://www.budget.gov.hk/2010/chi/ speech.html
[20] HCDD.Orphan drug policy[EB/OL].[2013-01-12].http://www. hc-sc.gc.ca/hpfb-dgpsa/tpd-dpt/orphdrug_e.pdf.
[21] Statistics Norway.Population statics[EB/OL].[2012-03-03].http://www.ssb.no/english/subjects/02/02/folkendrkv_en/2011k4/hittil00-en.html.
[22] ABS.Australia population[EB/OL].[2012-05-03].http://www.abs. gov.au/ausstats/abs@.nsf/94713ad445ff1425ca25682000192af2/ 1647509ef7e25faaca2568a900154b63?OpenDocument.
[23] USA,Census.Popclock[EB/OL].[2012-05-03].http://www.census.gov/population/www/popclockus.html.
[24] MIC.Japan’s population [EB/OL].[2013-01-27].http://www. stat.go.jp/english/data/handbook/c02cont.htm.
[25] Korea statis.Population(Korean version)[EB/OL].[2012-05-01]. http://www.index.go.kr/egams/stts/jsp/potal/stts/PO_STTS_Idx-Main.jsp?idx_cd=1009&bbs=INDX_001.
[26] National Population Estimates:September 2011 quarter[EB/OL].[2012-05-01].http://www.stats.govt.nz/browse_for_stats/population/estimates_and_projections/NationalPopulationEstimates_ HOTPSep11qtr.aspx.
[27] EUROSTAT.European population[EB/OL].[2012-05-01].http://epp.eurostat.ec.europa.eu/tgm/table.do?tab=table&language= en&pcode=tps00001&tableSelection=1&footnotes=yes&labeling=labels&plugin=1.
[28] Hong Kong Statistics.Population of HK[EB/OL].[2012-05-01]. http://www.censtatd.gov.hk/hong_kong_statistics/statistics_by_ subject/index.jsp?subjectID=1&charsetID=2&displayMode=T.
[29] National Bureau of Statistics of China.Communiqué of the National Bureau of Statistics of People’s Republic of China on Major Figures of the 2010 Population Census[1](No.1)[EB/OL].(2011-04-28)[2012-04-27].http://www.stats.gov.cn/english/newsandcomingevents/t20110428_402722244.htm.
Analysis of Definition of Rare Diseases and Orphan Drugs in Developed Countries
Li Chunxiao1,2,Xie Jing1,2,Hu Xin2
(1 School of Business of Shenyang Pharmaceutical University,Liaoning Shenyang 110016,China;2 Department of Clinical Pharmacology of Beijing Hospital of MoH,Beijing 100730)
Objective:To study the policies about rare diseases or orphan drugs in developed countries so as to provide a reference for the establishment of relative policies in China.Methods:Literature studies were conducted through retrieving the policies about rare diseases or orphan drugs in developed countries.The Human Development Index issued by the UN Development Programme was used as the screening standard for the definition of developed countries and regions. Results &Conclusion:Specific policies were made by most developed countries on rare diseases.The strategy for definition of rare diseases was set up mainly according to three factors such as sum of patients,incidence and spontaneously reported diseases without qualitative requirements.The level of social development,availability of orphan drugs,demographic characteristics were the key elements for each country or region to define rare disease.The countries with large populations preferred defining the rare diseases by sum of patients,which can be considered and learned by China.
Rare Diseases;Orphan Drug;Population;Human Development Index
10.3969/j.issn.1672-5433.2013.03.014
2012-04-10)
卫生行业科研专项基金(BJ-2010-1)
李春潇,男,在读硕士,研究方向:药事管理。E-mail:lichunxiao_arthur@163.com胡欣,男,主任药师。研究方向:医院药学和药事管理。通讯作者Email:huxinbjyy@126.com
