目标物诱导的等离子激元耦合以及表面增强拉曼光谱用于牛奶中三聚氰胺的检测
2013-03-14刘凤娟
陈 珂,刘凤娟,易 姿*,楚 霞
(1.湖南师范大学化学化工学院,湖南长沙410081)
(2.湖南大学化学化工学院,化学生物传感与计量学国家重点实验室,湖南长沙410082)
目标物诱导的等离子激元耦合以及表面增强拉曼光谱用于牛奶中三聚氰胺的检测
陈 珂1,刘凤娟2,易 姿2*,楚 霞2
(1.湖南师范大学化学化工学院,湖南长沙410081)
(2.湖南大学化学化工学院,化学生物传感与计量学国家重点实验室,湖南长沙410082)
该文报道了一种基于目标物诱导的等离子激元耦合以及表面增强拉曼光谱、利用未修饰的金纳米颗粒检测牛奶中三聚氰胺的新颖、免标记、易操作的纳米生物传感方法。三聚氰胺与聚T寡核苷酸的结合使得金纳米颗粒不稳定,从而导致盐诱导的单分散金纳米颗粒发生团聚。而团聚的金纳米颗粒能够产生等离子激元耦合,并引发了表面拉曼信号的增强。该方法不仅在设计上简单、直接,而且在具体实验操作中也是非常快速和方便的。该方法能够在实际牛奶样品中检测三聚氰胺,检测限为8 nmol/L。
三聚氰胺;表面增强拉曼光谱;牛奶;纳米生物传感器
0 引言
三聚氰胺(1,3,5-三嗪-2,4,6-三胺)是一种三嗪类含氮杂环有机化合物,它作为一种工业化学品,广泛应用于塑料、造纸、纺织、涂料、木材加工等行业。由于其含氮量高(66%)和成本低的特性[1],它经常会被不法商贩添加到食品中来提高蛋白质的含量。近年来,因食用添加了三聚氰胺的奶制品而导致婴幼儿中毒死亡的严重事故已经引起了全世界的关注。如今,许多国家已经对人类和动物食物中的三聚氰胺含量实行了监管和限制[2~3]。因此,目前急切需要发展一种简单、快速、经济高效和高灵敏度的技术用于三聚氰胺的检测。
一般来说,通过质谱法(MS)[4~6]、色谱法[7]、毛细管电泳法(CE)[8~9]、化学发光法[10~11]、电化学[12~13]或酶联免疫吸附法(ELISA)[14~15],都可以对食品中的三聚氰胺进行分析。在这些方法中,质谱法是检测三聚氰胺的最好方法,具有较高的灵敏度和特异性。然而,由于食品是一个典型的复杂基质样品,当检测食品中的三聚氰胺时,传统的质谱法通常需要预先进行较多步骤、较为繁琐的样品处理,并且由于需要利用分离技术(例如气相色谱法、液相色谱法以及毛细管电泳法等)来对基质进行分离,整个检测过程是非常耗时的。总的来说,这些传统的检测方法对于快速检测大量奶制品中的三聚氰胺含量并不合适。
表面增强拉曼散射(SERS)是一种超灵敏的振动光谱检测方法,它在纳米基底上检测样品能达到十亿分之一的水平,甚至达到单个分子水平的检测限[16~18]。由于其光谱的高特异性、理想的响应速度以及较好的光稳定性,表面增强拉曼散射方法在构建一个快速、方便、灵敏、具体的样品测定的传感器方面,得到了相当大的关注。最近,有研究表明,两个或多个金属纳米颗粒之间的纳米间隙与“拉曼热点”之间是相互联系的,而且当颗粒之间的间隙距离减小时,SERS强度会大大地增强[19~20]。也就是说,表面增强拉曼散射信号可以通过颗粒间的等离激元耦合电磁场的加强来得以调整。因为这种机制能够在维持高灵敏度的情况下进行简单的均相测定实验,因此,它在纳米传感器的发展方面也是一个极为理想的选择,例如,DNA的检测、酶控制的组装以及pH响应的聚合物构象变换等都可以使用这种方法。
在该文中,为了简化检测三聚氰胺的步骤并提高检测灵敏度,该文课题组设计了一种新型的纳米传感器,这种传感器是通过使用表面增强拉曼光谱的检测方法来对三聚氰胺进行检测。研究发现,三聚氰胺能够通过氢键选择性地与聚胸腺嘧啶(poly T)寡核苷酸结合。这一现象使得该文课题组构建出一种通过控制DNA保护的金纳米颗粒之间的等离激元耦合来高灵敏检测三聚氰胺的方法。在目标物控制的等离子激元耦合以及表面增强拉曼光谱转导的基础上,这种新型的纳米传感器展现了相当高的灵敏性和特异性,三聚氰胺在实际液体牛奶样品中可以检测到的下限为8 nmol/L,并且具有很宽的线性响应范围。
1 实验部分
1.1 试剂与仪器
三聚氰胺(纯度≥99%)购自上海百灵威化学有限公司,不需要进一步的纯化。氯金酸(HAuCl4)、结晶紫 (CV)、柠檬酸钠、KH2PO4、Na2HPO4和NaCl均购自上海国药集团化学试剂有限公司。无标记的、含有24个胸腺嘧啶的聚T寡核苷酸是由大连宝生物有限公司合成。所有试剂均为分析纯。实验中所用的超纯水由Millipore Milli-Q纯水净化仪(Billerica,MA,USA)获得(电阻值大于18.3 MΩ),并经过高温高压灭菌处理。
实验使用激光共聚焦显微拉曼仪(RamLab-010,Jobin Yvon,法国)进行拉曼检测。仪器包括一个内置的Olympus BX40显微镜和一个50倍的物镜。实验中所用的He-Ne发射激光波长是632.8 nm,能量约为5 mW,光谱分辨率为2 cm-1,曝光时间为10 s。拉曼仪器的狭缝宽度和共轭孔大小分别设置为100 μm和1 000 μm。紫外吸收光谱的检测是利用UV-2450(Shimadzu,Japan)紫外分光光度计测得。透射电子显微镜(TEM)成像图是由高清晰度2100F透射电子显微镜(JEOL,Japan)获得的,加速电压为200 kV。TEM分析样品的准备过程如下:将4 μL的样品溶液滴在碳膜覆盖的铜网上,然后在室温下自然晾干。
1.2 金纳米颗粒的制备
据文献报道[21~22],柠檬酸根保护的金纳米颗粒是通过柠檬酸钠还原氯金酸制备而成的。首先,实验中所用的玻璃器皿都浸泡在新配置的HNO3∶HCl=1∶3(V/V)溶液中,在使用前用超纯水冲洗干净后在空气中干燥。对于合成直径约为30 nm的金纳米颗粒,将100 mL,0.49 mmol/L的氯金酸溶液在500 r/min的转速下搅拌加热至沸腾,然后迅速加入2.3 mL,0.039 mol/L的柠檬酸钠溶液,几分钟后,溶液的颜色由浅黄色变成深红色,继续加热回流30 min,然后让其自然冷却至室温,再放在4℃下储存备用。合成好的金纳米颗粒会在530 nm处出现最大紫外吸收值,按照之前文献报道的方法,不同尺寸的金纳米颗粒是通过调节柠檬酸钠溶液的浓度来制备的[22~25]。
1.3 吸附了拉曼活性染料和聚T寡核苷酸的金纳米颗粒溶液的制备
无标记的聚T寡核苷酸和拉曼活性染料结晶紫(CV)是通过静电吸附覆盖在金纳米颗粒表面的。简要的说,将3 μL,10 μmol/L的聚T寡核苷酸,10 μL,10 μmol/L的 CV以及 10 μL,10 mmol/L的PB(pH7.4)缓冲液加入到50 μL约为1 nmol/L的金纳米颗粒溶液中,并在37℃下孵育20 min。
1.4 SERS检测三聚氰胺
将10 μL不同浓度的三聚氰胺样品溶液加入73 μL吸附了CV和聚T寡核苷酸的金纳米颗粒反应溶液中,然后在室温下孵育20 min。最后在反应后的混合溶液中加入8 μL,125 mmol/L的NaCl溶液和9 μL的H2O(使得最终总体积为100 μL),并立即进行SERS检测。
1.5 实际牛奶样品的检测
实际牛奶样品的处理方法是参考文献[26]并加以修改得到的。首先取6 mL市售的液体牛奶与1.8 μL三氯乙酸溶液混合,并孵育2 min将样品基质中的蛋白质沉淀下来。然后将混合物进行离心处理(10 000 r/min,5 min),再将离心后的上清液移至另一个离心管中用NaOH调节pH值至7。对上清液重复离心操作两次后,加入一定量的三聚氰胺,最后所得到的滤液用SERS纳米传感器进行检测。
2 结果与讨论
2.1 SERS方法检测三聚氰胺的基本原理
该文设计了一种新型的检测三聚氰胺的纳米传感器,它是基于目标物诱导的等离子耦合以及表面增强拉曼散射(SERS)来对三聚氰胺进行检测的。图1描述了这种SERS纳米传感器检测三聚氰胺的基本原理。这种纳米传感器是利用三聚氰胺控制金纳米颗粒的稳定性,使得金纳米颗粒发生团聚,同时产生等离激元耦合感应以及SERS传导来进行检测的。
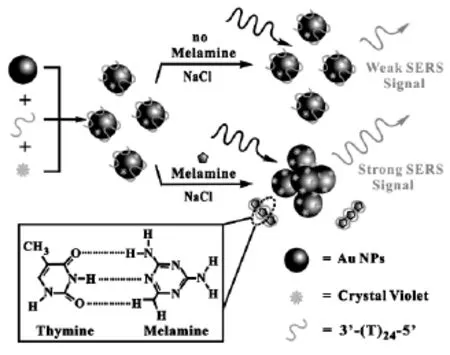
图1 目标诱导的等离激元偶合及表面增强拉曼光谱检测三聚氰胺的原理图Fig.1 Schematic illustration of the melamine sensing strategy based on target-controlled interparticle plasmon coupling and surface enhanced Raman scattering transduction
首先,通过静电吸附作用,聚T寡核苷酸和拉曼活性染料混合吸附在金纳米颗粒的表面。聚T寡核苷酸吸附到金纳米颗粒表面后,它的负电荷能够保证金纳米颗粒很好的分散在反应混合溶液中,并且保护金纳米颗粒在盐离子的诱导下不发生团聚。而三聚氰胺又能控制吸附了聚T寡核苷酸和拉曼活性染料的单分散金纳米颗粒,当三聚氰胺存在时,它能与聚T寡核苷酸在水介质中形成三重氢键,降低了金纳米颗粒表面的负电荷,从而导致金纳米颗粒不稳定,在加入NaCl溶液后,金纳米颗粒会发生团聚,拉曼信号增强。其结果是由于金纳米颗粒粒子表面电磁场的显著增强,粒子间产生强的表面等离激元耦合而引发的。因为目标物三聚氰胺能够将盐诱导的金纳米颗粒团聚控制在一个单步的过程中,因此,这就为三聚氰胺的检测提供了一种简单、快速、高灵敏和高特异性的方法。
2.2 SERS检测三聚氰胺的拉曼光谱及其对应的紫外吸收光谱
为了考察三聚氰胺检测的可行性,该文课题组进行了一系列的控制实验。如图2A所示,这是利用结晶紫(CV)作为拉曼报告分子对三聚氰胺进行SERS检测所得到的拉曼光谱图。吸附了CV的金纳米颗粒能够很好的分散在水溶液中,呈现红色,并且会产生一个非常弱的SERS信号(曲线a),这就意味着金纳米颗粒粒子间的距离太远以至于不能诱发粒子间的等离子激元耦合。当加入20 mmol/L的NaCl后,该溶液迅速褪色,最后几乎变为无色的,这就是一个典型的金纳米颗粒的团聚现象。此外,在该反应溶液中能检测到一个显著增强的拉曼信号(曲线b),这对于说明粒子间等离激元耦合引起的SERS信号增强是伴随着金纳米颗粒的团聚而产生的,提供了一个非常明显的证据。

图2 (A)不同情况下所得到的拉曼光谱图,其中:(a)Au NPs+CV;(b)Au NPs+CV+NaCl;(c)Au NPs+ CV+DNA+NaCl;(d)Au NPs+CV+DNA+三聚氰胺+NaCl;(B)图(A)中相对应体系的紫外吸收光谱图,插图为对应体系的照片Fig.2 Typical SERS(A)and UV-vis absorption(B)spectra obtained in melamine assay:(a)AuNPs+CV;(b) AuNPs+CV+NaCl;(c)AuNPs+CV+NaCl+DNA;(d)AuNPs+CV+NaCl+DNA+melamine.The inset is the photograph of the corresponding systems.The concentrations of NaCl,DNA,CV and melamine are 20 mmol/L,300 nmol/L,0.1 μmol/L and 10 μmol/L,respectively
在进行三聚氰胺检测实验时,当不存在三聚氰胺的情况下,加入20 mmol/L的NaCl溶液,吸附了聚T寡核苷酸和CV的金纳米颗粒的颜色没有明显的变化,SERS信号也并没有得到增强(曲线c),这就说明聚T寡核苷酸能够保护金纳米颗粒稳定地存在于盐溶液中,从而抑制了粒子间的等离激元耦合的发生。与此相反,当目标物三聚氰胺与吸附了聚T寡核苷酸和CV的金纳米颗粒孵育20 min后,加入NaCl溶液,溶液颜色由红色褪色至接近无色,这表明金纳米颗粒发生团聚,并且发生了粒子间的表面等离激元耦合,使得SERS信号得到非常大的增强(曲线d)。
图2B所描述的是为与上述情况相对应的紫外吸收光谱图,当金纳米颗粒发生团聚、SERS强度大大增加时,伴随的是所对应紫外光谱的扩宽和红移(见图2B中曲线b和d);相反,当金纳米颗粒很好的分散在溶液中,不发生SERS信号增强时,紫外吸收光谱则会在530 nm处出现一个很强的表面等离激元共吸收振峰 (见图2B中曲线a和c)。
透射电子显微镜(TEM)成像图(如图3所示)进一步描述了该方法用于三聚氰胺实验时金纳米颗粒的状态,在没有三聚氰胺存在下,金纳米颗粒呈分散状态,在有三聚氰胺存在下,金纳米颗粒则呈现团聚状态。在实验中,由于等离激元耦合引起的SERS增强对聚T寡核苷酸与三聚氰胺的结合具有很高的特异性,而且仅需简单地将分析物和反应缓冲液相混合,并且孵育不超过20 min,因此,这种生物传感器方法提供了在均相中免标记检测三聚氰胺的一个简单、快速和高特异性的平台。
2.3 实验条件的优化
粒子间的等离激元耦合在很大程度上决定于金属颗粒的大小、形状以及拉曼染料和聚T寡核苷酸的浓度。为了优化这些实验条件,利用发生等离激元耦合的金纳米颗粒团聚体产生的SERS强度与没有发生等离激元耦合的单分散金纳米颗粒产生的SERS强度的比值来进行考察。这项考察手段反应了在有和没有三聚氰胺存在的情况下SERS响应强度之间的对比。图4描述了不同粒径的金纳米颗粒对SERS响应的影响。从图中可以看出,较大尺寸的金纳米颗粒在电磁场中表现出较好的SERS增强效果,但是粒径为60 nm的金纳米颗粒与粒径为30 nm的金纳米颗粒相比较,仅呈现出非常微弱的优势。并且聚T寡核苷酸浓度很高的情况下,粒径为60 nm的金纳米颗粒在盐溶液中的稳定性并没有30 nm的金纳米颗粒在盐溶液中的稳定性好。所以,选择30 nm的金纳米颗粒用于所构建的传感器。

图3 不同情况下的透射电子显微镜图(TEM):(A)不存在三聚氰胺时;(B)存在三聚氰胺时Fig.3 TEM images of polythymine-stabilized AuNPs in the absence(A)or presence of(B)10 μmol/L melamine
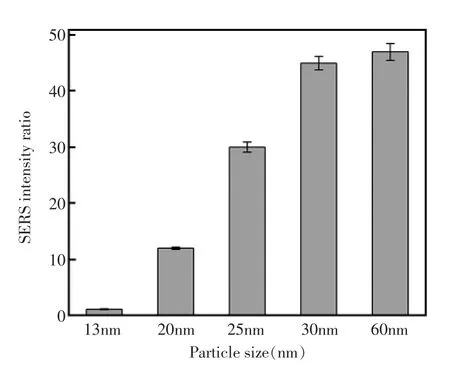
图4 金纳米颗粒尺寸大小的优化,实验中NaCl、聚T寡核苷酸、CV和三聚氰胺的浓度分别为:20 mmol/L、300 nmol/L、0.1 μmol/L和10 μmol/L。误差棒是四次独立的实验的标准偏差Fig.4 Dependency of SERS intensity ratio values on the size of AuNPs.The concentrations of NaCl,polythymine, CV,and melamine were 20 mmol/L,300 nmol/L,0.1 μmol/L,and 10 μmol/L,respectively.Error bars are standard deviation of three repetitive experiments
另外,对CV的浓度进行了优化。从图5A中可以看到,当CV的浓度为0.1 μmol/L时,SERS强度的比值能够达到最大。然而,较高浓度的CV会导致SERS强度的减小,其主要原因是,当三聚氰胺加入时,高浓度的拉曼报告分子会阻碍单链DNA很好的保护金纳米颗粒,并且导致金纳米颗粒的团聚。因此,选择0.1 μmol/L为最佳的CV浓度用于该传感器中。最后,聚T寡核苷酸浓度的优化也是非常重要的。选择含有24个胸腺嘧啶的聚T寡核苷酸用于该传感器。图5B是聚T寡核苷酸的浓度与SERS响应的关系图。从图中可以看出,聚T寡核苷酸的浓度太低,则不能很好的保护金纳米颗粒,而聚T寡核苷酸的浓度过高,则会导致金纳米颗粒无法团聚从而背景信号过高。因此,选择能够实现SERS最大强度的300 nmol/L的聚T寡核苷酸浓度来用于后续的实验中。
2.4 SERS方法检测三聚氰胺的工作曲线
在优化后的实验条件下,对SERS方法检测三聚氰胺的灵敏性进行了考察。图6描述了目标物三聚氰胺在不同浓度下的SERS强度响应。从图中可以看出,随着三聚氰胺的浓度增加,SERS的峰强度也逐渐增加,这表明,在高浓度的目标物存在下,金纳米颗粒会发生团聚且发生了增强的等离激元耦合。在0.01 μmol/L到10 μmol/L的三聚氰胺检测浓度范围内,1 612 cm-1处的SERS峰面积与三聚氰胺的浓度是呈线性关系的,根据空白响应的3倍标准偏差准则,估算三聚氰胺的检测下限为4.5 nmol/L。如此低的检测下限明显的优于现有的检测三聚氰胺的方法[1,11~12],这就表明所设计的传感器具有非常高的灵敏性。
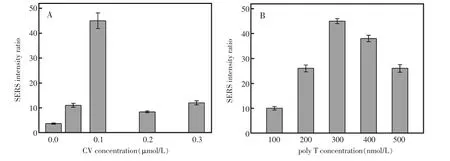
图5 实验条件的优化:(A)不同浓度的CV对SERS强度比值的影响;(B)不同浓度的聚T寡核苷酸对SERS强度的影响。误差棒是四次独立的实验的标准偏差Fig.5 Dependency of SERS intensity ratio values on the concentrations of CV(A)and polythymine(B).The concentrations of NaCl and Melamine were 20 mmol/L and 10 μmol/L,respectively.Error bars are standard deviation of three repetitive experiments
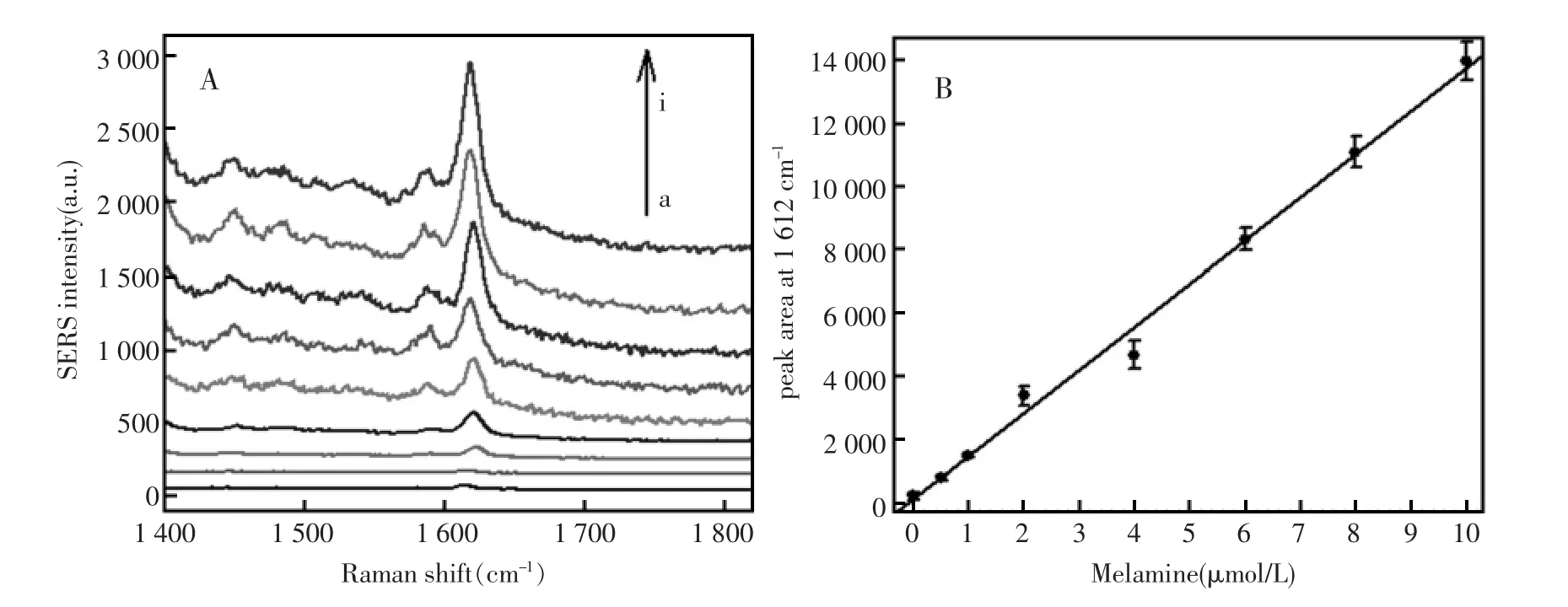
图6 (A)在不同浓度三聚氰胺存在下产生的SERS光谱图;(B)1 612 cm-1处SERS峰面积与三聚氰胺浓度的关系图。三聚氰胺的浓度从a到i分别是:0 μmol/L,0.01 μmol/L,0.5 μmol/L,1 μmol/L,2 μmol/L, 4 μmol/L,6 μmol/L,8 μmol/L and 10 μmol/L。误差棒是四次独立的实验的标准偏差Fig.6 (A)Typical Raman spectra of the nanosensor in response to melamine of varying concentrations.(B)Raman peak areas at 1 612 cm-1versus different melamine concentrations.The concentrations of melamine are(from a to i), respectively.The error bars indicate the standard deviations of three independent experiments
2.5 选择性的考察
对于传感器性能的考察,选择性是除了灵敏性以外的另一个重要考察因素,特别是在传感器实际样品的检测中,目标物对于其它潜在竞争物质的高选择性是非常有必要的。因此,该文课题组所拟建的SERS纳米传感器的选择性实验将在三聚氰胺的类似物以及牛奶中常见的离子和辅料中进行。图7A是三聚氰胺和其它干扰物质的SERS响应光谱图,图7B是各种干扰物质所对应在1 612 cm-1处的SERS峰面积的柱状图,从图中可以发现,所选择的十四种干扰物质用于该传感器几乎检测不到任何表面增强拉曼散射信号。这就表明,该文课题组所设计的纳米传感器方法来检测三聚氰胺具有很高的选择性。
2.6 实际牛奶样品中三聚氰胺的检测
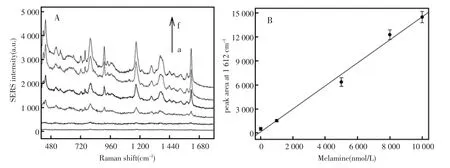
图8 (A)在不同浓度三聚氰胺存在于实际牛奶样品中产生的SERS光谱图;(B)1 612 cm-1处SERS峰面积与实际牛奶样品中三聚氰胺浓度的关系图,误差棒是四次独立的实验的标准偏差Fig.8 (A)Typical Raman spectra of the nanosensor in response to melamine of varying concentrations in real liquid milk samples.(B)Raman peak areas at 1 612 cm-1versus different melamine concentrations.The concentrations of melamine are 0 μmol/L,0.1 μmol/L,1 μmol/L,5 μmol/L,8 μmol/L and 10 μmol/L(from a to f),respectively.The error bars indicate the standard deviations of three independent experiments
最后,考察了该纳米传感器在实际应用中的可行性,该文课题组从超市购买液体牛奶,并将不同浓度的三聚氰胺加入到处理后的牛奶中进行SERS检测。正如预期的那样,表面增强拉曼光谱峰强度会随着牛奶中加入三聚氰胺浓度的增大而增强。如图8中所示,在0.01 μmol/L到10 μmol/L的三聚氰胺检测浓度范围内,1 612 cm-1处的SERS峰面积与三聚氰胺的浓度是呈线性关系的,根据空白响应的3倍标准偏差准则,估算的三聚氰胺的检测下限为8 nmol/L。这个检测下限比法律所规定的牛奶中三聚氰胺的含量还要低三个数量级(中国和FDA规定的婴幼儿配方奶粉中三聚氰胺的含量为7.9 μmol/L,其他奶制品中三聚氰胺的含量为 19.75 μmol/L,欧盟委员会规定奶制品中三聚氰胺的含量为19.75 μmol/L)[1~2]。此外,基于该纳米传感器的均相分析模式,该传感器具有非常好的重现性。
对含有0.1 μmol/L、1 μmol/L、8 μmol/L和10 μmol/L的三聚氰胺样品分别进行了三次重复测定,得到1 612 cm-1处的拉曼峰值的相对标准偏差分别为3.0%、2.5%、0.8%、0.7%和1.6%。同样,通过对三聚氰胺回收率的测定,对该传感器检测三聚氰胺的准确度进行了考察。如表1所示,含有四个不同浓度的三聚氰胺牛奶样品,三聚氰胺的回收率范围从98.7%到108%,这证明该文课题组所设计的纳米传感器在实际样品中检测三聚氰胺是非常可靠的。这些结果表明,该文课题组所发展的这种纳米传感器为三聚氰胺的检测提供了一个非常理想的、简单的、灵敏度高的、可靠的平台。
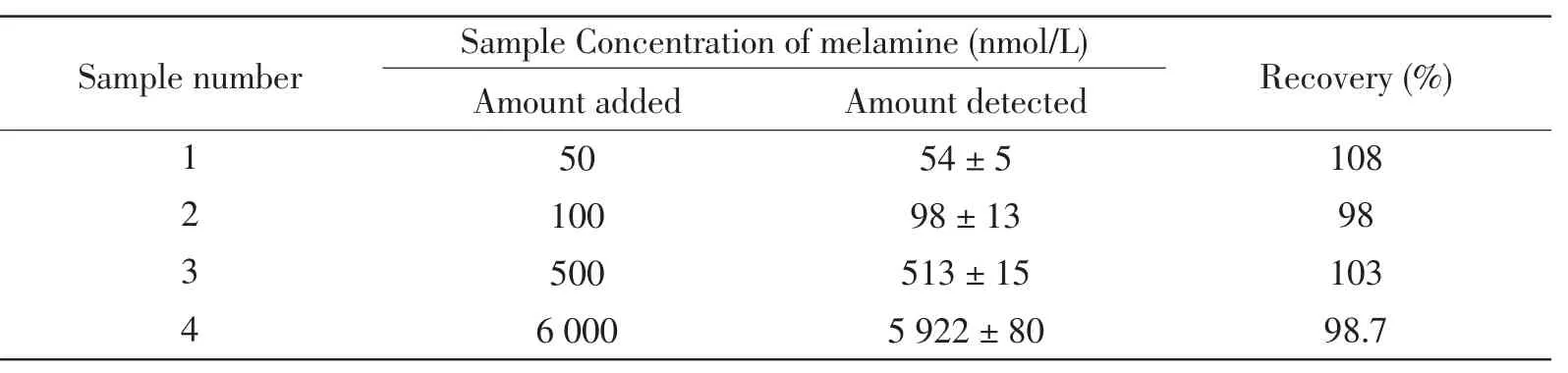
表1 牛奶样品中三聚氰胺的回收率测定Tab.1 The performance of the developed SERS nanosensor in recovery experiments
3 结论
该文发展了一种新型的表面增强拉曼光谱传感器,该传感器是基于目标物诱导的等离子激元耦合来实现对三聚氰胺的检测。三聚氰胺与聚T寡核苷酸的结合破坏了金纳米颗粒在盐溶液中的稳定性,引起金纳米颗粒发生团聚现象,从而产生非常强的等离激元耦合表面增强拉曼信号。由于目标物诱导的粒子间的等离激元耦合以及表面增强拉曼信号增强的高效性,该文课题组所发展的这种纳米传感器在三聚氰胺的快速检测中具有很高的灵敏性和选择性,并且在液态牛奶样品中能检测到三聚氰胺的最低检测下限为8 nmol/L。由于这种技术使用了无标记的金纳米颗粒和单链DNA,并且是在均相中进行简单的操作,因此它能够对数百个样品进行快速、简单、高效率的检测,在三聚氰胺的常规分析中具有相当大潜力,并为三聚氰胺的检测提供了一个很好的平台。
[1]Ai K L,Liu Y L,Lu L H.Hybrogen-bonding recognitioninduced color change of gold nanoparticle for visual detection of melamine in raw milk and infant formula[J]. Journal of the American Society,2009,131(27):9 496~ 9 497.
[2]Mauer L J,Chernyshova A A,Hiatt A,et al.Melamine detection in infant formula powder using near-and midinfrared spectroscopy[J].Journal of Agricultural and Food Chemistry,2009,57(10):3 974~3 980.
[3]Lam C W,Lan L,Che X Y,et al.Diagnosis and spectrum of melamine-related renal disease:Plausible mechanism of stone formation in humans[J].Clinca Chimica Acta, 2009,402(1-2):150~155.
[4]Fligenzi M S,Tor E R,Poppenga R H,et al.The determination of melamine in muscle tissue by liquid chromatography/tandem mass spectrometry[J].Rapid Communications in Mass Spectrometry,2007,21(24):4 027~4 032.
[5]Tang H W,Ng K M,Chui S S Y,et al.Analysis of melamine cyanurate in urine using matrix-assisted laser desorption/ionization mass spectrometry[J].Analytical Chemistry,2009,81(9):3 676~3 682.
[6]Yang S P,Ding J H,Zheng J,et al.Detection of melamine in milk products by surface desorption atmospheric pressure chemical ionization mass spectrometry[J].Analytical Chemistry,2009,81(7):2 426~2 436.
[7]Tsai I L,Suna S W,Liao H W,et al.Rapid analysis of melamine in infant formula by sweeping-micellar electrokinetic chromatography[J].Journal of Chromatography A,2009,1216(47):8 596~8 303.
[8]Xia J G,Zhou N Y,Liu Y J,et al.Simultaneous determination of melamine and related compounds by capillary zone electrophoresis[J].Food Control,2010,21(6): 912~918.
[9]Cook H A,Klampfl C W,Buchberger W.Analysis of melamine resins by capillary zone electrophoresis with electrospray ionization-mass spectrometric detection [J].Electrophoresis,2005,26(7-8):1 567~1 583.
[10]Wang Z M,Chen D H,Gao X,et al.Subpicogram deter-mination of melamine in milk products using a luminolmyoglobin chemiluminescence system[J].Journal of Agricultural and Food Chemistry,2009,57(9):3 464~ 3 469.
[11]Zeng H J,Yang R,Wang Q W,et al.Determination of melamine by flow injection analysis based on chemiluminescence system[J].Food Chemistry,2011,127(2): 842~846.
[12]Cao Q,Zhao H,Zeng L X,et al.Electrochemical determination of melamine using oligonucleotides modified gold electrodes[J].Talanta,2009,80(2):484~488.
[13]Zhu H,Zhang S X,Li M X,et al.Electrochemical sensor for melamine based on its copper complex[J].Chemical Communications,2010,46(13):2 259~2 261.
[14]Liu J X,Zhong Y B,Liu J,et al.An enzyme linked immunosorbent assay for the determination of cyromazine and melamine residues in animal muscle tissues[J]. Food Control,2010,21(11):1 482~1 487.
[15]Eric A E G.Detection of melamine using commercial enzyme-linked immunosorbent assay technology[J].Journal of Food Protection,2008,71(3):590~594.
[16]He L L,Liu Y,Lin M S,et al.A new approach to measure melamine,cyanuric acid,and melamine cyanurate using surface enhanced Raman spectroscopy coupled with gold nanosubstrates[J].Sensing and Instrumentation for Food Quality and Safety,2008,2(1):66~71.
[17]Kneipp K,Kneipp H,Itzkan I,et al.Surface-enhanced Raman scattering and biophysics[J].Journal of Physics: Condensed Matter,2002,14(18):R597~R624.
[18]Kneipp K,Kneipp H,Itzkan I,et al.Ultrasensitive chemical analysis by Raman spectroscopy[J].Chemical Reviews,1999,99(10):2 957~2 976.
[19]Suzuki M,Niidome Y,Kuwahara Y,et al.Surface-enhanced nonresonance Raman scattering from size-and morphology-controlled gold nanoparticle films[J].The Journal of Physical Chemistry B,2004,108(31):11 660~ 11 665.
[20]Grasseschi D,Zamarion V M,Araki K,et al.Surface enhanced Raman scattering spot tests:A new insight on feigl’s analysis using gold nanoparticles[J].Analytical Chemistry,2010,82(22):9 146~9 149.
[21]Liu J W,Lu Y.Preparation of aptamer-linked gold nanoparticle purple aggregates for colorimetric sensing of analytes[J].Nature Protocols,2006,1(1):246~252.
[22]Hill H D,Mirkin C A.The bio-barcode assay for the detection of protein and nucleic acid targets using DTT-induced ligand exchange[J].Nature Protocols,2006,1(1): 324~336.
[23]Ray P C.Diagnostics of single base-mismatch DNA hybridization on gold nanoparticles by using the Hyper-Rayleigh scattering technique[J].Angewandte Chemie International edition,2006,45(7):1 151~1 154.
[24]Darbha G K,Singh A K,Rai U S,et al.Selective detection of mercury(Ⅱ)ion using nonlinear optical properties of gold nanparticles[J].Journal of the American Chemical Society,2008,130(25):8 038~8 043.
[25]Griffin J,Singh A K,Senapati D,et al.Sequence-specific HCV RNA quantification using the size-dependent nonlinear optical properties of gold nanoparticles[J].Small, 2009,5(7):839~845.
[26]Li L,Li B X,Cheng D,et al.Visual detection of melamine in raw milk using gold nanoparticles as colorimetric probe[J].Food Chemistry,2010,122(3):895~ 900.
Target-controlled plasmonic coupling and surface enhanced raman scattering transduction for simple,rapid and highly sensitive detection of melamine in milk
Chen Ke1,Liu Feng-juan2,Yi Zi2*,Chu Xia2
(1.College of Chemistry and Chemical Engineering,Hunan Normal University,Changsha 410081,China)
(2.State Key Laboratory of Chemo/Bio-Sensing and Chemometrics,College of Chemistry and Chemical Engineering,Hunan University,Changsha 410082,China)
We report a novel,label-free and easy-to-operation nanobiosensor strategy for melamine via targetcontrolled plasmonic coupling and surface enhanced Raman scattering(SERS)transduction by using the unmodified gold nanoparticles(Au NPs).This strategy utilizes the binding between polythymine and melamine result in the destabilization of Au NPs,and then lead to the salt-induced aggregation of monodispersed Au NPs.Finally,the aggregation of Au NPs can give rise to the plasmonic coupling and turn on the enhancement of the Raman scattering. This approach is not only straightforward and simple in design,but also fairly rapid and convenient in operation.We have demonstrated successfully the application of this strategy in the detection of melamine in real liquid milk sample with the limit of detection as low as 8 nmol/L.
melamine;SERS;milk;nanobiosensor
国家自然科学基金(21275045)、NCET-11-0121、湖南省自然科学基金(Grant 12JJ1004)课题资助
*通讯联系人,Email:willy260@163.com
