多层纳米银/壳聚糖膜用于芘的表面增强拉曼测定
2013-03-14黄晨安盛鹏涛蔡青云
黄晨安,盛鹏涛,蔡青云
(湖南大学化学化工学院,化学生物传感与计量学国家重点实验室,湖南长沙410082)
多层纳米银/壳聚糖膜用于芘的表面增强拉曼测定
黄晨安,盛鹏涛,蔡青云*
(湖南大学化学化工学院,化学生物传感与计量学国家重点实验室,湖南长沙410082)
多环芳烃类物质的高疏水性质使得其在金属表面吸附能力差,从而拉曼增强信号弱。该文针对此问题,制备了以壳聚糖为骨架,纳米银颗粒为热点的多层纳米银/壳聚糖复合膜表面拉曼增强基底,成功用于芘的表面增强拉曼检测。由于壳聚糖本身的富集作用,目标分子被吸附、富集于银纳米颗粒形成拉曼热点,可检测0.01 μmol/L的芘。
多环芳烃;表面增强拉曼;分析
0 引言
多环芳烃(Polycyclic Aromatic Hydrocarbons,PAHs)是指两个或两个以上苯环以稠合方式连接起来的化合物, 包括萘 (Naphthalene)、蒽(Anthracene)、菲(Phenanthrene)、芘(Pyrene)等200余种化合物,主要来源于煤、石油、木材的不完全燃烧以及化工生产、有机物热解等。PAHs分布极其广泛,甚至在远离人群居住的土壤中也检测出较高含量的PAHs,其中有相当部分具有致癌性,且具有生物累积性,因此被列入《斯德哥尔摩公约》中持久性有机污染物(POPs)的控制名单[1~2]。1990年我国提出的68种水体优先控制污染物中含七种PAHs。芘作为PAHs的典型代表,是PAHs中毒性最大的物质之一,因而研究最多。研究发现芘能够导致生物发育过程中的多种缺陷,如造成外围循环系统缺陷、贫血、心包囊发育迟缓及水肿、加速神经管的细胞死亡等。由于芘具有较高的荧光量子产率,常被作为监测PAHs污染的指示物和模型分子[3]。
目前芘的主要检测方法为气相/液相色谱法、气质联用法等[4~5]。这些方法仪器昂贵、样品的前处理复杂耗时、分析费用高。报道的其他方法有石英晶体微天平法、荧光光谱法等[6~7]。这些方法背景干扰大、选择性差,在实际样品分析存在不少问题。表面增强拉曼散射(SERS)光谱具有良好的选择性与灵敏度,在各类金属离子和有机化合物的SERS分析领域开展了大量研究[8~9],但SERS分析PAHs存在困难。主要原因是PAHs疏水性大,在金属表面吸附能力低,不足以产生足够的SERS效应。为了解决这一问题,人们修饰金属表面、构建功能性分子膜层,捕获PAHs分子,拉近分子与金属的距离以增大SERS效应[10]。目前研究较多的是利用标记的功能分子修饰的金属纳米粒子作为富集和检测目标物的增强基质。如已报道的利用杯芳烃衍生物以及环糊精衍生物修饰金或银纳米粒子检测PAHs,其基本策略均为环状功能分子对目标物分子的捕获使它们直接靠近金属纳米粒子表面,产生SERS效应[11~12]。如今,为了使拉曼测试的前处理手段更加精简,人们越来越关注开发简单、无标记的金属纳米增强基底。
该文基于壳聚糖与柠檬酸盐包裹的银纳米颗粒间的自组装,使壳聚糖成为银纳米粒子的交联体,构建了多层银纳米/壳聚糖复合膜用于芘的SERS检测。壳聚糖(Chitosan,结构如图1)是甲壳素在碱性条件下水解脱去部分乙酰基后的产物,是一种通过β-1,4糖苷键相连的线性多糖,不仅来源丰富、价格低廉、无毒无刺激,而且还拥有良好的吸附性、成膜性和通透性等优良性能。壳聚糖分子内含有大量游离的羟基和氨基,具有很高的反应活性。在溶液中,它的氨基基团能够质子化,由此产生的可溶性多糖带正电[13~15]。利用其正电性使其与各类负电基团包裹的纳米颗粒通过静电力进行自组装,制备出新型功能复合材料的方法早前已有报道[16~17]。该工作采用了拉曼增强效果最佳的贵金属—银纳米颗粒,利用其表面负电性与壳聚糖分子进行多次自组装,构建以壳聚糖为骨架、银纳米颗粒为拉曼增强源的SERS活性基底。由于壳聚糖本身的富集效果,目标分子被基底吸附、富集,贴近银纳米颗粒形成拉曼热点,产生SERS效应,实现对芘的SERS分析。
1 实验部分
1.1 仪器与试剂
试剂:钛片(99.8%,厚0.127 mm)购于Aldrich公司。壳聚糖购于Amresco公司。芘和蒽购买于百灵威科技股份有限公司。3-氨丙基三乙氧基硅烷(APTES)、柠檬酸三钠、硝酸银、氟化钠、硫酸氢纳、乙酸、硝酸、磷酸氢钠、磷酸二氢钠、乙醇、罗丹明6G(R6G)、丙酮、芘、蒽等以及实验过程中使用的其他试剂均为分析纯。实验所用水均为二次蒸馏水。
仪器:扫描电子显微镜 (SEM,JSM 6700F;JEOL,Tokyo,Japan),紫外可见光谱仪(Cary 300;Varian Inc.,Palo Alto)与傅里叶转换红外光谱仪(FTIR,Nicolet 5700;Thermo Electron,U.S.A)用于拉曼基底材料的表征。拉曼分析在共聚焦显微拉曼光谱仪 (Voyage BWS435-785SY,B&W Tek Inc.,U.S.A)上进行。
1.2 多层纳米银/壳聚糖基底材料的制备
具有拉曼增强效应的AgNPs是根据P.C. Lee与D.Meisel的经典方法[18]制备而成。简要的说,90 mg硝酸银溶于500 mL除氧水中并煮沸。随后迅速加入10 mL质量分数为1%的柠檬酸三钠,保持沸腾至反应液体积变为原来的一半(约1 h)。 溶液颜色由最初的无色变为灰绿色,形成粒径约为70 nm的银纳米粒子溶胶。为了方便后续的自组装过程,银溶胶冷却后利用透析方法除去其中未反应的柠檬酸根等离子。最终将纯化后的AgNPs避光保存于4℃。
采用比表面大,表面羟基富裕的二氧化钛纳米管(TiO2)作为自组装的底板材料。钛片先在2%的氢氟酸中超声除去表面污渍,再于乙醇和丙酮中各超声震荡洗涤5 min,自然晾干。采用钛片阳极,纯铂片阴极的两电极体系,在含0.5 mol/L硫酸氢钠和0.1 mol/L氟化钠的电解液中室温下15 V恒电压氧化反应3 h,在Ti基板上得到管径约为90 nm的二氧化钛纳米管阵列,蒸馏水冲洗表面,自然干燥[19]。以此材料作为基底。
多层纳米银/壳聚糖基底材料(Ag-CS/TiO2)的构建过程如图1所示。首先,将TiO2基底用1 mol/L NaOH处理0.5 h以活化表面羟基,然后于体积比为2%的APTES乙醇溶液中70℃恒温反应2 h。取出后用乙醇和水冲洗,在氮气氛围中120℃干燥0.5 h。随后,将氨基化基底于体积比为7%的戊二醛水溶液中浸泡1 h使其能够与壳聚糖分子交联。然后将它转移至含0.1 mol/L乙酸的0.5%壳聚糖溶液中反应1 h以形成壳聚糖单层膜。取出后,先后用0.1 mol/L乙酸和水多次交替冲洗,防止物理吸附的壳聚糖分子使AgNPs聚沉。事先用稀硝酸将AgNPs溶液的pH调至约6.0后,将壳聚糖修饰的基底浸入其中至少0.5 h以完成自组装过程。通过在壳聚糖溶液与AgNPs溶液中交替浸泡,两种物质自组装在基底表面形成多层结构,使AgNPs以壳聚糖为骨架层层堆砌,最终获得不同修饰轮数的Ag-CS/TiO2基底。彻底清洗后,这些基底于氮气氛围中避光封存。

图1 壳聚糖分子式及多层纳米银/壳聚糖基底(Ag-CS/TiO2)组装示意图Fig.1 The chitosan formula and the assembly diagram of silver nanoparticles/chitosan multilayer substrate(Ag-CS/TiO2)
此外,作为对比材料的Ag-CS/Ti与Ag-CS/ ITO分别采用钛片(氢氟酸清洗)与氧化铟锡导电玻璃(ITO,食人鱼洗液清洗)为底板,利用与上述相同的自组装方法制备。而金电极作为另一种对比材料,依次用粒径为70 nm和30 nm的氧化铝粉末打磨成粗糙镜面后,先以饱和甘汞电极为对电极,于0.1 mol/L KCl溶液中在-0.2至1.2 V之间做循环伏安扫描(500 mV/s,300次),再用超纯水清洗,用氮气吹干待用。1.3 目标物的SERS分析检测
各浓度的R6G,蒽以及芘均由丙酮稀释。实验时,将10 μL待测液滴在面积为0.5×0.5 cm2的基底表面,等待自然晾干。随后将该基底置于拉曼光谱仪上检测。实验参数:物镜倍数为20倍,激发光为785 nm的激光,功率为1.9 mW,积分为3 s,平均积分次数为3次。
2 结果与讨论
2.1 材料的表征
对所制备的基底材料分别进行了红外光谱、紫外光谱和扫描电镜(SEM)的表征,结果如图2所示。
由图2A可看出,在经过10轮交替浸泡后的Ag-CS/TiO2基底表面,壳聚糖的特征峰已十分明显,表明吸附在基底表面的壳聚糖分子数量已经非常高(曲线a)。其中515 cm-1处为TiO2底板的特征峰,而1 068 cm-1、2 921 cm-1与3 321 cm-1处分别C-O、C-H与O-H键的吸收峰,与壳聚糖纯品的特征峰(曲线b)一致,证明壳聚糖的成功修饰。图2B展示了不同修饰轮数的Ag-CS/TiO2基底与未经修饰的TiO2基底在紫外区间的吸收对比。可以看出,空白TiO2基底在波长为250~360 nm的区间无明显吸收,这与以往的研究结果一致。当通过自组装修饰壳聚糖与AgNPs后,基底在波长为305 nm处出现了吸收峰,并且随着修饰轮数的增多,吸收峰越来越大,而最大吸收波长也从305 nm蓝移至312 nm。这表明了AgNPs成功与壳聚糖发生自组装反应固定于底板之上,并且多轮数的修饰使该反应反复发生致使AgNPs通过壳聚糖分子发生堆砌、聚集。

图2 (A)壳聚糖与Ag-CS/TiO2基底的红外谱图;(B)经0~10轮修饰的Ag-CS/TiO2基底的紫外谱图;(C~F)分别为经1轮,3轮,6轮,9轮修饰的Ag-CS/TiO2基底的SEM图Fig.2 Infrared spectra of chitosan and Ag-CS/TiO2substrate;(B)UV spectrum of Ag-CS/TiO2assembled with 0~10 cycles;(C~F)The SEM of Ag-CS/TiO2substrate modified with 1,2,6,and 9 round assemblies
图2 C~F分别展示了经过1轮、3轮、6轮与9轮自组装修饰的Ag-CS/TiO2基底的SEM图。可以看出,AgNPs的粒径约为70 nm到90 nm。当修饰轮数为1轮时,修饰在基底表面的AgNPs的数量明显较少,且纳米颗粒之间的距离相对疏远。而根据SERS的增强机理,AgNPs之间的距离直接影响了拉曼热点的形成,意味着这种程度的修饰不足以产生SERS效应。随着反应轮数的增加,富含氨基的壳聚糖分子充当了交联剂的角色,使更多的AgNPs在最初的位点发生堆砌,形成多层结构。当修饰轮数到达9轮时,大量的AgNPs被固定在基底上形成一种多层交联的状态,而纳米颗粒之间通过与壳聚糖分子的静电作用发生聚集,紧密的接壤在一起,这与紫外光谱的表征结果一致。
2.2 材料的优化
图3A展示的是1 μmol/L R6G在各种基底上的拉曼响应信号。图3A中,曲线a~d分别采用CS/TiO2和经过 9轮修饰的 Ag-CS/Ti、Ag-CS/ ITO、Ag-CS/TiO2作为基底的拉曼增强光谱。可以看出,以Ag-CS/TiO2为基底获得的曲线d是一幅优异的拉曼谱图,展现出最强的拉曼吸收峰,且各吸收峰与以往文献所报道的R6G特征峰基本吻合,说明R6G能在该基底上获得良好的SERS效应[20]。相比于曲线d,曲线b和c虽然也展现出R6G的各特征峰,且峰型也十分明显,但是各吸收峰强度却远远低于曲线d中相对应的峰强,表明自组装反应同样能够在钛片以及ITO导电玻璃底板上进行,但这两种基底的拉曼增强效果远不及Ag-CS/TiO2。在仅修饰壳聚糖的基底表面所获得的曲线a没有明显的拉曼增强峰,基本为一条直线,说明Ag-CS/TiO2基底上的所获得拉曼增强效果来自于AgNPs,而不是单纯的由目标物在壳聚糖膜表面的聚集作用而产生的。由此对比可知,银纳米与壳聚糖的多层复合结构在SERS检测方面,表现出良好的增强效果,并且以TiO2作为该结构的底板远比采用Ti或ITO所获得的增强效果好。这是由于TiO2相比于Ti和ITO,表面富裕的羟基以及其多孔表面所提供的巨大比表面积更利于第一步的氨基化,使壳聚糖单层膜更好的成形以完成后续的自组装反应。
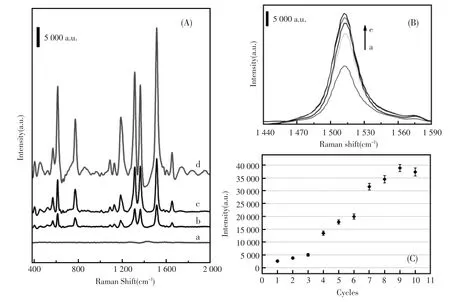
图3 (A)1 μmol/L R6G在CS/TiO2(a)和经过9轮修饰的Ag-CS/ITO(b),Ag-CS/Ti(c),Ag-CS/TiO2(d)上的拉曼光谱图;(B)1 μmol/L R6G分别以6轮(a),7轮(b),8轮(c),9轮(e),10轮(d)修饰的Ag-CS/TiO2为基底获得的1 440~1 590 cm-1区域范围内的拉曼光谱图;(C)1 512 cm-1处拉曼峰强度与修饰轮数的关系Fig.3 (A)Raman spectra of 1 μmol/L R6G on CS/TiO2(a),and 9 rounds assembled Ag-CS/ITO(b),Ag-CS/Ti(c), Ag-CS/TiO2(d);(B)Raman spectra in 1 440~1 590 cm-1region of 1 μmol/L R6G on the 6(a),7(b),8(c),9(e),and 10 round(d)assembled substrate;(C)The relationship between intensity of Raman peak at 1 512 cm-1and the modification rounds
对于Ag-CS/TiO2基底,自组装的修饰轮数将直接影响其拉曼增强效果,所以对它进行了优化。图3B是1 440~1 590 cm-1区域范围内R6G在经6~10轮修饰的Ag-CS/TiO2基底上的SERS图。拉曼位移为1 512 cm-1处吸收峰峰值大小随着修饰轮数增加而增大,当修饰轮数为9轮时达到最大值,约为39 000(a.u.)。与之对应的图3C是1 512 cm-1处拉曼峰强度与修饰轮数的关系。可以看出,经过4轮自组装反应后所构建的基底已经对R6G产生一定的拉曼增强效果,并且在7轮修饰过后增强效果明显提高,于9轮修饰时增强效果达到最大。继续增加反应轮数并没有使1 512 cm-1处的拉曼峰进一步增强反而使其略有减弱。这意味着Ag-CS/TiO2基底在经过9轮修饰后的结构状态最适宜于SERS效应的产生,其拉曼增强效果已经达到饱和值,额外的增加自组装次数并不能增加基底上的拉曼热点,反而可能产生空间位阻不利于目标物分子进入最佳位点。所以,在接下来的SERS检测中,采用的Ag-CS/TiO2基底均经过9轮自组装反应的修饰。
2.3 SERS法对芘的定性定量分析
对芘与多环芳烃中另一种典型代表物蒽进行了SERS分析以评价 Ag-CS/TiO2基底针对PAHs的定性分析能力。如图4所示,曲线c和曲线e分别为芘和蒽的固体纯品的拉曼光谱图,固体样品是通过将相应纯品粉末在玻璃板上压平成微小颗粒得到的。曲线b和曲线d则分别为10 μmol/L芘与100 μmol/L蒽在所制备基底上的拉曼增强谱图。根据对各类多环芳烃的结构和振动光谱的研究,在光谱图中有五个区域需要引起注意和讨论:(1)1 650~1 550 cm-1,一般为芳香环的拉伸振动与C-H键面内弯曲振动的混合;(2)1 500~1 350 cm-1与1 050~1 000 cm-1,一般为强的C-H键面内弯曲振动和弱的芳香环振动;(3)1 300~1 000 cm-1,一般为C-H键弯曲振动;(4)1 000~600 cm-1,一般为C-H键面外振动。(5)550 cm-1以下的区域,可能属于芳香环面外振动[21]。从图中可以看出,曲线b和曲线d在各个区域吸收峰的位置和峰形分别与纯芘固体和纯蒽固体的拉曼图的特征峰基本吻合[22]。曲线a则为10 μmol/L芘与100 μmol/L蒽等体积混合后在Ag-CS/TiO2基底上的拉曼光谱图。其中,芘的所有特征峰均被检测出,且芘的特征峰 (虚线x标出)与蒽的特征峰(虚线y标出)区分明确,少数两者共有的特征峰发生重叠,但是峰型良好(虚线z标出)。这说明利用该基底进行芘的SERS分析时,通过与纯品芘的标准谱图对比进行特征峰的归属,可以准确的从结构相似的混合物中对芘进行定性分析,确定芘是否存在。
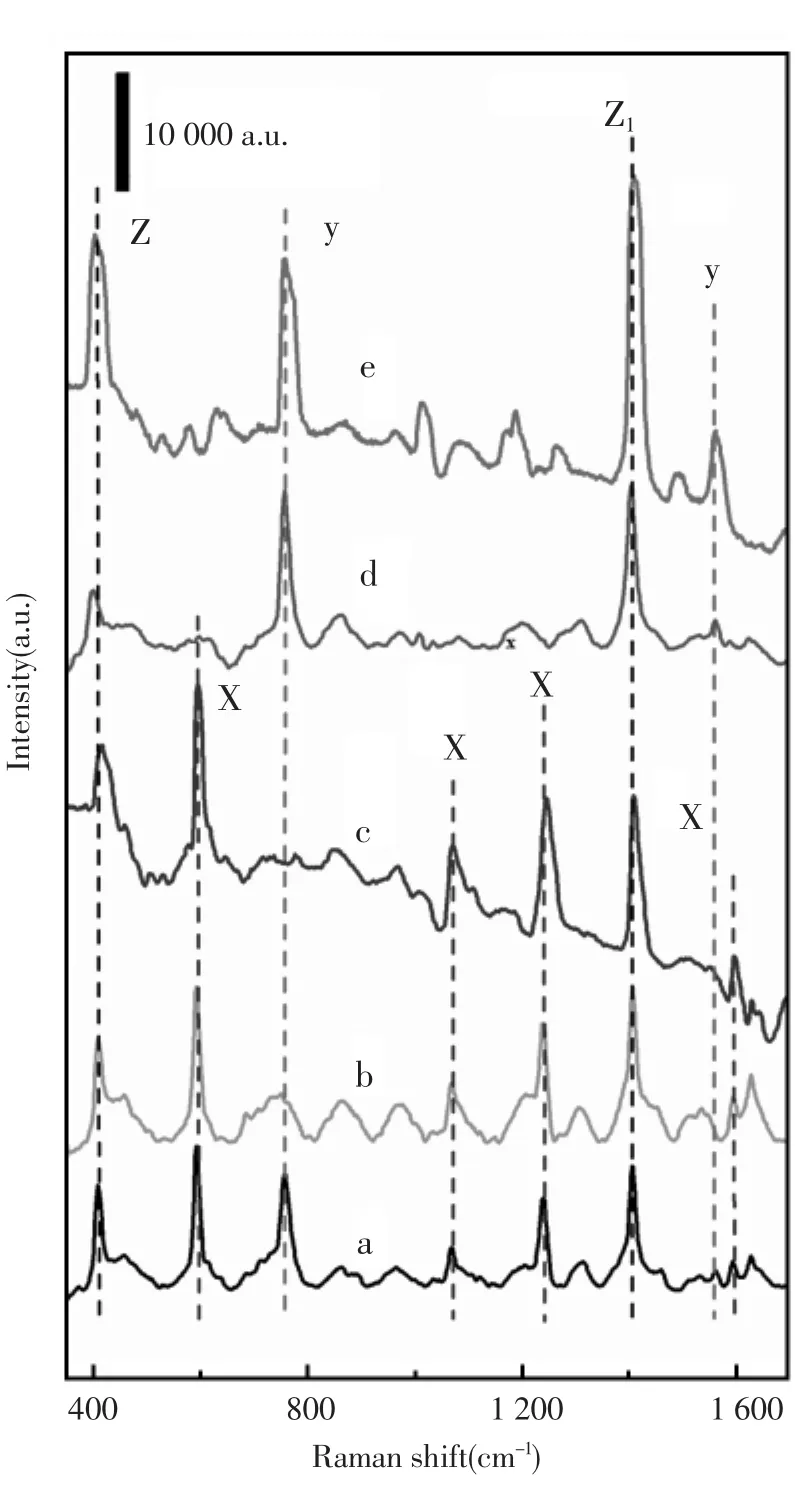
图4 10 μmol/L芘与100 μmol/L蒽等体积混合液(a),10 μmol/L芘溶液(b),芘固体粉末(c),100 μmol/L蒽溶液(d)与蒽固体粉末(e)分别在Ag-CS/TiO2基底上的SERS图Fig.4 SERS diagrams of 10 μmol/L pyrene and 100 μmol/L anthracene mixture(a),10 μmol/L pyrene(b), pyrene solid powder(c),100 μmol/L anthracene(d),and anthracene solid powder(e)on Ag-CS/TiO2substrate
图5A是不同浓度的芘在Ag-CS/TiO2材料表面的SERS图。10 μmol/L芘在传统金电极上的拉曼增强光谱(曲线a)和Ag-CS/TiO2空白基底材料的拉曼光谱图(曲线b)也在图中作为对照给出。在传统的金电极表面,虽有少数拉曼峰展现出来,但其信噪比不高且存在较多干涉峰,拉曼增强效果明显不如Ag-CS/TiO2基底材料。因芘在598 cm-1处的拉曼峰稳定并尖锐,且峰值较大,因此选用598 cm-1处的峰值做定量分析。与图5A对应,图5B为芘浓度的对数与598 cm-1处的峰值的线性拟合关系。该标准曲线的线性范围为0.05 μmol/L到 10 μmol/L,线性回归系数为0.989,说明该分析方法的线性范围较宽,线性相关良好。以三倍信噪比计算,此方法对芘的检测下限约为0.01 μmol/L。考虑到该实验所用的拉曼光谱仪的性能一般,所得光谱质量较好,检测下限已相对较低。

图5 A:10 μmol/L芘在传统Au电极上的SERS图(a)以及0 μmol/L(b),0.05 μmol/L(c),0.1 μmol/L(d),0.5 μmol/L(e),1 μmol/L(f),5 μmol/L(g),10 μmol/L(h)芘在Ag-CS/TiO2基底上的SERS图。B:598 cm-1处拉曼峰强度芘浓度对数的线性关系Fig.5 A:SERS diagram of 10 μmol/L pyrene on traditional Au electrode(a).The SERS diagrams of 0 μmol/L(b), 0.05 μmol/L(c),0.1 μmol/L(d),0.5 μmol/L(e),1 μmol/L(f),5 μmol/L(g),and 10 μmol/L(h)pyrene on Ag-CS/TiO2substrate.B:The linear relationship between the peak intensity at 598 cm-1and the logarithm of pyrene concentration
对该分析方法的精确度进行了测试。采用同样修饰步骤的不同批次的Ag-CS/TiO2基底材料对芘溶液进行三次重复SERS检测实验,得0.1、1和 5 μmol/L芘的变异系数分别为 9.44%、6.37%和5.30%。这表明该分析方法拥有可接受的精确度与重现性。进一步研究了该基底材料的稳定性。经9轮自组装修饰的Ag-CS/TiO2基底于氮气氛围中避光封存30 d后,10 μmol/L芘在其表面的SERS信号仅仅衰减3.32%(以598 cm-1处拉曼峰计算)。这种优良的稳定性表明通过壳聚糖分子固定在基底表面的AgNPs在较长时间内保有了原有的物理化学性质与拉曼增强能力。
2.4 实际水样回收率的测定
为了评估基于Ag-CS/TiO2基底材料对芘的SERS检测方法在实际应用中的可行性,对湘江水样进行了回收率的测定。先将水样分别用0.45 μm的纤维素膜过滤,然后分别向每份水样中加入不同浓度的芘的丙酮溶液,其最终浓度分别为0、0.005、0.05和0.5 μmol/L,一式三份。常温下芘在水中的溶解度约为0.675 μmol/L,其中少量溶解在水中,一部分以胶体形式存在,大部分吸附在水体中的颗粒物质上。所以,为了得到可靠的检测结果并使后续的拉曼检测步骤更便捷,对加标后的水样进行了简单的液-液萃取,操作如下:将0.5 mL正己烷加到10 mL水样中并室温搅拌0.5 h。静置2 h后收集有机相,反复萃取3次后使用氮气吹干。将残渣复溶于1 mL丙酮中,得到浓缩10倍的加标水样。回收率检测结果归纳于表1中。可以看出,不同水样中芘的回收率范围介于84.00%至 100.32%之间,相对标准偏差介于4.89%至10.10%之间。
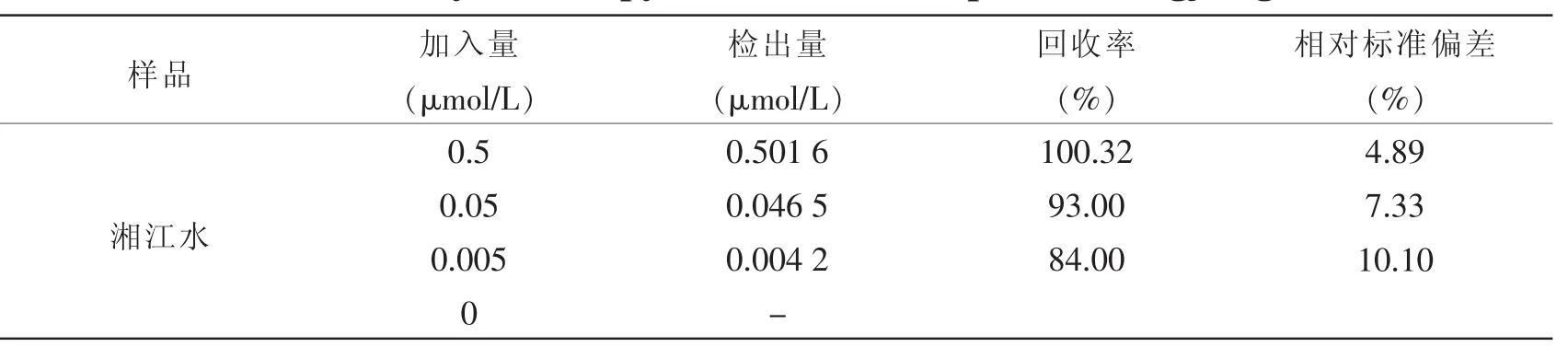
表1 湘江水样中对芘的回收率测定结果Tab.1 Recovery rates of pyrene in water samples of Xiangjiang river
3 结论
该文采用柠檬酸盐包裹的银纳米颗粒,利用其表面负电性与壳聚糖分子进行多次自组装,在二氧化钛纳米管底板上构建了以壳聚糖为骨架,银纳米颗粒为拉曼增强源的多层银纳米/壳聚糖SERS活性基底。R6G,蒽与芘均在该基底材料上获得较强的拉曼增强效果。由于壳聚糖本身的富集效果,目标物分子被基底吸附、富集,贴近银纳米颗粒间形成拉曼热点,产生增强的拉曼信号。利用该基底成功实现了对芘的定性定量分析。在最优条件下,其检测的线性范围为0.05 μmol/L到10 μmol/L,检测下限为0.01 μmol/L。此方法对实际样品加标回收率为84.00%至100.32%之间,表明该基底能用于PAHs分析。
[1]Alexander R R,Alexander M.Genotoxicity of two polycyclic aromatic hydrocarbons declines as they age in soil [J].Environmental Toxicology and Chemistry,1999,18 (6):1 140~1 143.
[2]Bjørseth A.Handbook of polycyclic aromatic hydrocarbons[M].New York:Marcel Dekker Inc.,1983,12(10): 727~733.
[3]Yuan S,Wei S,Chang B.Biodegradation of polycyclic aromatic hydrocarbons by a mixed culture[J].Chemosphere,2000,41(9):1 463~1 468.
[4]Wang H,Campiglia A D.Determination of polycyclic aromatic hydrocarbons in drinking water samples by solid-phase nanoextraction and high-performance liquid chromatography[J].Analytical Chemistry,2008,80(21): 8 202~8 209.
[5]Onyemauwa F,Rappaport S M,Sobus J R,et al.Using liquid chromatography-tandem mass spectrometry to quantify monohydroxylated metabolites of polycyclic aromatic hydrocarbons in urine[J].Journal of Chromatography B,2009,877(11):1 117~1 125.
[6]Stanley S,Percival C,Auer M,et al.Detection of polycyclic aromatic hydrocarbons using quartz crystal microbalances[J].AnalyticalChemistry,2003, 75(7): 1 573~1 577.
[7]Apicella B,Ciajolo A,Tregrossi A.Fluorescence spectroscopy of complex aromatic mixtures[J].Analytical Chemistry,2004,76(7):2 138~2 143.
[8]Tsoutsi D,Guerrini L,Hermida-Ramon J M,et al.Simultaneous SERS detection of copper and cobalt at ultratrace levels[J].Nanoscale,2013,5(13):5 841~5 846.
[9]Sheng P,Wu S,Bao L,et al.Surface enhanced Raman scattering detecting polycyclic aromatic hydrocarbons with gold nanoparticle-modified TiO2nanotube arrays [J].New Journal of Chemistry,2012,36(12):2 501~ 2 505.
[10]Bao L,Sheng P,Li J,et al.Surface enhanced Raman spectroscopic detection of polycyclic aromatic hydrocarbons(PAHs)using a gold nanoparticles-modified alginate gel network[J].Analyst,2012,137(17):4 010~ 4 015.
[11]Xie Y,Wang X,Han X,et al.Selective SERS detection of each polycyclic aromatic hydrocarbon(PAH)in a mixture of five kinds of PAHs[J].Journal of Raman Spectroscopy,2011,42(5):945~950.
[12]Abalde-Cela S,Ho S,Rodríguez-González B,et al. Loading of exponentially grown LBL films with silver nanoparticles and their application to generalized SERS detection[J].Angewandte Chemie,2009,121(29):5 430~ 5 433.
[13]Pospieszny H.Antiviroid activity of chitosan[J].Crop Protection,1997,16(2):105~106.
[14]彭湘红.甲壳素、壳聚糖的改性材料及其应用[M].武汉:武汉出版社,2009,8~18.
[15]Putri F,Kennedy J F.Application of chitin and chitosan: Mattheus FA Goosen (ed.),Basel,Switzerland,1997, Technomic Publishing AG,xi+336 pp.,Sfr.314.00,ISBN 1-56676-449-1.Carbohydrate Polymers,1997,34 (4):414.
[16]Huang H,Yang X.Chitosan mediated assembly of gold nanoparticles multilayer[J].Colloids and Surfaces A: Physicochemical and Engineering Aspects,2003,226(1): 77~86.
[17]Serizawa T,Goto H,Kishida A,et al.Improved alternate deposition of biodegradable naturally occurring polymers onto a quartz crystal microbalance[J].Journal of Polymer Science Part A:Polymer Chemistry,1999,37(6):801~ 804.
[18]Lee P,Meisel D.Adsorption and surface-enhanced Raman of dyes on silver and gold sols[J].The Journal of Physical Chemistry,1982,86(17):3 391~3 395.
[19]Yang L,He D,Cai Q.Fabrication and catalytic performances of TiO2nanotube array-supported Co-Ag-Pt nanoparticles[J].The Journal of Physical Chemistry C, 2007,111:8 214~8 217.
[20]Michaels A M,Jiang J,Brus L.Ag nanocrystal junctions as the site for surface-enhanced Raman scattering of single rhodamine 6G molecules[J].The Journal of Physical Chemistry B,2000,104(50):11 965~11 971.
[21]Lin-Vien D,Colthup N B,Fateley W G,et al.The handbook of infrared and Raman characteristic frequencies of organic molecules[M].Academic Press,1991.
[22]Jones C L,Bantz K C,Haynes C L.Partition layer-modified substrates for reversible surface-enhanced Raman scattering detection of polycyclic aromatic hydrocarbons [J].Analytical and Bioanalytical Chemistry,2009,394 (1):303~311.
Surface enhanced raman scattering detection of pyrene based on multiplayer Ag nanoparticles/chitosan
Huang Chen-an,Sheng Peng-tao,Cai Qing-yun*
(State Key Laboratory of Chemo/Biosensing and Chemometrics,Department of Chemistry,Changsha 410082, China)
The high hydrophobic property of polycyclic aromatic hydrocarbons(PAHs)results in low affinity to metallic surface and therefore insignificant Raman enhancement effect.In this work Ag nanoparticles-embeded multiplayer chitosan framework was prepared and used as the surface enhanced Raman scattering(SERS)substrate for the SERS detection of pyrene.Due to the high absorption ability of chitosan,target molecules were absorbed and concentrated onto the surface of Ag,sensitive detection of pyrene was achieved with a limit of detection of 0.01 μmol/L.
polycyclic aromatic hydrocarbons;surface enhanced raman scattering;analysis
该文工作获得国家973计划(2009CB421601)和国家自然科学基金(No.21175038)支持
*通讯联系人,E-mail:qycai0001@hnu.edu.cn
