凝血酶电化学适体传感器
2013-03-14袁亚利柴雅琴
袁亚利,袁 若,柴雅琴
(西南大学化学化工学院,重庆400715)
凝血酶电化学适体传感器
袁亚利,袁 若,柴雅琴*
(西南大学化学化工学院,重庆400715)
凝血酶是一种由凝血酶前体形成的丝氨酸蛋白质水解酶,具有催化纤维蛋白元变成纤维蛋白,促进血液凝固和调控凝血等作用,在揭示肿瘤的发生机制及作为早期诊断、疗效及愈后判断依据等方面有着非常重大的意义。由于血液中凝血酶的浓度达nmol/L,建立简单、快速、高灵敏度检测凝血酶的方法具有非常重要的意义。将SELEX技术筛选出的适体作为识别元件与电化学生物传感器相结合构建电化学适体传感器,集成了适体和电化学传感器两方面的优势,既具有电化学传感器的高灵敏度、快响应、简单操作、低成本,又具有适体的高选择性和特异性,在凝血酶检测方面具有广阔的应用前景。该文主要介绍了适体的体外筛选方法、适体的特点、适体与凝血酶的结合作用;总结了电化学适体传感器的不同分类,捕获探针适体的固定化方法及目前所采用的电化学分析技术;重点评述了电化学响应信号放大技术在电化学适体传感器中的应用。
电化学适体传感器;凝血酶;纳米粒子;催化信号放大
0 引言
随着人类基因组计划的逐渐完成以及功能基因学、蛋白组学研究的开展,寻找可靠、快速、高灵敏度的分析方法来对重要蛋白质进行实时定量的检测是后基因组时期一个重要的研究领域之一。在传统检测方法中,蛋白质的检测主要是利用抗体——抗原之间的特异作用。最近,基于寡核苷酸严格的识别及亲合力而人工设计合成的寡核苷酸——适体(aptamer)的出现,使得传统的抗体抗原反应发生了革命性的变化。适体对蛋白质的特异结合力与抗原抗体间的作用力相差不大,且与抗体相比较有更多的优越性。因此利用适体构建蛋白质的检测方法己受到广大科学研究者的关注。该文主要介绍了适体的体外筛选方法、适体的特点、适体与凝血酶的结合作用;总结了电化学适体传感器的不同分类,捕获探针适体的固定化方法及目前所采用的电化学分析技术;重点评述了电化学响应信号放大技术在电化学适体传感器中的应用。
1 适体概述
1.1 适体的定义
自上世纪90年代Ellington[1]和Tuerk[2]等研究小组用化学方法合成了适体并对其进行了定义以来,适体的研究工作得到了快速发展。适体是一种通过体外筛选技术,也就是指数富集配体的系统进化技术 (简称 SELEX,systematic evolution of ligands by exponential enrichment)在含有大量的核酸分子库中得到的,功能类似于单克隆抗体的,能够与蛋白质、小分子、离子、核酸、甚至整个细胞等目标分子高特异性、高亲和力结合的单链寡聚核苷酸。适体也称为核酸适体、适配体、适配子等。它的英文名为aptamer,源于拉丁语aptus,即适合之意,可以是RNA,也可以是DNA,长度一般为25~80个核苷酸[3~5]。适体与各种目标物的高特异性结合是建立在单链核酸结构和空间构象的多样性基础上的。它可以通过链内某些互补碱基之间的配对以及氢键作用、静电作用等发生自身适应性的折叠,从而形成一些具有稳定、特殊的三维空间结构,比如G-四聚体(G-quartet)[6]、 茎-环 (stem-loop)[7]、 假节(pseudoknot)[8]、发卡(hairpin)[9]等(图1)。目前,适体被广泛应用于药物检测、生物传感器、医学诊断和治疗等方面。
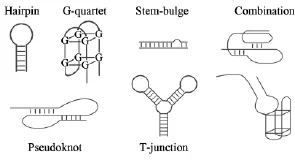
图1 各种稳定特殊适体的三维空间结构Fig.1 Various stably three-dimensional structures of aptamer
1.2 适体的筛选——SELEX
SELEX技术是体外筛选aptamer的一种分子进化工程技术,其总的构思是从利用组合化学原理人工设计合成的大量随机寡核苷酸库 (约1015~1018种核酸分子)中经过多轮重复筛选和指数富集而最终获得具有高特异性的目标核酸适体。核酸适体的筛选流程包括与达尔文进化理论类似的三个过程:自发突变、自然选择、大量增殖(图2)。
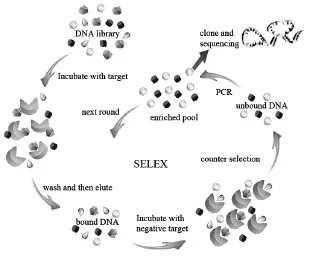
图2 适体的筛选流程[10]Fig.2 Schematic representation of aptamer selection procedure[10]
首先利用分子生物学技术人工构建一个含有随机碱基数为n的单链寡核苷酸文库。由组合化学原理可知,该文库则含4n个不同的随机寡核苷酸序列(约为1015~1018个,因为随机寡核苷酸序列长度一般在25~80个碱基之间)。在人工设计随机序列时将寡核苷酸序列的两端设计为固定序列,以便用于随后PCR循环时结合引物,这一步就相当于达尔文进化论中自发突变过程。在单链随机寡核苷酸与目标物结合时,寡核苷酸可以通过氢键、静电、“假碱基对”的堆积和形状匹配等作用与目标物形成具有很高结合力的复合物。利用这一原理可以将能与目标物结合的寡核苷酸初步分离出来,这一步相当于进化过程中的自然选择。在选择性分离出核酸适体之后,利用聚合酶链式反应(PCR)及体外转录技术对其进行扩增,生成次一级文库,这种扩增的过程其实就类似于达尔文进化论中的大量增殖。为了使寡核苷酸分离相对容易一点,通常会在PCR过程中对其中一条链修饰上核糖核苷酸、生物素或有机基团等。此外,为了得到与目标物高特异性、高亲和力结合的适体,将前面生成的次一级文库接着再与目标物进行结合,反复循环多次。在每次的循环中,筛选出来的适体与目标物的结合力都会得到提高。经研究表明,一般情况下,循环6~15次就可以得到高特异性、高亲和力的适体。而具体的循环次数最终由单链寡核苷酸文库的类型以及每次循环所得到的适体富集程度来决定。只要单链寡核苷酸文库足够大,就可以为任意目标物找到与之对应的适体。为了实现筛选流程的自动化和快速化,近年来发展了多种新型SELEX筛选技术,如毛细管电泳交联筛选技术 (CESELEX),光交联筛选技术(photo-SELEX),自动化筛选技术(automated-SELEX),加尾筛选技术(tailored-SELEX), 微流控芯片筛选技术(microfluidic-SELEX)和荧光激活细胞分类筛选技术(FACS-SELEX)等。这些方法的建立,极大地提高了筛选效率,拓展了适体的应用范围。
1.3 适体的优点
适体作为电化学传感器的分子识别元件与其它分子识别元件相比,具有以下优点:
(1)能与适体特异结合的目标物种类比较广泛:一般情况下,抗体只可与抗原结合,单链DNA也只能与其碱基配对的单链DNA结合,而对于适体,它不仅可以与较大的蛋白质目标物结合(如酶、抗体、生长因子、细胞粘附分子等),而且也可以与小分子目标物结合(如氨基酸、金属离子、核苷酸、生物辅因子、肽、药物等),甚至还可以与完整的病毒颗粒、细菌和细胞等目标物结合[11]。
(2)高特异性以及高亲和力:适体对蛋白质的高特异性结合力稍大于抗原抗体间的作用力,解离常数一般为1×10-9~1×10-12mol/L[12]。适体与目标物高的特异性以及高亲和力主要由以下原因引起的。当适体与目标物之外的分子相互作用时,目标物之外的分子通常将适体上富含嘌呤的环作为外来靶序列的结合位点,具体表现为嘌呤—嘌呤排列(包括碱基错配、碱基三聚体和碱基平台),因此可以在适体上看到G-G或G-A错配。通过这些碱基的错配就可以在正常双螺旋碱基对间的堆积处产生一个转折点从而导致环的关闭,使得适体不与目标物之外的分子相互作用[13]。而当适体与目标物结合时,单链核酸的结构和空间构象通常会通过链内某些互补碱基之间的配对、静电作用及其氢键作用等发生一定的适应性折叠,从而形成稳定的空间结构,利于与目标分子发生特异结合[14]。
(3)分子量较小:由于适体是一段由25~80个碱基组成的单链寡核苷酸,因而分子量一般在8~15 KDa之间,分子量较小,有利于高密度高灵敏阵列生物传感器的构建。此外,还有利于穿透组织,有望直接运用于活体分子成像和药物传输。
(4)体外筛选、人工化学合成:适体是通过SELEX技术体外筛选产生的,不依赖于动物或细胞,与抗体制备相比较其更简单快速、成本低。而且筛选出来的适体具有高纯度,有效地消除了适体的批间差异。并且适体分子序列所定义的组合库容量大,具备空前的多样性,体外筛选效率高,便于进行大规模、高通量的筛选和制备,适用于生物传感器的大批量生产。
(5)稳定性好、适合反复变性和复性:与酶和抗体/抗原相比较,适体不仅具有良好的稳定性,而且还适合反复变性和复性,有利于重复利用。经研究发现,适体制成冻干粉后可置于室温保存长达数年之久,而当适体溶解后又立刻恢复其相应的功能,一定程度上提高了传感器的使用寿命和重复利用次数。
1.4 适体与凝血酶的结合作用
凝血酶是由凝血酶原活化变成的丝氨酸蛋白质水解酶 (由49个氨基酸残基的轻链和259个氨基酸残基的重链组成),分子量为36 Ku。轻链和重链由二硫键连接,其中轻链对凝血酶整体结构的完整功能性起到稳定作用[15],重链能提高催化位点[16],结合阴离子,对底物发生疏水作用[17]以及稳定凝血酶结构[18]。凝血酶可以将催化体内纤维蛋白元转变成纤维蛋白,在炎症、血液凝固和创伤愈合等方面发挥着极其重要的作用,常用于毛细血管出血的局部止血和外科手术后组织的愈合。机体内的凝血作用必须保持在一定的范围内,这是因为过度的凝血将会引起血栓栓塞性疾病,而且严重的凝血将导致机体死亡[19]。因此,凝血酶的浓度及活性可以作为衡量凝血机制的重要指标之一,它对早期诊断、疗效及愈后判断具有十分重大的意义[20]。一般情况下,血液中的凝血酶浓度大约为nmol/L数量级,因此建立准确、快速、高灵敏度的检测方法和传感器用于凝血酶的检测在医学上十分重要。传统免疫分析法由于抗体的制备、保存等缺陷一定程度上限制了其发展。
适体对蛋白质的特异结合力与抗原抗体间的作用力相差不大,且与抗体相比较有更多的优越性。目前,己相继筛出两种与凝血酶(图3B)不同位点特异性结合的适体(TBA),其中一个是结合于纤维蛋白原位点上的适体[1](15个碱基:5′-GGT TGG TGT GGT TGG-3′)(图3A),解离常数(Kd)为25~200 nmol/L,另一个是结合于凝血酶肝磷脂位点上的适体[21](29个碱基: 5′-TCA GTG GGG TTG GAC GGG ATG GTG CCT GA-3′)(图3C),其解离常数(Kd)达到0.5 nmol/L。凝血酶与适体除了有2个特异性结合位点外,还相对应有2个适体[22]。利用适体与凝血酶之间高的亲和力和特异性,这两种适体己经用于凝血酶的灵敏检测中[21]。凝血酶适体在高离子浓度(尤其是K+)或无目标分析物凝血酶时呈卷曲状,而当凝血酶出现时,凝血酶适体构象逐渐由卷曲状变为G-四聚体结构[23]。此时,通过适体带负电荷的特殊G-四聚体结构以及凝血酶侧链上的Arg126、Lys236、Lys240和Arg93这几个在生理条件下带正电荷的氨基酸之间的相互静电吸附作用可以将凝血酶适体与凝血酶结合在一起[23]。
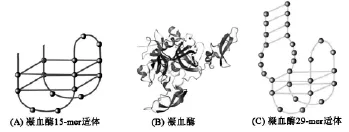
图3 凝血酶适体与凝血酶特异性结合形成复合物的空间结构Fig.3 Spatial structure assumed for complex of thrombin with the thrombin aptamer
2 电化学适体传感器
2.1 电化学适体传感器简介
电化学传感器是应用最广泛、最古老的传感器类型之一。具有快响应、高选择性、高灵敏度、简单操作、低成本等显著优点。将适体作为识别元件与电化学生物传感器结合在一起所构建的电化学适体传感器,集成了适体和电化学传感器两方面的优势,既具有电化学传感器的高灵敏度、快响应、简单操作、低成本,又具有适体的高选择性和特异性,在环境污染物检测、药物筛选、疾病检测等方面具有广阔的应用前景。
电 化 学 适 体 传 感 器 (electrochemical aptasensor)是以适体作为分子识别的接受器(receptor)并通过固定化技术将其结合到感受器表面。发生特异识别反应后,生成适体-目标分析物复合物与产生的信号相关联,再以电化学电极、场效应晶体管、热敏电阻、压电石英晶体等作为换能器(transducer)将其转化为与目标分析物浓度(或活度)有关的可定量或者可处理的电化学信号,这样就可以根据电化学信号的改变实现对目标分析物的定量检测。图4是电化学适体传感器的检测原理示意图。目前,用于固定适体的工作电极主要有玻碳电极[24]、丝网印刷碳电极[25]、金电极[26]、金阵列电极[27]、金芯片电极[28]和铟锡氧化物(ITO)电极[29]等。
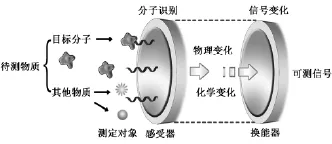
图4 电化学适体传感器原理示意图Fig.4 Scheme of the principle for an electrochemical aptasensor
2.2 电化学适体传感器分类
2.2.1 以电化学适体传感器的构建原理分类
根据电化学适体传感器的构建原理将其分为单链核酸构建的电化学适体传感器、双螺旋结构的核酸构建的电化学适体传感器和两条单链核酸构建的电化学适体传感器:
单链核酸构建的电化学适体传感器是指在适当的实验条件下(如适当的温度、pH值、离子强度等)将适体单链通过固定化技术固定到电极表面,然后将适体与目标分析物直接特异结合,这一结合过程将引起电极表面电子传递效率的变化,从而进一步引起电化学信号的改变。通过检测电极表面电化学信号的变化就可以达到识别和高灵敏检测目标分析物的目的。如Degefa等[30]设计了将血小板生长因子适体直接修饰在电极表面,适体与电惰性的血小板生长因子特异结合后,电极表面空间位阻增大,根据电流信号的减小就可以完成对目标分析物的定量检测(图5)。但是,在此类方法中,适体被固定在电极表面,由于适体片段较小,易影响其结构,从而影响与目标分析物的结合,因而其固定方法是关键点和难点。
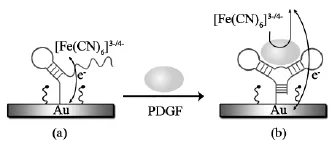
图5 单链核酸物质体系构建的电化学适体传感器原理示意图Fig.5 Scheme of the principle for a single-stranded based electrochemical aptasensor
双螺旋结构的核酸构建的电化学适体传感器是指将适体及其互补链形成的双螺旋结构的双链固载在电极表面,当孵育目标分析物溶液时,由于目标分析物与适体的高亲和力,原有的双链解开,双链中的适体探针或其互补链部分或完全脱离电极表面,这一过程将引起电极表面电子传递效率的变化,从而进一步引起电化学信号的改变。通过检测电极表面电化学信号的变化就可以达到识别和高灵敏检测目标分析物的目的。它根据dsDNA的杂交程度又可以分为不完全双链结构和完全双链结构。
如Xiao等[31]构建了一种不完全双螺旋结构的凝血酶电化学适体传感器。将凝血酶适体和标记有电活性物质亚甲蓝MB的不完全双螺旋结构首先固载在电极表面。由于此时双螺旋结构长度较大,不利于MB与电极交换电子。当孵育目标分析物凝血酶后,原有双螺旋结构部分解开,MB接近电极表面,电化学信号增强(图6)。
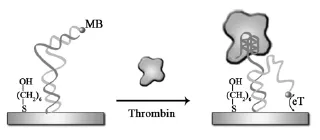
图6 不完全双螺旋结构的凝血酶电化学适体传感器原理示意图[31]Fig.6 Scheme of the principle for a double-stranded based thrombin electrochemical aptasensor[31]
Zuo等[32]制备了一种完全双链结构的腺苷电化学适体传感器。首先将两端分别修饰了巯基和电活性物质二茂铁的腺苷适体的互补链自组装至金电极表面,然后杂交上腺苷适体。此时双螺旋结构长度超过电子最大隧穿距离(~10 nm),电活性物质二茂铁无法与电极交换电子,只能检测到极微弱的电流信号。当加入目标分析物腺苷ATP后,ATP与适体结合,使原有的双链完全解开,腺苷适体的互补链发生折叠,标记的电活性物质二茂铁因此接近电极表面,电化学信号显著增加,根据电化学信号的增加就可以完成对目标分析物的定量检测(图7)。
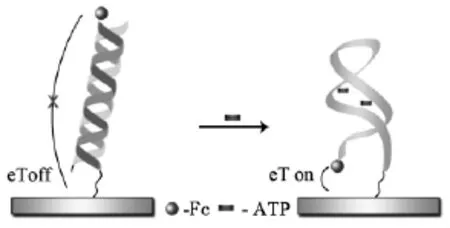
图7 完全双螺旋结构的腺苷电化学适体传感器原理示意图[32]Fig.7 Scheme of the principle for a double-stranded based ATP electrochemical aptasensor[32]
两条单链核酸物质体系构建的核酸适体电化学传感器是基于构建固相负载适体—目标分析物—标记适体夹心复合物的分析方法。其要求目标分析物至少有2个结合位点,才能先后与两条适体结合,形成夹心之势。即首先将能与目标分析物特异性结合的一条适体作为捕获探针通过固定化技术固定在电极上,待其与相应的目标分析物结合后,利用目标分析物有多个结合位点的特性,特异识别另一条标记有酶、金属离子、电活性物质、纳米材料等的检测适体,形成适体—目标分析物—标记适体夹心复合物。这样就可以通过标记在检测适体上的物质来反应出目标分析物的浓度,灵敏度较高。这类传感器也称“夹心式”电化学适体传感器。
Numnuam等[33]在金电极表面通过自组装法首先组装上一层凝血酶适体,然后与目标分子凝血酶发生特异性识别,再与CdS标记的适体结合,形成夹心结构。然后用过氧化氢将Cd2+溶出,借助镉离子选择性电极来电化学检测溶出的Cd2+电化学信号,从而完成对凝血酶的检测,检出限为0.14 nmol/L。Wang等[34]首先在纳米金表面修饰大量的血小板生长因子适体以得到功能化的纳米金并以此作为第二适体。然后通过“夹心反应”于金电极表面构建适体/血小板生长因子/功能化纳米金颗粒三明治复合结构(图8)。因纳米金颗粒表面适体带负电,能通过静电吸附作用吸附带正电的电活性物质[Ru(NH3)5Cl]2+。该传感器电化学信号随目标分析物浓度增加而明显增加,对目标分析物血小板生长因子的检出限达0.01 pmol/L。此外,该适体传感器具有很强的抗干扰能力,对血清和血浆中的凝血酶测定都得到令人满意的结果,为传感器有望应用于临床医学提供了可靠的依据。
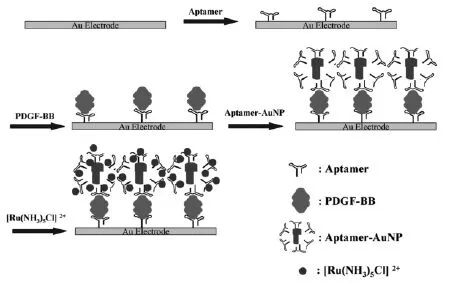
图8 “夹心式”电化学适体传感器原理示意图[34]Fig.8 Scheme of the principle for the sandwich-type electrochemical aptasensor[34]
2.2.2 以适体是否被标记分类
电化学适体传感器根据适体是否被标记可分为免标记型和标记型两类:
免标记型电化学适体传感器对适体不需要进行标记,可以直接根据适体与目标分析物识别前后所引起的电流、电阻等电化学信号的变化来进行检测的一类操作简单的传感器。对于这类传感器,电活性物质一般有三种存在方式:一种存在于检测溶液中;一种是通过静电吸附作用直接吸附在适体表面;还有一种是直接修饰在电极表面。
Lee等[35]设计了一种基于凝血酶适体修饰热解碳电极的免标记型阻抗适体传感器用于凝血酶的检测。电活性物质存在于检测溶液中。由于凝血酶是生物大分子,阻碍电极表面电子传递,传感器阻抗值随着特异识别逐渐增加。Zayats等[36]制备了一种免标记型腺苷适体电化学生物传感器。利用化学键共价结合方法将腺苷适体及其互补链固定在电极表面,与目标分析物结合后,适体互补链离开电极表面从而减少电极表面空间位阻。Peng等[37]在电极表面固定溶菌酶适体与其互补链,检测底液中的Fe(CN)63-/4-离子作为氧化还原探针。由于适体不导电以及带负电荷,此时双链修饰的电极电阻较大。当适体与溶菌酶结合后,溶菌酶适体离开电极表面,引起电极表面空间位阻和负电荷减小,电子转移速率因此大大的增加,随着溶菌酶浓度的逐渐增加,电极表面电子转移电阻随之相应减少,检出限达0.07 nmol/L(图9)。这类传感器构建简单,但电活性物质存在于溶液中,电极表面易受到污染。
后来研究者将电活性物质直接修饰在电极表面,这样有效克服以上缺点,同时一定程度上减少了电活性物质与电极表面的距离,电化学信号增强。Shen等[38]将巯基修饰的腺苷适体与一条较短的互补链杂交并固定至金电极表面,带负电的双链可有效地将带正电的六氨合钌阳离子吸附在电极表面。腺苷与适体结合后,双链解开携带部分六氨合钌阳离子离开电极表面,电信号降低(图10)。这类传感器构建简单,但是稳定性较差。

图9 电活性物质在溶液中的免标记型电化学适体传感器原理示意图[37]Fig.9 Scheme of the principle for label-free electrochemical aptasensor with electroactive substances presence in solution[37]

图10 通过静电吸附作用结合电活性物质与电极表面的免标记型[38]电化学适体传感器原理示意图Fig.10 Scheme of the principle for label-free electrochemical aptasensor with electroactive substances modified on electrode surface via electrostatic interaction[38]
因此,Du等将聚乙烯亚胺与二茂铁形成的复合物(Fc-PEI)通过层层自组装直接修饰在电极表面形成含有大量电活性物质的多层复合膜。然后将可卡因适体[39]或凝血酶适体[40]修饰在电极上,当与目标分析物可卡因或凝血酶特异结合后,由于可卡因和凝血酶阻碍电子传递,电极表面空间位阻增大,电流减小。该传感器对可卡因和凝血酶的检出限分别可达0.1 μmol/L和0.14 ng/mL(图11)。这类传感器无需标记、成本低、稳定性好、操作简单、假阳信号率低,而且不损伤适体的活性,然而有个缺点就是灵敏度相对较低。
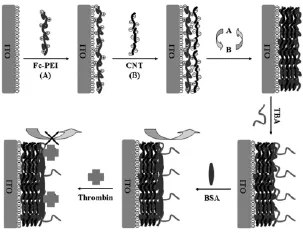
图11 电活性物质修饰在电极表面的免标记型电化学适体传感器原理示意图[40]Fig.11 Scheme of the principle for the label-free electrochemical aptasensor with electroactive substances modified on electrode surface[40]
标记型电化学适体传感器是用纳米粒子(量子点纳米粒子、铂纳米粒子等)、电活性物质(如亚甲蓝、二茂铁等)或酶 (如辣根过氧化物酶HRP,葡萄糖脱氢酶GOD等)对适体进行标记,然后根据适体与目标分析物特异识别前后标记物所产生的电化学信号的改变来完成目标分析物的定量检测的一类传感器。
Lai等[41]将末端修饰亚甲基蓝MB的血小板生长因子适体固定在金电极上。利用目标分析物血小板生长因子与适体结合前后MB距离电极的远近实现对血小板生长因子的定量检测 (图12)。同样原理也适用于Xiao等[42]构建的凝血酶适体传感器,检出限达6.4 nmol/L。Hu等[43]设计了一条能部分形成双链的适体,当有目标分析物组氨酸存在下,组氨酸将适体剪切成两段,而剪切下来的一条适体正好能同时与溶液中标记有二茂铁的适体和修饰在金电极上的DNA部分杂交形成“Y”结构。通过测定电流信号的增加就可以测出目标分析物组氨酸的浓度。标记型电化学传感器灵敏度高,但识别物需要标记、操作步骤多、较繁琐、成本高。
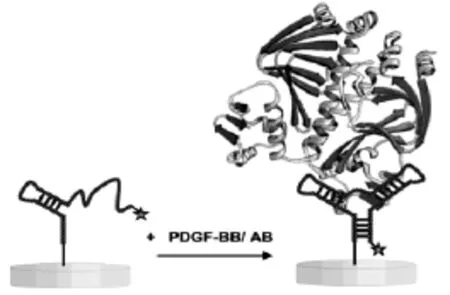
图12 标记型血小板生长因子电化学适体传感器原理示意图[41]Fig.12 Scheme of the principle for the MB-labeled electrochemical aptasensor[41]
2.2.3 以适体与目标分析物结合前后信号的变化分类
电化学适体传感器根据适体探针与目标分析物特异识别前后电化学信号的改变可分为信号衰减(signal-off)型和信号增强(signal-on)型两类:
signal-off型电化学适体传感器是以目标分析物与适体结合后所导致的电化学信号衰减程度为定量分析信号。Liu等[9]制备了电化学信号signal-off型适体传感器用于干扰素IFN-γ的高灵敏测定。首先将干扰素适体末端修饰电活性物质亚甲蓝MB并将其通过固定化技术修饰在电极上形成发夹结构,此时MB与电极之间的距离较近,电子传递速率快,电流信号大。然而,当适体与目标分析物IFN-γ特异识别后,迫使发夹结构打开,同时MB远离电极表面,得到明显降低的电化学信号。该传感器操作简便且灵敏度高,对目标分析物IFN-γ的检出限可达到0.06 nmol/L。Xu等[44]设计了基于不规则纳米金修饰电极的signal-off型电化学适体传感器用于凝血酶的检测。首先将凝血酶适体修饰在不规则纳米金表面,在检测底液中存在电活性物质二茂铁的情况下表现出较高的氧化峰电流。当适体探针与目标分析物凝血酶特异识别后,由于蛋白质是惰性生物大分子,电极表面的空间位阻将增大,氧化峰电流因此相应减小,从而成功制备了signal-off型电化学适体传感器(图13)。该传感器提供了一种通用的电化学检测方法,可以广泛应用于其他物质的检测。实现了快速、灵敏检测目标分析物。同样原理也适用于McMullan等[45]构建的signaloff型电化学适体传感器。与之不同的是该传感器的电活性物质氨基钌是通过静电吸附作用直接修饰在凝血酶适体表面。
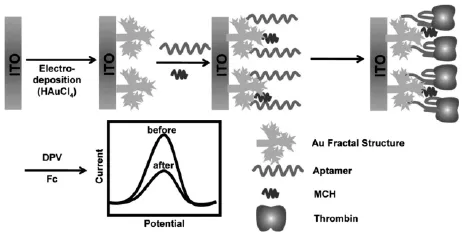
图13 基于不规则纳米金修饰电极的signal-off型电化学适体传感器原理示意图[44]Fig.13 Scheme of the principle for the fractal gold-based signal-off electrochemical aptasensor[44]
此外,Feng等[46]构建了基于双螺旋结构的signal-off型电化学适体传感器。腺苷适体及其互补链被直接修饰在电极表面,电活性物质亚甲蓝MB镶嵌在双链中间,通过腺苷适体与目标分析物腺苷结合后脱离电极表面带走一部分MB实现对腺苷定量检测。Signal-off型电化学传感器虽然可实现对目标分析物的定量检测,但这类传感器是根据适体探针与目标分析物特异结合后所导致的信号降低来完成目标分析物的定量检测,该方法本身有一定的局限性,背景信号较大,检出限高,限制了传感器的灵敏度。并且,污染物以及其它物质所产生的“假信号”与特异目标分析物的结合所产生的信号很难区别。
Signal-on型电化学适体传感器是以目标分析物与适体结合后所导致的电化学信号增强程度为定量分析信号。该方法的出现有效克服了上述signal-off型适体传感器的缺点。成功实现了准确、快速、高灵敏检测目标分析物。Radi等[47]设计了一种signal-on型电化学传感器用于直接检测凝血酶。首先将末端修饰有二茂铁的凝血酶适体捕获探针通过自组装技术修饰在金电极表面。此时,由于凝血酶适体处于半折叠状态,电流信号较小,当凝血酶适体与目标分析物凝血酶特异识别后,二茂铁与电极表面之间的距离相应缩短,电子传输效率提高,电流信号随之相应变大。该Signal-on型传感器在实际样品中显示出优越的稳定性,对凝血酶的检出限达到0.5 nmol/L。Zhang等[48]提出了表面临近杂交型signal-on电化学适体传感器。一对相同的尾端标记有二茂铁的适体同时识别以二聚体形式存在的血小板生长因子PDGF-BB后,由于临近效应使适体探针两尾端序列同时与电极表面固定的两条短链DNA杂交,促使二茂铁充分靠近电极表面,产生显著的氧化还原电流。该传感器响应范围可从1.0 pg/L到20 ng/L,检出限可达1.0 pg/L。Zuo等[49]报道了一种基于夹心法的signal-on型电化学传感器,如图14所示,小分子目标分析物的适体链被巧妙的设计成两段,其中一段通过自组装技术修饰在金电极表面,另一段末端标记上电活性物质MB。当目标物存在并与两段核酸适体结合形成三明治结构时,MB与电极的距离变近,电流信号增强。该方法成功实现了对实际样品血液中可卡因及ATP小分子的高灵敏检测。
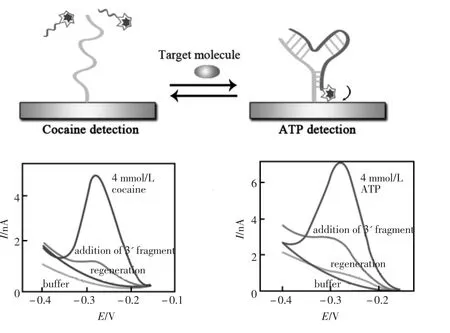
图14 基于目标物适体分两段构建signal-on型电化学适体传感器原理示意图[49]Fig.14 Scheme of the principle for the signal-on electrochemical aptasensor with target probe divided into two parts[49]
2.3 适体的固定化方法
适体的固定化是电化学适体传感器构建的首要问题。适体的固定量、定向以及活性直接影响着电化学适体传感器的灵敏度和选择性。为了把适体牢固修饰在电极表面,常常需要借助有效的物理或化学方法。传统比较常见的吸附法和包埋法是最简单的固定化方法,但构建的传感器存在定向性差的缺点,不利于适体与目标分析物的结合。目前报道的适体固定化方法主要有自组装膜法、共价键合法、亲和素-生物素法和互补核苷酸链连接法。
2.3.1 自组装膜法
在电化学适体传感器中,自组装膜法是在金电极表面进行适体固定最常用的方法之一。该方法一般以金电极作为基体电极,然后对适体末端(3′或5′)标记巯基基团,在金硫键成键驱动作用力下将适体有序吸附在传感器金载体表面并形成单层膜。该方法的结合力强,操作简单,得到的修饰表面适体探针高度有序且稳定性好,对目标分析物表现出很高的特异性和选择性。但是,该自组装膜法要求巯基修饰的适体纯度较高,而分离提纯操作繁琐。另外还有不足之处就是金除了跟巯基结合外,同样能和适体的碱基发生非特异性结合,使适体平躺于电极表面。因而一般需要再组装第二层疏基层,常用的是巯基小分子,如疏基己醇,它不仅可有效减少适体中碱基与金之间的相互作用,占据金电极表面上未被适体占据的位点,而且它带负电的羟基基团能与同样带负电的适体产生排斥作用,从而促使适体链以一定角度直立在电极表面,形成结构较为紧密的适体修饰层,有效地提高了亲合反应效率,大大降低了传感器假阳性信号[50~51]。如Xu等[52]成功将带巯基的凝血酶适体自组装在金电极表面构建了一种免标记的阻抗性电化学适体传感器。该传感器操作简单、稳定性好、灵敏度较高,对凝血酶的检测达到0.01 pmol/L。
2.3.2 共价键合法
共价键合法是以形成共价键(如酯键、醚键、酰胺键等)的方式使适体探针固定在电极表面的一种常用方法。此方法一般是首先对电极进行预处理以引入氨基、羧基、羟基等活性基团,或对核苷酸进行衍生,使其带上合适的功能团,随后用双官能团试剂(戊二醛、对硝基苯氯甲酸醋等)或偶联活化剂(马来酞亚胺、二异硫氰酸醋等)通过共价键合反应把适体固定在电极表面。共价键合法在适体传感器中的应用有效提高了适体传感器表面固定适体的特异性,减少了非特异性吸附所产生的干扰信号。此外,该方法一定程度提高了适体的牢固度及耐用性。共价键合法在制备电化学适体传感器中应用广泛,是诸多固定探针方法中较为理想的方法。但该固定方法需要对电极表面引入合适的功能团,步骤比较繁琐,同时也会带入许多新的干扰因素,如表面活化剂、交联剂等的副作用。另一方面,电极表面有限的活性位点以及异相结合反应使得适体的固定量有限,一定程度影响了电化学生物传感器的灵敏度。因此,需要综合考虑反应体系中各种化学试剂、适体、目标分析物最佳反应所需的理化条件、浓度等。
2.3.3 生物素—亲和素法
生物素(Biotin)是从动、植物组织中提取的辅酶。它具有两个环状结构:其中Ⅰ环是能与亲和素特异结合的咪哇酮环;Ⅱ环为唆吩环,有一戊酸侧链,其末端羧基是与适体结合的唯一结构。生物素标记适体后既不影响其与亲和素的结合,也不影响适体的活性。亲和素(Avidin)是从卵白蛋白中提取的一种碱性糖蛋白,由4个含有相同结合位点的亚基组成,能与4个生物素结合形成高度稳定的结构,亲和常数为1015mol/L,几乎与共价键相当。早在1986年,Ross等[53]就报道了这种亲和作用不容易受到温度、pH和有机溶剂的影响。因此,亲和素(及其衍生物)和生物素之间的高特异性和亲合力被广泛用于适体在传感器表面的固定。Kawde等[54]利用生物素—亲和素固定化法构建了溶菌酶电化学适体传感器。首先将亲和素修饰在磁性纳米粒子表面,然后加入标记有生物素的适体探针,利用生物素—亲和素之间的相互作用将适体固定到磁性纳米粒子表面,当加入目标分析物溶菌酶后,磁性微珠表面形成了适体—溶菌酶复合物。使用氢氧化钠分解复合物释放出捕获的溶菌酶,最后利用电位溶出技术检测溶菌酶,检出限为7 nmol/L。Liao等[55]利用碱性磷酸酯酶标记亲和素构建了原位产生共反应试剂的电致化学发光凝血酶适体传感器。发光物质联吡啶钌和铂纳米粒子首先通过静电吸附作用固定在Nafion电极表面,然后将碱性磷酸酯酶标记的亲和素固定在铂纳米粒子表面,通过生物素—亲和素之间的相互作用将凝血酶适体探针固定在电极表面以直接检测凝血酶。实验表明,该传感器对凝血酶的检出限为0.33 fmol/L。生物素标记的适体与亲和素相互作用所构建的适体传感器可以用来检测多种目标物质,如抗生素、蛋白质、生物毒素等。此外,由于1个亲和素分子可以结合4个生物素标记的适体,相比于其它固定方式,该方法可以有效增加传感器表面适体的固定量,减少非特异性吸附的发生,提高传感器的信噪比。因此,该方法所构建的电化学适体传感器可以广泛的应用于药物分析、疾病诊断及食品质量安全监测等领域。
2.3.4 互补核苷酸链连接法
互补核苷酸链连接法是指通过适体末端连接的一小段核苷酸短链或适体直接与传感器表面修饰的另一段相应互补短链杂交而被固定的方法。Zhang等[56]设计了一种基于互补核苷酸链连接法修饰适体的超灵敏电化学适体传感器(图15)。能与腺苷适体部分互补的一小段核苷酸短链首先被固定在电沉积的纳米金表面,然后将腺苷适体通过末端互补短链连接的方式固定在电极表面。由于腺苷适体部分与短链互补,还能剩余一部分碱基与纳米金标记的核苷酸短链互补结合。此时电极表面带有较多的负电荷,能将电活性物质氨基钌通过静电吸附作用修饰在电极表面。当反应体系中加入目标分析物腺苷时,适体就会与腺苷结合,从而使纳米金标记的核苷酸短链解离下来并带走部分氨基钌。Wang等[57]设计了相类似的传感器,同样也是将能与腺苷适体部分互补的一小段核苷酸短链首先固定在金电极表面,然后将腺苷适体通过末端互补短链连接的方式固定在电极表面并通过静电吸附作用吸附带正电的电活性物质亚甲基蓝MB,通过适体与腺苷结合后解离电极表面带走部分MB完成腺苷的定量检测。从上面可以看出,互补核苷酸链连接法在电化学适体传感器中的应用一般是基于目标分析物的加入会引起互补核苷酸链或适体解离,从而导致电化学信号的变化。该类传感器在检测过程中电化学信号的产生不依赖于适体构象的变化或是目标分析物多结合位点的要求,对各种电化学适体传感器都适用。然而,由于适体的固定涉及到核苷酸链的退火杂交,实验条件难以控制。同时适体与传感器表面互补短链连接时,二者带有相同电性的负电荷,静电排斥力和空间位阻较大。因此,需要通过改变体系的理化性质,优化适体在传感器表面的固定过程来解决上述问题。
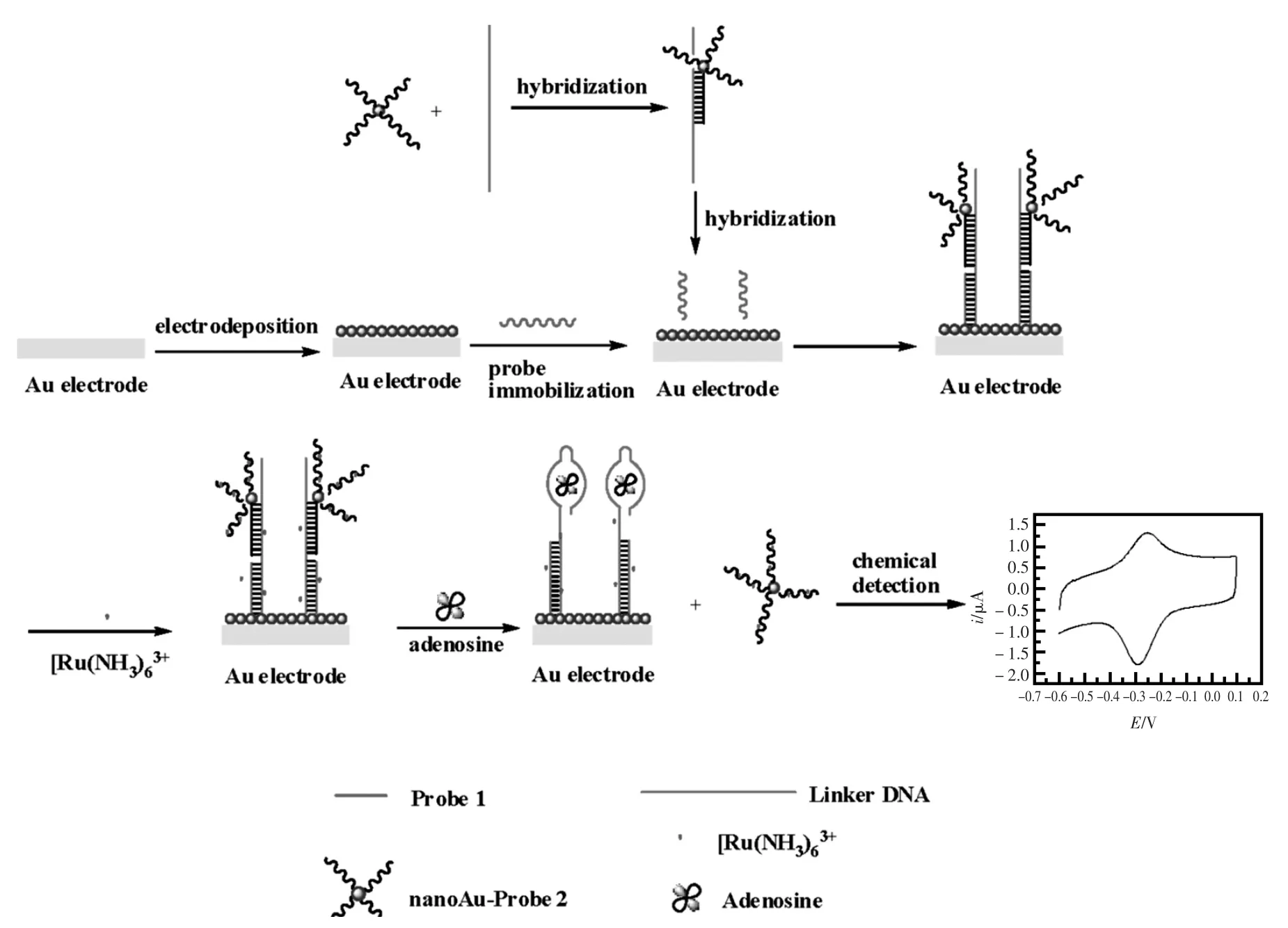
图15 基于互补核苷酸链连接法修饰适体的超灵敏电化学适体传感器原理示意图[56]Fig.15 Scheme of the principle for the ultrasensitive electrochemical aptasensor with complementary chain as linker[56]
2.4 电化学分析技术
电化学分析方法是利用被测物含量变化引起电流、阻抗、电位、电导或电量等电学参量发生相应变化来完成被测物定量分析的一种分析方法。该方法不仅能对传感器组成和形态进行分析,而且对其修饰过程的理论研究具有十分重要的意义。对于电化学适体传感器来说,电化学适体传感器的电化学定量检测方法可根据不同电学参量分为电化学阻抗法、循环伏安法、差分脉冲伏安法、溶出伏安法、交流伏安法和方波伏安法等。下面主要对电化学阻抗法、循环伏安法、差分脉冲伏安法和溶出伏安法进行简要地介绍。
2.4.1 电化学阻抗法
电化学阻抗谱 (electrochemical impedance spectroscopy,EIS)又称电化学阻抗法,是近年来发展迅速的一种电化学分析方法,具有良好的界面表征作用,是研究生物分子间相互作用的重要技术[58],特别适合于分析传感器表面生物敏感膜的制备和生物学反应的动力学机制,已逐渐成为生物传感器研究的有效辅助方法。电化学阻抗法是以Fe(CN)63-/4-等作为氧化还原探针,由于电极上不存在阻挡电子传输的物质,裸电极的阻抗图谱在所有频率范围内基本是一条直线,氧化还原反应受扩散控制。当适体探针修饰在电极表面后,由于适体探针带负电荷,将通过静电排斥作用阻碍Fe(CN)63-/4-向电极表面的扩散,电子传递阻抗值较裸电极的大,当适体探针与目标分析物蛋白质结合后,由于蛋白质的电惰性,电子传递阻抗值变大,相应的在阻抗谱图上表现为高频部分半圆逐渐变大。这样就可以根据适体探针与蛋白质特异识别前后电阻的变化值来完成对蛋白质的定量检测。
2005年,Radi等[26]首次将EIS引入到电化学适体传感器中,具体操作如下:凝血酶适体首先被固定在金电极表面,以溶液中的Fe(CN)63-/4-离子作为氧化还原探针。由于凝血酶生物大分子的特性,适体与凝血酶结合后会引起电子转移电阻的增加,界面电子转移电阻随着凝血酶浓度的提高而相应增加,检测下限达2.0 nmol/L。该传感器操作简单,稳定性好,传感器的再生是通过在2.0 nmol/L的NaCl溶液中浸泡10 min得到的,重复使用15次阻抗值没有明显的变化。为了进一步提高电极的灵敏度,Deng等[59]构建了基于纳米金放大的夹心式EIS电化学适体传感器 (图16)。带巯基的凝血酶适体首先固定在金电极表面,通过夹心反应将凝血酶和标记有金纳米粒子的第二适体结合在电极表面。由于适体带负电荷,凝血酶是生物大分子,凝血酶和标记有金纳米粒子的第二适体结合在电极表面后电阻依次增大。进一步灵敏度的提高采用了NADH于金纳米粒子表面原位还原氯金酸以得到粒径增大的金纳米粒子,实验结果表明,该传感器具有较高的灵敏度,对凝血酶的检出限可达到100 fmol/L。
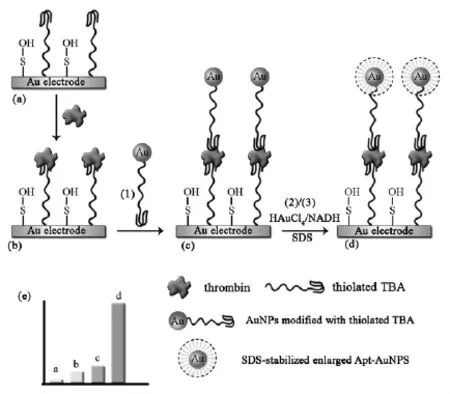
图16 基于金纳米粒子放大的阻抗型电化学适体传感器原理示意图[59]Fig.16 Scheme of the principle for the EIS electrochemical aptasensor[59]
2.4.2 循环伏安法
循环伏安法(Cyclic Voltammetry,CV)是一种常用的电化学研究方法,可用于判断电极反应的可逆程度,电极吸附现象,电化学反应产物,电化学—化学耦联反应等,对于有机物、金属有机化合物及生物物质的氧化还原机理研究很有用。常用来测量电极反应参数,判断其控制步骤和反应机理,并观察整个电势扫描范围内可发生哪些反应及其性质如何。对于一个新的电化学体系,首选的研究方法往往就是循环伏安法,可称之为“电化学的谱图”。Kuang等[60]构建了一种简单、快速的signal-off型电化学适体传感器并采用循环伏安法检测目标分析物赭曲霉素(图17)。三段单链DNA,包括赭曲霉素适体和纳米金标记的单链NDA被固定在金电极表面,由于纳米金具有良好的导电性,此时传感器在电活性物质亚甲蓝存在下呈现出较高的循环伏安峰电流。而标记有纳米金的适体与目标分析物结合后离开电极表面带有部分导电的纳米金,循环伏安峰电流减小。随着赭曲霉素浓度的增大,电流值逐渐减小,实验表明对赭曲霉素的检测达到30 pg/mL。
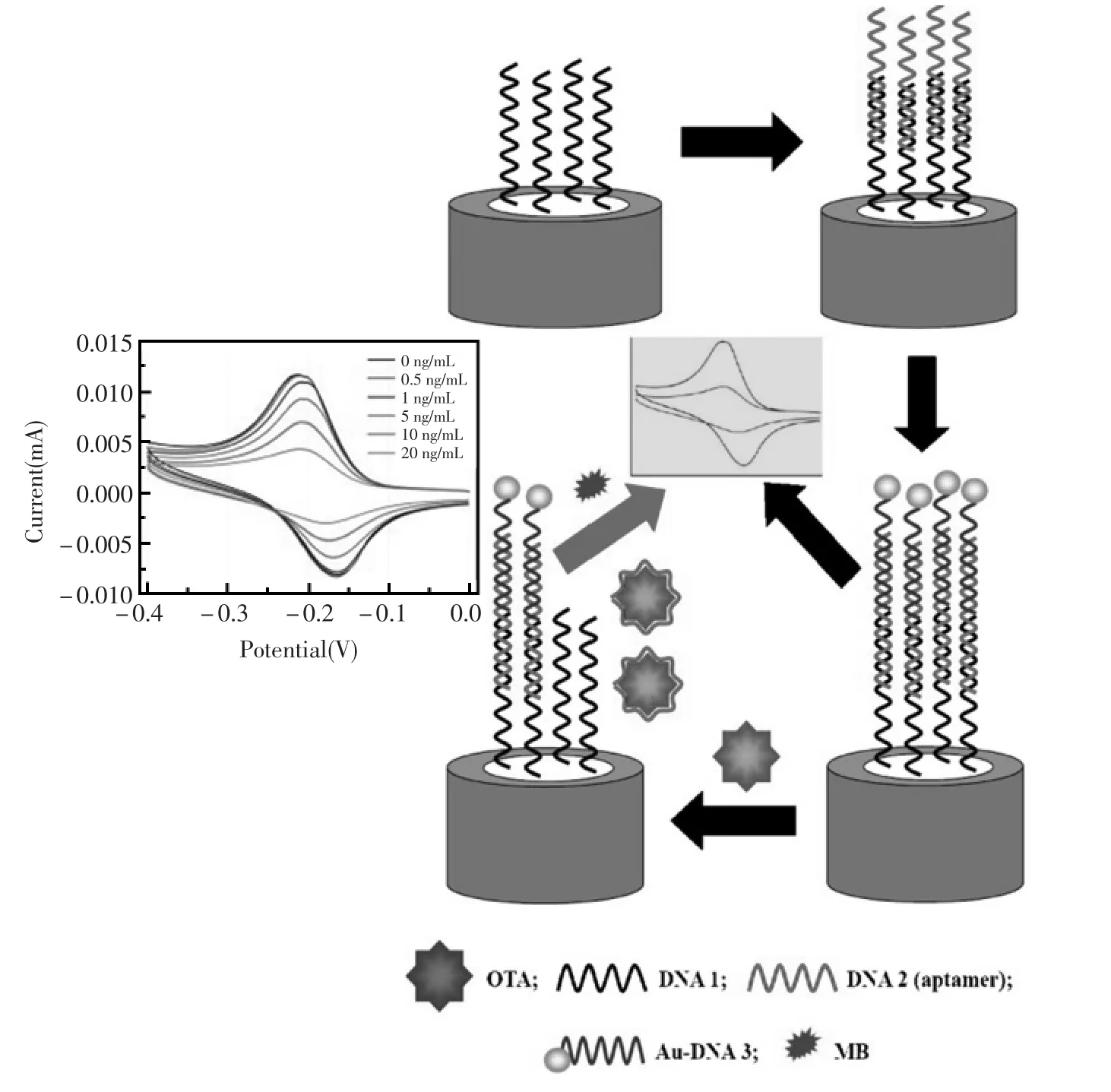
图17 基于循环伏安法检测赭曲霉素的电化学适体传感器原理示意图[60]Fig.17 Scheme of the principle for the electrochemical aptasensor[60]
2.4.3 溶出伏安法
溶出伏安法(Stripping Voltammetry,SV)是电解溶出过程和电解沉积过程相结合的一种电化学检测方法,是由极谱法发展优化得来的。在该方法中,被测离子在一定电位下首先被电解沉积,然后在反向电位转换的作用下,已经沉积在电极表面的离子将发生电解溶出,这个溶出过程的所记录的伏安曲线就称为溶出伏安曲线。在进行测定时,被测离子的性质决定了溶出伏安曲线出峰的电位。峰电流的大小直接与被测离子浓度成正比。由于被测离子在电极表面的沉积相当于浓缩富集,浓度大大的提高了,因此在溶出过程中电流较大,灵敏度较高。然而,由于被测物质富集量的多少与电解富集电位、电极面积、时间和搅拌速率有一定关系,在进行实验操作时应严格控制实验条件,而且应使电解溶出过程中溶液保持静止。
2.4.4 差分脉冲伏安法
差 分 脉 冲 伏 安 法 (differential pulse voltammetry,DPV)是指电压在缓慢线性变化的情况下对恒定振幅的矩形脉冲电位进行叠加。差分脉冲伏安法实际是对叠加脉冲前的某一时间和脉冲终止前的某一时间电流进行的测量,记录的是两次电流差,因而得到的差分脉冲伏安曲线能有效地消除背景电流的影响,比循环伏安法具有更高的检测灵敏度和更低的检出限。Du等[61]构建了免标记型电化学适体传感器并用差分脉冲伏安法分别完成对凝血酶和溶血酶的定量检测,检出限分别为0.14 ng/mL和0.17 ng/mL。Ding等[62]设计了一种新型的夹心式凝血酶电化学适体传感器并同样采用差分脉冲伏安法对其检测凝血酶的性能进行了测定,实验结果表明对凝血酶的检测可达0.55 fmoL/L,具有较低的检出限。差分脉冲伏安法属于全定量分析,与半定量分析的循环伏安法相比,其准确度大大提高了。
3 信号放大技术在电化学适体传感器中的应用
在电化学适体传感器中,一个指示探针对应的电活性指示剂只能产生一个信号电子,因此检测的灵敏度较低。为了提高检测灵敏度,需要运用到信号放大技术,它是实现对痕量蛋白等定量测定的常用手段之一[63]。以下就不同信号放大技术的电化学适体传感器在无机离子、有机小分子和蛋白质定量检测分别作简要介绍。
3.1 纳米粒子信号放大技术在电化学适体传感器中的应用
纳米粒子是指基本单元的颗粒或晶粒尺寸在1~100 nm之间的材料。纳米粒子结构既不同于体块材料,也不同于单个的原子,具有独特的物理化学性质(如小尺寸效应、表面效应、量子尺寸效应、宏观量子隧道效应等)。纳米粒子所具有的小尺寸效应和表面效应使其与其它原子结合时表现出很高的化学活性,易与其他原子结合而使纳米粒子的比表面积、表面能及表面结合能迅速增大。因此,利用纳米粒子这些特点可将其作为固载基质固载标记物(如酶、信号物质等),有效高标记物的固载量。此外,纳米粒子具有良好的生物相容性,能提供一个类似生物分子本体环境的微环境,起到保持生物组分活性的良好作用。以上这些独特的性能使纳米粒子能够充分满足传感器多功能、微型化、高速化的要求。因此纳米粒子非常适合用于构制高选择性、高灵敏度的电化学适体传感器。目前碳纳米管、石墨烯、纳米金和磁珠作为信号放大在这方面的应用最为常见。
Fu等[64]同时结合纳米磁珠和碳纳米管信号放大构建了夹心式电化学适体传感器。构建如图18所示,纳米磁珠首先用于固载大量凝血酶适体,与此同时制备了碳纳米管包裹凝血酶适体的复合物。在溶液中存在目标分析物凝血酶时,纳米磁珠包裹的凝血酶适体和碳纳米管包裹凝血酶适体将凝血酶通过夹心反应结合在两者之间,然后利用纳米磁珠的磁性将所形成的纳米磁珠包裹的凝血酶适体—凝血酶—碳纳米管包裹凝血酶适体复合物聚集在金电极表面。由于适体带负电,能将带正电荷的电活性物质亚甲蓝MB吸附在电极表面,这样就可以通过检测MB的电信号完成对凝血酶的高灵敏检测。该传感器的高灵敏度主要归结于以下两点:首先由于纳米磁珠具有大的比表面积,能固载多的凝血酶适体,一定程度提高了凝血酶的结合量。同时,碳纳米管良好的导电性大大改善了形成的夹心复合物对电极表面电子传递的阻碍作用。此外,Xiang等[65]利用具有良好导电性和大比表面积的碳纳米管固载大量碱性磷酸酯酶和凝血酶适体以形成第二适体,通过夹心反应后将其结合在电极表面。在双酶放大体系作用下,该传感器对凝血酶的检出限达到8.3 fmol/L。Li等[66]用金纳米粒子增加凝血酶适体互补链固载量构建了signal off型电致化学发光传感器以及用纳米管固载发光试剂钌和凝血酶适体构建了夹心式传感器,对凝血酶的检测分别为0.8 pmol/L和3 fmol/L。
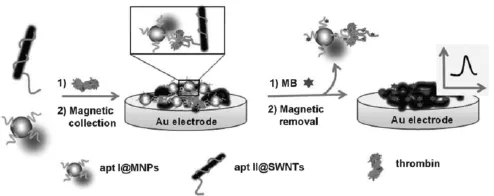
图18 基于纳米磁珠和碳纳米管放大的电化学适体传感器原理示意图[64]Fig.18 Scheme of the principle for the electrochemical aptasensor with magnatic bead and carbon nanotubes for amplification[64]
3.2 酶催化信号放大技术在电化学适体传感器中的应用
酶(enzyme)是一类由生物体产生的具有生命调节能力的蛋白质,人体中各种代谢反应都离不开酶的参与,在生命过程中扮演着重要的角色,具有高效的催化能力和高度的专一性,因此,将酶催化运用到高灵敏度传感器的构建具有非常重要的意义。酶催化信号放大有效改善电化学传感器灵敏度是通过酶催化底物氧化还原反应产生电子循环而实现的。一般情况下,酶在电极表面的固定是通过共价键合和纳米技术来实现,因此酶催化信号放大往往与纳米放大技术联用,实现信号双重放大。
Zhao等[67]制备了一种新型的壳聚糖—金纳米复合粒子并用于固载大量辣根过氧化物酶HRP和凝血酶适体。与此同时制备了纳米金包裹的磁珠复合物固载另一段凝血酶适体,在溶液中存在目标分析物凝血酶时,两条凝血酶适体通过夹心反应结合在一起,然后利用纳米磁珠的磁性将所形成的夹心复合物富集在电极表面。此时电极表面的辣根过氧化物酶能对检测溶液中电活性物质对苯二酚的氧化还原反应起到催化作用,显著提高了传感器的灵敏度(图19)。Centi等[68]利用夹心反应将标记有生物素的凝血酶适体修饰在电极表面,利用亲和素—生物素之间的特异性结合将碱性磷酸酶修饰在电极表面,而此时碱性磷酸酶就能有效地催化底物水解产生氧化还原物质完成对凝血酶蛋白检测。Bai等[69]以Pt纳米粒子修饰的石墨烯固载葡萄糖氧化酶并将此复合物标记适体制备了第二适体偶合物,采用夹心模式形成适体—凝血酶—适体复合物。此时,结合在电极表面的葡萄糖脱氢酶能催化底物葡萄糖产生过氧化氢,而产生的过氧化氢又被Pt纳米催化还原,形成了催化葡萄糖脱氢酶自身氧化还原反应的双酶放大体系。
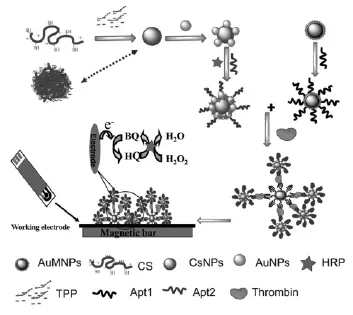
图19 基于壳聚糖-金和辣根过氧化物酶双重信号放大的电化学适体传感器原理示意图[67]Fig.19 Dual amplification strategy of highly sensitive thrombin amperometric aptasensor based on chitosan-Au nanocomposites and HRP[67]
在酶催化信号放大技术中,常用的酶有葡萄糖脱氢酶、碱性磷酸酯酶、辣根过氧化物酶等,这些都是蛋白质,其催化活性易受温度、酸度等环境因素的影响,而且成本也高。1998年,Travascio等[70]首次提出了一种具有G-四链体结构的DNA酶(图20)。这种G-四链体DNA酶是由一段富含G碱基的寡核酸序列与卟啉铁(hemin)配位结合构成的具有很强结合能力的配合物,又称辣根过氧化物模拟酶 (G-四链体-卟啉铁,hemin/G-quadruplex),具有类似辣根过氧化酶的性质,能在过氧化氢存在下对鲁米诺(luminol)、2,2-连氮-双(3-乙基苯并噻唑-6-磺酸)(ABTS)等氧化还原物质进行催化,催化能力较游离的hemin高出大约两个数量级,能够成功实现信号放大检测。与蛋白酶相比较,G-四链体-卟啉铁更易于修饰到DNA序列中或与其它分子上,成本低,稳定性好、抗水解性强,成为一种新型的催化标记物。此外,G-四链体-卟啉铁作为催化标记基团,由于其自身是核酸,在某种程度上减少了对蛋白等分子的非特异性吸附,进一步提高了检测的灵敏度和特异性。同时,该辣根过氧化物模拟酶的核苷酸序列可以按照需要设计,甚至任意裁剪,大大扩大了其应用领域。因此,利用卟啉铁与富含G碱基寡核酸序列形成G-四链体-卟啉铁催化结构构建高灵敏度传感器具有非常重要的意义,而且该仿酶的使用避免了很多传感器需要进行标记的步骤和成本,有望用于各种传感器的设计中。
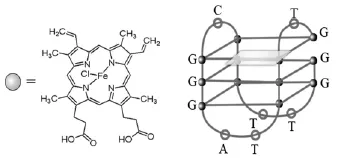
图20 卟啉铁和富含G碱基寡核苷酸序列构建的G-四链体-卟啉铁催化结构Fig.20 Proposed hemin structure and guanine-quadruplex model for the folded and catalytically active structure of the hemin/G-quadruplex
基于此,Tang等[71]通过杂交链式反应将富含有G碱基的寡核酸链结合在一DNA长双链上构建了基于G-四链体-卟啉铁电催化放大的仿单酶放大系统。富含有G碱基的寡核苷酸链与卟啉铁hemin结合后形成辣根过氧化物模拟酶,在过氧化氢存在下有效催化电活性物质二茂铁的氧化还原反应。Zhou等[72]利用寡核甘酸互补链连接法将G-四链体-卟啉铁催化结构修饰在电极表面构建了电催化放大的microRNA电化学传感器。Shen等[73]直接将凝血酶适体固定在电极表面,利用凝血酶适体能与卟啉铁hemin结合形成催化结构构建了一种简单的用于凝血酶检测的电化学适体传感器。Zhang等[74]设计了一条含有大量G碱基的细胞因子适体,在没有目标分析物细胞因子时,细胞因子适体自身部分发生碱基配对。而当结合细胞因子后,配对的双链解开,裸露出一段富含G碱基序列与卟啉铁hemin结合形成G-四链体-卟啉铁催化结构,从而成功构建了电催化放大电化学适体传感器(图21)。
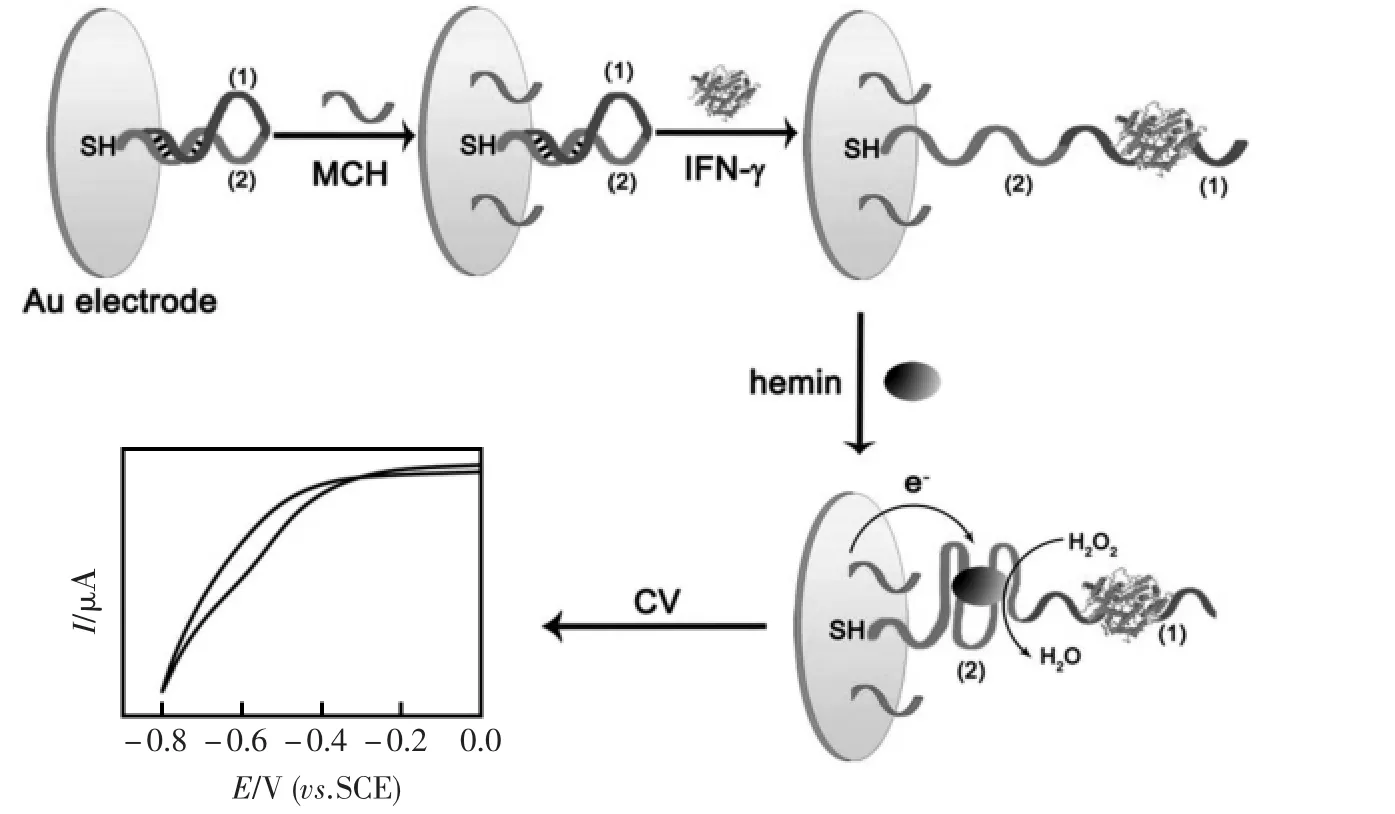
图21 基于G-四链体-卟啉铁模拟酶电催化放大检测细胞因子的免标记型电化学适体传感器原理示意图[74]Fig.21 Label-free and amplified electrochemical detection of cytokine based on hairpin aptamer and catalytic DNAzyme[74]
3.3 杂交链式反应信号放大技术在电化学适体传感器中的应用
杂交链式反应 (hybridization chain reaction, HCR)是2004年由Dirks和Pierce[75]提出的一种检测灵敏度类似聚合酶链式反应的信号放大技术。它是一个无酶参与的反应过程,通过设计合理的不同寡核苷酸,由一小段核苷酸链作为引发剂诱导寡核苷酸相互杂交形成一条具有二维或三维空间结构的双链DNA。由于它是引发剂引起的反应,可以有效减少假阳信号,降低背景电流。此外,每一引发剂可以触发一个HCR反应形成长链dsDNA,致使许多寡核苷酸连接在一起,在电化学传感器信号放大方面显示出了巨大的潜力。Chen等[76]利用杂交链式反应信号放大技术构建了超灵敏电致化学发光传感器(图22)。通过杂交链式反应得到的长链dsDNA能将大量的发光物质嵌入其中,大大提高了传感器灵敏度。Chen等[77]同样也利用杂交链式反应形成dsDNA结合电活性物质氨基钌构建了简单、灵敏的免标记型电化学传感器。由于杂交链式反应不需要酶的加入,以核苷酸链作为引发剂诱导链聚合,反应条件温和,操作简单,可适用于其他传感器的信号放大。
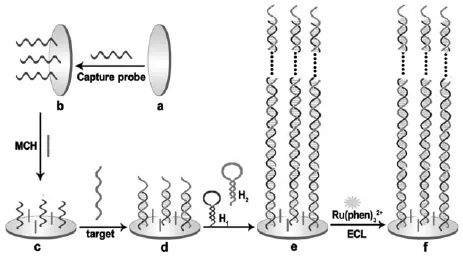
图22 基于杂交链式反应信号放大的免标记型电致化学发光传感器原理示意图[76]Fig.22 Scheme of the principle for the label-free ECL biosensor with hybridization chain reaction amplification[76]
Zhao等[78]将杂交链式反应和酶标记信号放大技术连用构建了多重信号放大电化学适体传感器用于干扰素的测定(图23)。通过杂交链式反应得到的长链dsDNA标记有大量的生物素,可以在生物素—亲和素的作用下成功将碱性磷酸酶标记在长链dsDNA上。碱性磷酸酶具有催化特性,能催化检测底液中磷酸盐水解产生电活性物质而形成催化放大体系。该传感器具有高的灵敏度,对干扰素的检出限达到了0.3 nmol/L。
3.4 目标循环信号放大技术在电化学适体传感器中的应用
目标循环是近年来快速发展起来的一种信号放大技术,被越来越多的用于基础理论的研究和临床实际样品检测中。目标循环信号放大技术是利用内切酶或者外切酶将与目标分析物等结合的适体或其互补链切断,释放出目标分析物或互补链,释放出的目标分析物或互补链进行下一个结合—剪切循环,经过不断的重复利用,达到信号放大的效果。自Kiesling等[79]利用内切酶结合激光诱导荧光联合毛细管电泳进行目标循环信号放大检测后,该信号放大技术在电化学方法上得到了快速的发展。Cao等[80]基于小分子目标分析物连接适体和核酸内切酶构架了新型电化学传感器(图24)。在该传感器中,小分子目标分析物与适体结合后能有效保护核酸内切酶对适体的破坏。利用适体能与修饰在电极表面的互补链捕获探针进行杂交反应,将小分子目标分析物和适体修饰在电极表面。此时核酸内切酶对适体进行剪切释放出互补链捕获探针,用于结合更多的小分子目标分析物和适体。这个过程导致电极表面空间位阻减少,得到增强的电化学信号。实验表明,该传感器对小分子叶酸受体目标分析物的检测范围为0.3~5 ng/mL,检测线为0.19ng/mL。Tong等[81]基于外切酶催化目标分析物循环放大构建了用于高灵敏检测赭曲霉素的电化学适体传感器。赭曲霉素适体与赭曲霉素结合后离开电极表面进入溶液并释放出二茂铁标记的互补单链,二茂铁距离电极表面距离缩短,得到较强的电化学信号。此时,利用外切酶将溶液中与赭曲霉素结合的适体破坏并释放出赭曲霉素,而释放出的赭曲霉素又能与电极表面的适体结合,释放出更多二茂铁标记的互补单链,使得电化学信号大大增强,检测灵敏度得到了有效的提高。

图23 基于杂交链式反应和酶标记双重信号放大的干扰素电化学适体传感器[78]Fig.23 Scheme of electrochemical aptasensor based on hybridization chain reaction with enzyme-signal amplification for interferon-gamma detection[78]

图24 基于核酸内切酶信号放大的电化学适体传感器[80]Fig.24 Scheme of electrochemical aptasensor based on nicking endonuclease-assisted amplification[80]
[1]Ellington A D,Szostak J W.In vitro selection of RNA molecules that bind specific ligands[J].Nature,1990, 346(6287):818~822.
[2]Tuerk C,Gold L.Systematic evolution of ligands by exponential enrichment:RNA ligands to bacteriophage T4 DNA polymerase[J].Science,1990,249(4968):505~ 510.
[3]Jayasena S D.Aptamers:An emerging class of molecules that rival antibodies in diagnostics[J].Clinical Chemistry,1999,45(9):1 628~1 650.
[4]Song S,Wang L,Li J,et al.Aptamer-based biosensors [J].Trac-Trends in Analytical Chemistry,2008,27(2): 108~117.
[5]Wu Z S,Guo M M,Zhang S B,et al.Reusable electrochemical sensing platform for highly sensitive detection ofsmallmoleculesbased on structure-switching signaling aptamers[J].Analytical Chemistry,2007,79 (7):2 933~2 939.
[6]Virno A,Randazzo A,Giancola C,et al.A novel throm-bin binding aptamer containing a G-LNA residue[J]. Bioorganic&Medicinal Chemistry, 2007,15(17): 5 710~5 718.
[7]Ling J,Morley S J,Pain V M,et al.The histone 3'-terminal stern-loop-binding protein enhances translation through a functional and physical interaction with eukaryotic initiation factor 4G(eIF4G)and eIF3[J].Molecular and Cellular Biology,2002,22(22):7 853~7 867.
[8]Kensch O,Connolly B A,Steinhoff H J,et al.HIV-1 reverse transcriptase-pseudoknot RNA aptamer interaction has a binding affinity in the low picomolar range coupled with high specificity[J].Journal of Biological Chemistry, 2000,275(24):18 271~18 278.
[9]Liu Y,Tuleouva N,Ramanculov E,et al.Aptamer-based electrochemical biosensor for interferon gamma detection [J].Analytical Chemistry,2010,82(19):8 131~8 136.
[10]Drabovich A P,Berezovski M,Okhonin V,et al.Selection of smart aptamers by methods of kinetic capillary electrophoresis[J].Analytical Chemistry,2006,78(9):3 171 ~3 178.
[11]Huang Y F,Chang H T,Tan W H.Cancer cell targeting using multiple aptamers conjugated on nanorods[J]. Analytical Chemistry,2008,80(3):567~572.
[12]Jiang Y X,Zhu C F,Ling L S,et al.Specific aptamerprotein interaction studied by atomic force microscopy [J].Analytical Chemistry,2003,75(9):2 112~2 116.
[13]王成刚,莫志宏.核酸适体技术研究进展 [J].生物医学工程学杂志,2006,23:463~466.
[14]谢海燕,陈薛钗,邓玉林.核酸适配体及其在化学领域的相关应用[J].化学进展,2007,19:1 026~1 033.
[15]De Cristofaro R,Akhavan S,Altomare C,et al.A natural prothrombin mutant reveals an unexpected influence of A-chain structure on the activity of human alpha-thrombin[J].Journal of Biological Chemistry,2004,279(13): 13 035~13 043.
[16]DiCera E,Dang Q D,Ayala Y M.Molecular mechanisms of thrombin function[J].Cellular and Molecular Life Sciences,1997,53(9):701~730.
[17]Pineda A O,Savvides S N,Waksman G,et al.Crystal structure of the anticoagulant slow form of thrombin[J]. Journal of Biological Chemistry,2002,277(43):40 177~ 40 180.
[18]Singh R R,Chang J Y.Structural stability of human alpha-thrombin studied by disulfide reduction and scrambling[J].Biochimica Et Biophysica Acta-Proteins and Proteomics,2003,1651(1-2):85~92.
[19]Pirkle H,Theodor I.Thrombin-like venom enzymes structure and function[J].Advances in Experimental Medicine and Biology,1990,281:165~175.
[20]Tu Y H,Cheng G F,Li L,et al.Detection of thrombin with a novel nano-biosensor based on aptamer fluorescence[J].Chemical Journal of Chinese Universities-Chinese,2006,27(12):2 266~2 270.
[21]Tasset D M,Kubik M F,Steiner W.Oligonucleotide inhibitors of human thrombin that bind distinct epitopes [J].Journal of Molecular Biology,1997,272(5):688~ 698.
[22]Pavlov V,Xiao Y,Shlyahovsky B,et al.Aptamer-functionalized Au nanoparticles for the amplified optical detection of thrombin [J].Journal of the American Chemical Society,2004,126(38):11 768~11 769.
[23]Wei H,Li B L,Li J,et al.Simple and sensitive aptamerbased colorimetric sensing of protein using unmodified gold nanoparticle probes[J].Chemical Communications, 2007,36:3 735~3 737.
[24]Bai L J,Yuan R,Chai Y Q,et al.Bi-enzyme functionlized hollow PtCo nanochains as labels for an electrochemical aptasensor[J].Biosensors&Bioelectronics, 2011,26(11):4 331~4 336.
[25]Xiang Y,Qian X Q,Zhang Y Y,et al.A reagentless,disposable and multiplexed electronic biosensing platform: application to molecular logic gates[J].Biosensors& Bioelectronics,2011,26(6):3 077~3 080.
[26]Radi A E,Sanchez J L A,Baldrich E,et al.Reusable impedimetric aptasensor[J].Analytical Chemistry,2005, 77(19):6 320~6 323.
[27]Xu D K,Xu D W,Yu X B,et al.Label-free electrochemical detection for aptamer-based array electrodes[J]. Analytical Chemistry,2005,77(16):5 107~5 113.
[28]Hea Yeon L,Man Bock G,Yeon Seok K,et al.Electrochemical detection of 17beta-estradiol using DNA aptamer immobilized gold electrode chip[J].Biosensors& Bioelectronics,2007,22(11):2 525~2 531.
[29]Rodriguez M C,Kawde A N,Wang J.Aptamer biosensor for label-free impedance spectroscopy detection of proteins based on recognition-induced switching of the surface charge[J].Chemical Communications,2005,34: 4 267~4 269.
[30]Degefa T H,Kwak J.Label-free aptasensor for plateletderived growth factor(PDGF)protein [J].Analytica Chimica Acta,2008,613(2):163~168.
[31]Xiao Y,Piorek B D,Plaxco K W,et al.A reagentless signal-on architecture for electronic,aptamer-based sensors via target-induced strand displacement[J].Journalofthe American ChemicalSociety,2005,127(51), 17 990~17 991.
[32]Zuo X L,Song S P,Zhang J,et al.A target-responsive electrochemical aptamer switch (TREAS)for reagentless detection of nanomolar ATP[J].Journal of the American Chemical Society,2007,129(5):1 042~1 043.
[33]Numnuam A,Chumbimuni-Torres K Y,Xiang Y,et al. Aptamer-based potentiometric measurements of proteins using ion-selective microelectrodes[J].Analytical Chemistry,2008,80(3):707~712.
[34]Wang J,Meng W Y,Zheng X F,et al.Combination of aptamer with gold nanoparticles for electrochemical signal amplification:application to sensitive detection of platelet-derived growth factor[J].Biosensors&Bioelectronics,2009,24(6):1 598~1 602.
[35]Lee J A,Hwang S,Kwak J,et al.An electrochemical impedance biosensor with aptamer-modified pyrolyzed carbon electrode for label-free protein detection[J].Sensors and Actuators B-Chemical,2008,129(1):372~379.
[36]Zayats M,Huang Y,Gill R,et al.Label-free and reagentless aptamer-based sensors for small molecules[J].Journal of the American Chemical Society,2006,128(42): 13 666~13 667.
[37]Yage P,Dongdong Z,Yan L,et al.Label-free and sensitive faradic impedance aptasensor for the determination of lysozyme based on target-induced aptamer displacement[J].Biosensors&Bioelectronics,2009,25(1):94~ 99.
[38]Shen L,Chen Z,Li Y H,et al.A chronocoulometric aptamer sensor for adenosine monophosphate[J].Chemical Communications,2007,21:2 169~2 171.
[39]Du Y,Chen C G,Yin J Y,et al.Solid-State Probe Based Electrochemical Aptasensor for Cocaine:A Potentially Convenient,Sensitive,Repeatable,and Integrated Sensing Platform for Drugs[J].Analytical Chemistry,2010, 82(4):1 556~1 563.
[40]Du Y,Chen C G,Li B L,et al.Layer-by-layer electrochemical biosensor with aptamer-appended active polyelectrolyte multilayer for sensitive protein determination [J].Biosensors&Bioelectronics,2010,25(8):1 902~ 1 907.
[41]Lai R Y,Plaxco K W,Heeger A J,Aptamer-based electrochemical detection of picomolar platelet-derived growth factor directly in blood serum [J].Analytical Chemistry,2007,79(1):229~233.
[42]Xiao Y,Lubin A A,Heeger A J,et al.Label-free electronic detection of thrombin in blood serum by using an aptamer-based sensor[J].Angewandte Chemie-International Edition,2005,44(34):5 456~5 459.
[43]Hu R,Fu T,Zhang X B,et al.Shen,signal-on electrochemical DNAzyme sensing system[J].Chemical Communications,2012,48(76):9 507~9 509.
[44]Xu L P,Wang S Q,Dong H F,et al.Fractal gold modified electrode forultrasensitive thrombin detection[J]. Nanoscale,2012,4(12):3 786~3 790.
[45]McMullan M,Sun N J,Papakonstantinou P,et al.Aptamer conjugated Mo(6)S(9-x)I(x)nanowires for direct and highly sensitive electrochemical sensing of thrombin[J]. Biosensors&Bioelectronics,2011,26(5):1 853~1 859.
[46]Feng K J,Sun C H,Kang Y,et al.Label-free electrochemical detection of nanomolar adenosine based on target-induced aptamer displacement[J].Electrochemistry Communications,2008,10(4):531~535.
[47]Radi A E,Sanchez J L A,Baldrich E,et al.Reagentless, reusable,ultrasensitive electrochemical molecular beacon aptasensor[J].Journal of the American Chemical Society,2006,128(1):117~124.
[48]Zhang Y L,Huang Y,Jiang J H,et al.Electrochemical aptasensor based on proximity-dependent surface hybridization assay for single-step,reusable,sensitive protein detection[J].Journal of the American Chemical Society,2007,129(50):15 448~15 449.
[49]Zuo X L,Xiao Y,Plaxco K W.High specificity,electrochemical sandwich assays based on single aptamer sequences and suitable for the direct detection of smallmolecule targets in blood and other complex matrices[J]. Journal of the American Chemical Society,2009,131 (20):6 944~6 945.
[50]Lao R J,Song S P,Wu H P,et al.Electrochemical interrogation of DNA monolayers on gold surfaces[J].Analytical Chemistry,2005,77(19):6 475~6 480.
[51]Herne T M,Tarlov M J.Characterization of DNA probes immobilized on gold surfaces[J].Journal of the American Chemical Society,1997,119(38):8 916~8 920.
[52]Xu Y,Yang L,Ye X Y,et al.An aptamer-based protein biosensor by detecting the amplified impedance signal [J].Electroanalysis,2006,18(15):1 449~1 456.
[53]Ross S E,Carson S D,Fink L M.Effects of detergents on avidin-biotion interaction[J].Biotechniques,1986,4(4): 350~354.
[54]Kawde A N,Rodriguez M C,Lee T M H,et al.Label-free bioelectronic detection of aptamer-protein interactions [J].Electrochemistry Communications,2005,7(5):537~ 540.
[55]Liao Y H,Yuan R,Chai Y Q,et al.In-situ produced ascorbic acid as coreactant for an ultrasensitive solidstate tris(2,2'-bipyridyl)ruthenium(II)electrochemiluminescence aptasensor[J].Biosensors&Bioelectronics, 2011,26(12):4 815~4 818.
[56]Zhang S S,Xia J P,Li X M.Electrochemical Biosensor for Detection of Adenosine Based on Structure-Switching Aptamer and Amplification with Reporter Probe DNA Modified Au Nanoparticles[J].Analytical Chemistry, 2008,80(22):8 382~8 388.
[57]Wang J L,Wang F,Dong S J.Methylene blue as an indicator for sensitive electrochemical detection of adenosine based on aptamer switch[J].Journal of Electroanalytical Chemistry,2009,626(1-2):1~5.
[58]Katz E,Willner I.Probing biomolecular interactions at conductive and semiconductive surfaces by impedance spectroscopy:Routes to impedimetric immunosensors, DNA-Sensors,and enzyme biosensors[J].Electroanalysis,2003,15(11):913~947.
[59]Deng C Y,Chen J H,Nie Z,et al.Impedimetric Aptasensor with Femtomolar Sensitivity Based on the Enlargement of Surface-Charged Gold Nanoparticles[J]. Analytical Chemistry,2009,81(2):739~745.
[60]Kuang H,Chen W,Xu D H,et al.Fabricated aptamerbased electrochemical"signal-off"sensor of ochratoxin A[J].Biosensors&Bioelectronics,2010,26(2):710~ 716.
[61]Du Y,Chen C G,Li B L,et al.Layer-by-layer electrochemical biosensor with aptamer-appended active polyelectrolyte multilayer for sensitive protein determination [J].Biosensors& Bioelectronics,2010,25(8):1 902~ 1 907.
[62]Ding C F,Ge Y,Lin J M.Aptamer based electrochemical assay for the determination of thrombin by using the amplification of the nanoparticles[J].Biosensors&Bioelectronics,2010,25(6):1 290~1 294.
[63]Tang D P,Yuan R,Chal Y Q.Ultrasensitive electrochemical immunosensor for clinical immunoassay using thionine-doped magnetic gold nanospheres as labels and horseradish peroxidase as enhancer [J].Analytical Chemistry,2008,80(5):1 582~1 588.
[64]Fu Y C,Wang T,Bu L J,et al.A post-labeling strategy based on dye-induced peeling of the aptamer off singlewalled carbon nanotubes for electrochemical aptasensing [J].ChemicalCommunications,2011,47(9):2 637~ 2 639.
[65]Xiang Y,Zhang Y Y,Qian X Q,et al.Ultrasensitive aptamer-based protein detection via a dual amplified biocatalytic strategy[J].Biosensors&Bioelectronics,2010, 25(11):2 539~2 542.
[66]Li Y,Qi H L,Gao Q A,et al.Nanomaterial-amplified "signal off/on"electrogenerated chemiluminescence aptasensors for the detection of thrombin[J].Biosensors& Bioelectronics,2010,26(2):754~759.
[67]Zhao J,Lin F B,Yi Y H,et al.Dual amplification strategy of highly sensitive thrombin amperometric aptasensor based on chitosan-Au nanocomposites[J].Analyst, 2012,137(15):3 488~3 495.
[68]Centi S,Tombelli S,Minunni M,et al.Aptamer-based detection of plasma proteins by an electrochemical assay coupled to magnetic beads[J].Analytical Chemistry, 2007,79(4):1 466~1 473.
[69]Bai L J,Yuan R,Chai Y Q,et al.Direct electrochemistry and electrocatalysis of a glucose oxidase-functionalized bioconjugate as a trace label for ultrasensitive detection of thrombin[J].Chemical Communications,2012,48 (89):10 972~10 974.
[70]Travascio P,Li Y F,Sen D.DNA-enhanced peroxidase activity of a DNA aptamer-hemin complex[J].Chemistry &Biology,1998,5(9):505~517.
[71]Tang J,Hou L,Tang D P,et al.Hemin/G-quadruplexbased DNAzyme concatamers as electrocatalysts and biolabels for amplified electrochemicalimmunosensing of IgG1[J].ChemicalCommunications,2012,48(66): 8 180~8 182.
[72]Zhou Y L,Wang M,Meng X M,et al.Amplified electrochemical microRNA biosensor using a hemin-G-quadruplex complex as the sensing element[J].Rsc Advances,2012,2(18):7 140~7 145.
[73]Shen B J,Wang Q,Zhu D,et al.G-quadruplex-based DNAzymes aptasensor for the amplified electrochemical detection of thrombin[J].Electroanalysis,2010,22(24): 2 985~2 990.
[74]Zhang H X,Jiang B Y,Xiang Y,et al.Label-free and amplified electrochemical detection of cytokine based on hairpin aptamer and catalytic DNAzyme[J].Analyst, 2012,137(4):1 020~1 023.
[75]Dirks R M,Pierce N A.Triggered amplification by hybridization chain reaction[J].Proceedings of the National Academy of Sciences of the United States of America,2004,101(43):15 275~15 278.
[76]Chen Y,Xu J,Su J,et al.In situ hybridization chain reaction amplification for universal and highly sensitive electrochemiluminescent detection of DNA[J].Analyti-cal Chemistry,2012,84(18):7 750~7 755.
[77]Chen X,Hong C Y,Lin Y H,et al.Enzyme-free and label-Free ultrasensitive electrochemical detection of human immunodeficiency virus DNA in biological samples based on long-range self-assembled DNA nanostructures [J].Analytical Chemistry,2012,84(19):8 277~8 283.
[78]Zhao J J,Chen C F,Zhang L L,et al.An electrochemical aptasensor based on hybridization chain reaction with enzyme-signal amplification for interferon-gamma detection[J].Biosensors&Bioelectronics,2012,36(1):129~ 134.
[79]Kiesling T,Cox K,Davidson E A,et al.Sequence specific detection of DNA using nicking endonuclease signal amplification(NESA)[J].Nucleic Acids Research,2007,35 (18):e117.
[80]Cao Y,Zhu S,Yu J C,et al.Protein detection based on small molecule-linked DNA[J].Analytical Chemistry, 2012,84(10):4 314~4 320.
[81]Tong P,Zhang L,Xu J J,et al.Simply amplified electrochemical aptasensor of Ochratoxin A based on exonuclease-catalyzed target recycling [J].Biosensors & Bioelectronics,2011,29(1):97~101.
Studies on electrochemical aptasensor for thrombin dectrion
Yuan Ya-li,Yuan Ruo,Chai Ya-qin*
(College of Chemistry and Chemical Engineering,Southwest University,Chongqing 400715,China)
Thrombin,a kind of serine protease that involved in thrombosis and hemostasis,plays an important role in revealing tumorigenesis mechanism and judgment of early diagnosis,curative effect and prognosis.Since the concentration of thrombin in blood reaches to nmol/L,create a simple,rapid and high-sensitivity method for detection of thrombin is extremely important.Electrochemical aptasensor,the combination of SELEX-screened aptamers and electrochemical sensors,integrates the advantages of high sensitivity,fast response,simple operation and low cost of electrochemical sensors as well as high selectivity and specificity of aptamer,which thus provids very broad application prospects in the field of thrombin detection.Here,after general introduction of aptamer including its in vitro selection,characteristic and interaction with thrombin,the principles,classification,immobilization method and associated electrochemical analysis techniques of the electrochemical aptasensor were described in detail.Moreover,the application of signal amplificatory strategy for electrochemical aptasenor was highlighted.
nanomaterial;biosensor;electrochemical;application
国家自然科学基金资助项目(21075100,21275119)
*通讯联系人,E-mail:yqchai@swu.edu.cn
