酒精性痴呆大鼠海马神经细胞凋亡与氧化应激的研究
2013-03-11杨海玉吴晓牧曾玉娥
杨海玉,吴晓牧,刘 勇,曾玉娥
慢性酒精中毒对于人类健康的危害日趋严重。酒精性痴呆(alcohol-associated dementia,AAD)是指由于长期饮酒导致慢性脑器质性损害而出现记忆缺损并伴有一种或一种以上认知功能受损的精神行为异常,同时可伴有震颤、谵妄、痉挛发作等神经功能障碍,记忆受损是其最重要和最基本的特征[1]。研究结果显示慢性酒精中毒已成为诱导痴呆发病的重要因素,AAD 患者可占痴呆发病人群的21%~24%[2]。由于其治疗手段有限且治疗效果不佳,大多数AAD 患者不能完全恢复至正常。因此,深入研究酒精诱导学习记忆功能损害的机制,对于寻求更为有效的AAD 治疗方法具有十分重要的意义。研究认为海马具有特殊的神经结构基础,是调控学习记忆功能的关键脑区。目前研究表明酒精诱导海马损伤的机制较为复杂,可从神经细胞、突触可塑性以及学习记忆相关分子等多方面对学习记忆功能造成损害[3]。本研究通过建立酒精性痴呆大鼠模型,以大鼠Morris 水迷宫(Morris water maze,MWM)行为学检测评价其学习记忆功能,并且观察大鼠海马神经细胞凋亡状况以及血清氧化应激指标的变化,探讨其与酒精诱导学习记忆功能损害的关系。
1 材料与方法
1.1 AAD 大鼠模型的建立
采用8 周龄雄性SD 大鼠(180~220g)(北京维通利华实验动物技术有限公司)。按完全随机区组法将动物分为生理盐水组(n=6)和酒精组(n=8)。酒精组大鼠给予持续酒精灌胃(20%,8ml/kg)28d,每天1 次。生理盐水组给予等量生理盐水灌胃。
1.2 MWM 行为学检测[4]
检测动物从入水至寻找到平台的时间,即逃避潜伏期(escape latency,EL),并以此作为衡量动物学习记忆能力的标准。实验规定大鼠最长游泳时间为60s,如动物在60s 内找不到平台,则将其引导至平台停留20s,记录该次EL 为60s。所有大鼠在检测前均接受训练5d。各组大鼠分别于灌胃前和灌胃28d 后进行MWM 行为学检测。每只动物以3 次游泳成绩(分别从3 个入水点记录)的平均值作为该动物的EL。
1.3 大鼠海马神经细胞凋亡检测
各组大鼠于灌胃28d MWM 行为学检测结束后处死取脑。选取大鼠海马区进行组织切片,经脱蜡、水化处理后用PBS 洗3 次,然后每张切片滴加适量Hoechst 33342 染色液(碧云天生物技术研究所)覆盖组织,避光染色10min,PBS 洗3 次后封片,采用荧光显微镜(德国徕卡)20 倍镜下观察取图。每只大鼠各选取1 张切片,每张切片双侧海马的海马齿状回(dentate gyrus,DG)和CA1区分别随机选取3个视野,并进行凋亡神经细胞计数。凋亡细胞的特征表现为细胞核呈明显固缩、浓染。
1.4 氧化应激检测
各组大鼠处死前取血清放-80℃冰箱冻存备用。实验方法严格按总超氧化物歧化酶(total superoxide dismutase,T-SOD)测试盒和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)测试盒(南京建成)说明书进行。采用紫外分光光度计分别检测T-SOD 反应液(550nm)和 GSH-Px 反应液(412nm)的光密度(opticaldensity,OD)值。每个样品重复检测3 次,取平均值进行统计学分析。
1.5 统计学处理
2 结果
2.1 MWM 检测结果
为了评价酒精对大鼠学习记忆功能的影响,我们对各组大鼠进行了MWM 行为学检测。实验结果显示建模前两组大鼠的EL 时间无明显差异(P>0.05);而大鼠在给予酒精灌胃28d 后,与生理盐水组相比,其EL 时间明显延长,结果具有统计学显著差异(P<0.05)(见表1)。
2.2 海马神经细胞凋亡检测结果
如图1 所示,酒精组大鼠海马DG 区可见大量聚集分布的异形、致密浓染凋亡细胞(见图1B,Eth),而生理盐水组大鼠海马DG 区仅见少量浓染凋亡细胞(见图1A,Con)。凋亡细胞计数结果显示,与生理盐水组相比,酒精组大鼠海马DG 区(16.00±0.89 vs.99.5 0±12.39,cells,P<0.01)和CA1区(9.50±2.18 vs.35.83±4.45,cells,P<0.01)中的凋亡神经细胞数量均明显增加。
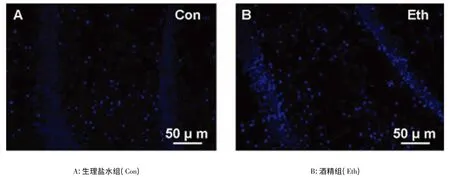
图1 大鼠海马齿状回神经细胞凋亡检测结果
2.3 大鼠血清氧化应激检测结果
表2 数据显示与生理盐水组相比,大鼠给予酒精灌胃28d 后,其血清中GSH-Px 的酶活力明显抑制,结果有统计学差异(P<0.01);而T-SOD 的酶活力虽有下降趋势,但结果无统计学差异(P>0.05)。
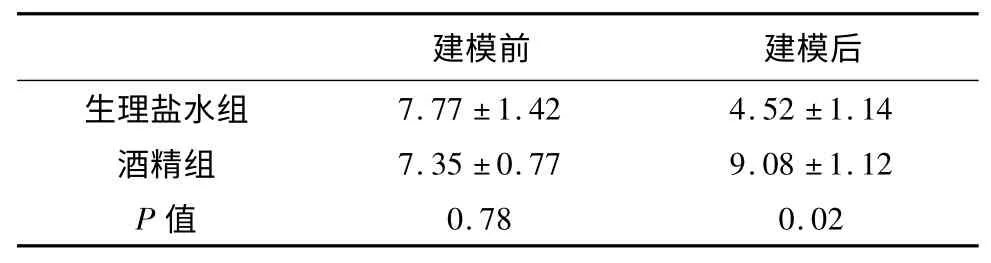
表1 各组大鼠MWM 检测EL 比较(s)

表2 各组大鼠血清氧化应激指标检测结果(U/ml)
3 讨论
AAD 是慢性酒精中毒最为严重的精神病状态,也是长期大量饮酒引起脑器质性损害的结果,临床表现记忆力缺损伴其他认知功能障碍为其主要特征。本研究通过持续酒精灌胃28d 建立AAD 大鼠模型,经MWM 行为学检测证实其EL 时间显著延长,提示酒精对大鼠学习记忆功能造成损伤。研究认为海马是调控学习记忆功能的关键脑区,在短时记忆转为长时记忆以及空间航行定位功能中具有重要作用。大量研究证实长期慢性饮酒可促使海马体积减小及海马区大量神经细胞凋亡。Oliveira-da-Silva 等[5]对出生后30~45d 的C57BL/6 小鼠给予腹腔注射酒精发现,酒精作用可导致海马大部分区域(包括齿状回颗粒层及分子层、CA1、CA2和CA3区)的凋亡细胞数目增加,而且神经元及胶质细胞密度明显减少。Vongvatcharanon 等[6]对3 月龄雌性成年Wistar 大鼠给予低浓度和高浓度酒精作用3w~0.5y发现,各组大鼠海马区和扣带回皮质γ-氨基丁酸能神经元减少和神经小胶质细胞增加,并且这种改变随着饮酒时间的延长而增加。同样,本研究也证实了酒精可诱导大鼠海马区神经细胞发生显著凋亡。以上结果提示酒精促进海马神经元凋亡是其导致学习记忆功能损伤的重要机制。
目前研究认为氧化应激是酒精诱导神经元凋亡的重要机制。氧化应激是指由于体内氧化与抗氧化作用失衡,活性氧自由基产生过多而超出机体清除能力,氧自由基可透过细胞膜脂质层与胞膜结构发生反应,进而损伤细胞膜并导致细胞死亡。研究证实长期慢性饮酒可通过抑制抗氧化酶的活性使细胞内氧自由基生成过多,从而造成细胞损伤[7,8]。GSH-Px 是机体内广泛存在的一种过氧化物分解酶,也是衡量机体抗氧化能力的重要指标之一。GSH-Px的活性中心是硒半胱氨酸,它能催化GSH 变为GSSG,使有毒的过氧化物还原成无毒的羟基化合物,从而保护细胞膜的结构及功能不受过氧化物的损害。超氧化物歧化酶(superoxide dismutase,SOD)也是重要的抗氧化酶之一,广泛分布于各种生物体内,是机体内清除氧自由基的关键酶。Scolaro 等[9]研究发现慢性酒精作用可明显抑制大鼠海马及血清中GSH-Px 的酶活力,而对SOD 的酶活力却有上调作用。在本研究中,我们同样证实酒精可明显抑制大鼠血清GSH-Px 的酶活力,但对T-SOD 的作用不明显,提示酒精对机体抗氧化能力的损伤主要与抑制GSH-Px 功能有关。由此,我们认为,针对性阻断酒精对GSH-Px 功能的抑制是进一步研究酒精性痴呆治疗方法的突破口。
[1]李舜伟.认知功能障碍的诊断与治疗[J].中国神经精神疾病杂志,2006,32(2):189-191.
[2]Smith DM,Atkinson RM.Alcoholism and dementia[J].Int J Addict,1995,30(13-14):1843-1869.
[3]Alfonso-Loeches S,Guerri C.Molecular and behavioral aspects of the actions of alcohol on the adult and developing brain[J].Crit Rev Clin Lab Sci,2011,48(1):19-47.
[4]Vorhees CV,Williams MT.Morris water maze:procedures for assessing spatial and related forms of learning and memory[J].Nat Protoc,2006,1(2):848-858.
[5]Oliveira-da-Silva A,Manhães AC,Cristina-Rodrigues F,et al.Hippocampal increased cell death and decreased cell density elicited by nicotine and/or ethanol during adolescence are reversed during drug withdrawal[J].Neuroscience,2010,167(1):163-173.
[6]Vongvatcharanon U,Mukem S,Udomuksorn W,et al.Alcohol administration during adulthood induces alterations of parvalbumin and glial fibrillary acidic protein immunoreactivity in rat hippocampus and cingulated cortex[J].Acta Histochem,2009,112(4):392-401.
[7]Zhong Y,Dong G,Luo H,et al.Induction of brain CYP2E1 by chronic ethanol treatment and related oxidative stress in hippocampus,cerebellum,and brainstem[J].Toxicology,2012,302(2-3):275-284.
[8]Wu D,Cederbaum AI.Oxidative stress mediated toxicity exerted by ethanol-inducible CYP2E1[J].Toxicol Appl Pharmacol,2005,207(2 Suppl):70-76.
[9]Scolaro B,Delwing-de Lima D,da Cruz JG,et al.Mate tea prevents oxidative stress in the blood and hippocampus of rats with acute or chronic ethanol administration[J].Oxid Med Cell Longev,2012,2012(3):314758.
