硫腺苷同型半胱氨酸——可能是一种新的脑血管疾病危险因素
2013-03-11常明秀综述陈立杰审校
曹 月,常明秀,王 锐 综述,陈立杰 审校
目前,脑血管疾病是全球患病率和致死、致残率都较高的疾病之一,美国因脑血管疾病死亡的患者占所有死亡患者的41.4%,而动脉粥样硬化是该类疾病的重要病理基础,但其具体作用机制不清。前期大量研究认为血同型半胱氨酸水平(Homocysteine,Hcy)升高可以引起血管平滑肌细胞(Vascular Smooth Muscle Cells,VSMCs)增殖,而它的移行和增殖是动脉粥样硬化(atherosclerosis,AS)形成的中心环节之一,因此人们广泛认为同型半胱氨酸是脑血管疾病的独立危险因子[1]。但最新有研究指出,高蛋氨酸(methionnine,Met)膳食引起的血管损伤或血管动脉粥样硬化病变与血浆中高Hcy 水平并无直接关系,既往的研究逐渐面临挑战。
1 脑血管疾病危险因素
脑血管疾病的发生是多种因素共同作用的结果,其中主要的危险因素包括性别、年龄、种族等不可控危险因素,同时还有吸烟、饮酒、高血压、高血脂、糖尿病、心脏病以及近年来一直被认为是脑血管疾病发生独立危险因素的高同型半胱氨酸血症等可控危险因素[2]。其中高同型半胱氨酸血症近年来被认为是较重要的独立危险因素。多项动物研究也发现饮食诱导的高Hcy 血症可以引起血管损伤,故许多学者积极探索其致病机理及作用方式,以期为未来疾病的治疗提供科学的治疗方案。
自从1969 年McCully 第一次提出了Hcy 水平的升高可以引起脑血管疾病发生的假设以来,血浆同型半胱氨酸与脑血管疾病的相关关系就成了学者们研究的重点。目前提出的几个关于高同型半胱氨酸血症诱发脑血管疾病发生的主要生物学机制为:直接引起血管内皮细胞[3]或者血管平滑肌细胞损伤[4,5],胆固醇和甘油三酯生物合成调节功能异常[6],抑制NO 合成[7],引起血管弹性组织损伤以及单核细胞活化[8],增加结缔组织的表达[9]等。由于血管平滑肌细胞增殖是动脉粥样硬化的标志,所以早期的研究主要集中在Hcy 对于血管平滑肌细胞的作用上,认为升高的血浆Hcy 可以通过诱导血管平滑肌细胞的增殖,促进动脉粥样硬化的形成[4]。还有研究称胱硫醚β 合成酶(cystathionine β-synthase,CBS)缺陷可促进Hcy 转变为胱硫醚,形成高Hcy 血症[10],最终引起神经系统异常、早期动脉粥样硬化改变,继而引起内皮细胞损伤以及促进血栓的形成等。另外一些研究认为Hcy 水平的增高还可以增加cyclin A 基因的表达,这是因为Hcy 可以通过结合ATF/cyclin AMP 反应性化学结合位点激活cyclin A 基因,诱导特定基因改变进而改变基因甲基化状态。此外,Hcy 浓度的改变会影响甲硫氨酸循环,而甲硫氨酸循环中一个甲基化反应还可以诱导一氧化氮合酶抑制剂非对称二甲基精氨酸(ADMA)的形成,进而会抑制NO 的合成[7],但是Hcy 致血管疾病发生的明确机制尚待进一步研究。
2 硫腺苷同型半胱氨酸(S-Adenosyl-L-homocysteine,SAH)可能是脑血管疾病新的危险因素
早期通过测定Hcy,人们认为Hcy 是脑血管疾病的独立危险因素,但是随着研究的深入,人们逐渐发现血浆Hcy 的前体物质SAH 可能才是血管疾病的真正元凶,Hcy 可能只是SAH 反应中的一个伴随现象[11]。Loehrer 等人第一次提出,与对照组相比,终末期肾衰患者血浆SAH 水平升高约44 倍,但是血浆Hcy 水平仅仅升高约5 倍。2001 年的一项研究报道中指出,与对照组比较,CVD 患者的血浆SAH 水平明显升高,但是血浆Hcy 水平并未见明显差异[12],因此人们逐渐对Hcy 是脑血管疾病的独立危险因素提出了质疑,然而这并不足以说明血浆Hcy 水平没有测量意义,由于该项研究的样本太少,也同样不能说明任何其他具有Hcy 水平轻度增高的患者具有更大的危险性。
虽然Hcy 与SAH 以及硫腺苷蛋氨酸(S-adenosyl-L-methionine,SAM)/SAH 比率明显相关,但是有研究显示补充叶酸、维生素B6、维生素B12虽能使血浆中Hcy 维持在正常水平或者有所下降,但不能改善血管损伤,甚至血管损伤比血浆同型半胱氨酸升高的更为严重[11,13],Balligand 也指出维生素B 族混合物可以减少血浆同型半胱氨酸水平,但是不能提高内皮细胞的功能,通常也不能减轻氧化应激损伤。相反,供给含L-精氨酸的饮食则不能减少血浆同型半胱氨酸水平,但是可以提高内皮细胞的功能、减轻氧化应激损伤。所以高Hcy 致血管疾病的发生可能并不是其直接作用所致,而是由SAH 的蓄积和DNA 低甲基化介导的[14]。同时有研究认为Hcy 水平的增高具有致血管平滑肌细胞有丝分裂的作用[15,16]:虽然一定浓度的Hcy 促进血管平滑肌细胞增殖,而当Hcy 浓度过高时,会造成血管平滑肌细胞损伤,使得血管平滑肌细胞反而减少[17],这就表明Hcy 浓度增高与细胞增殖并不呈量效关系,因此,我们认为细胞内的SAH 水平可能才是血管损伤的真正元凶。
3 SAH 与DNA 甲基化
3.1 DNA 甲基化 DNA 甲基化是在甲基转移酶的催化下,DNA 的CG 两个核苷酸的胞嘧啶被选择性的添加了甲基基团的一种化学修饰作用,从而引起染色质结构、DNA 构象、DNA 稳定性及DNA 与蛋白质相互作用方式的改变。虽然DNA 甲基化未改变核苷酸顺序及其组成,但是可在转录水平,特别是转录起始阶段调控基因的表达[18],从而发挥基因调控作用。此前的多项研究认为DNA 甲基化水平与肿瘤性疾病有明显的相关性,但是近年来研究显示脑血管疾病的发生与DNA 甲基化水平的改变也有密不可分的关系。
3.2 DNA 甲基化与动脉粥样硬化 脑血管疾病的发病机制与多种因素相关,动脉粥样硬化导致血管损伤是其中主要机制之一。此前人们一直在研究动脉粥样硬化性疾病致血管损伤的致病机理及传导通路,但是随着后基因时代的到来以及基因测序的开展,基因组DNA 的全面低甲基化与特定基因的高甲基化改变被认为与动脉粥样硬化发生有关。Hiltunen 等[19]在人动脉粥样硬化斑块、载脂蛋白-E 基因敲除鼠动脉粥硬化斑块以及新西兰兔新生内膜中相继发现,组织基因组DNA 甲基化均呈现降低改变,这种变化可导致平滑肌细胞增生,促进动脉粥样硬化病变的发生,而某些特定基因,如雌激素受体基因ER-α、基质金属蛋白酶基因等的高甲基化改变也被认为与动脉粥样硬化相关。
3.3 SAH 是更敏感的甲基化指标 SAH 是体内甲硫氨酸循环中Hcy 的前体物质(见图1),此反应是由硫腺苷同型半胱氨酸水解酶催化的可逆反应,且在此平衡反应中,Hcy 逆向转化为SAH 的反应占优势,只有在Hcy 参与其他代谢使其含量减少时,SAH 转化为Hcy 反应才占主导[20]。机体细胞内大约有50 个反应都有甲基转化过程参与,SAH 是SAM 在甲基转移酶作用下,将甲基转移至另一物质(DNA、RNA 及蛋白质等生物大分子)后的代谢产物,因此其浓度水平可以反应机体细胞甲基化水平。与此同时,SAH 还可以作为DNA甲基转移酶的强力抑制剂,起到反馈抑制的作用而干扰细胞甲基化。虽然SAM 是体内甲基化反应的直接供体,但由于以往研究中SAM/SAH 比率下降被看做是细胞甲基化水平下降的标志[21],有实验显示血浆和淋巴细胞的SAM/SAH比率明显相关[22],所以血浆这个比率可以预测细胞甲基化水平,同时其他的研究结果支持DNA 甲基化与Hcy、SAH 水平呈负相关,而与SAM/SAH 比率不相关[14]。单独SAM 下降反应细胞甲基化不敏感,而SAH 水平增高或者同时伴有SAM 下降则与DNA 甲基化相关,所以SAH 与细胞甲基化水平有更大的相关性[23]。实际上与SAM 相比,SAH 与甲基转移酶有更高的亲合性[24],其对转甲基反应有更大的主动性和决定性,SAH 的浓度改变会引起机体甲硫氨酸循环中SAM水平的改变,致其含量的减少,从而引起低甲基化反应。因此,综上所述,我们有理由相信SAH 是甲基化的一个更为敏感的因素,与脑血管疾病具有更大的相关性。
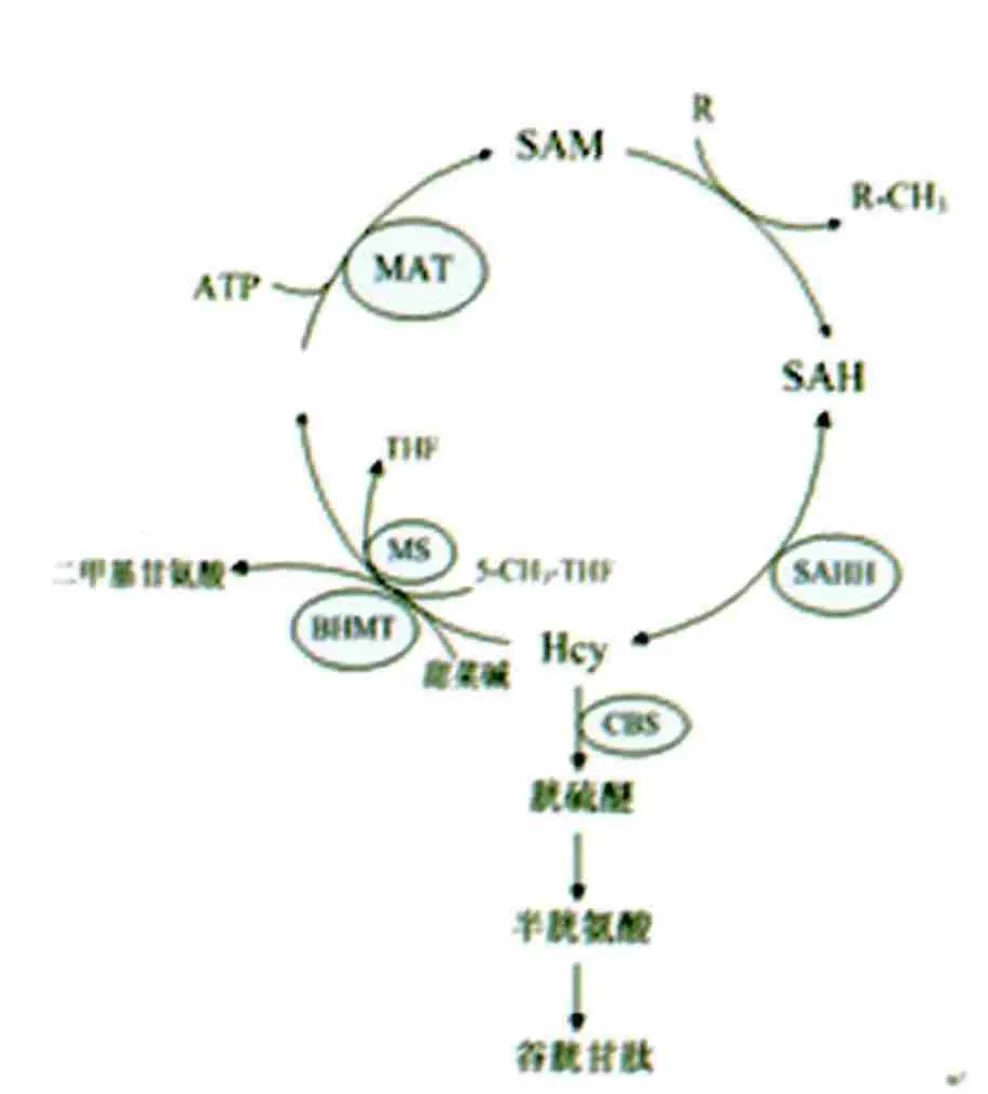
图1 甲硫氨酸循环
4 总结
与血浆Hcy 水平相比,体内甲硫氨酸循环的中间代谢产物SAH 水平近年来被认为是脑血管疾病更敏感的危险因素指标,其可能是通过干扰基因的甲基化水平,引起整体基因低甲基化或者个别基因高甲基化,进而使基因表达出现异常而诱发脑血管疾病发生。但是由于血浆SAH 浓度甚微,且其测定方法复杂,进行大规模血浆中SAH 的测定具有一定难度,故近年关于SAH 与脑血管疾病的直接关联性研究仍较少,我们期待未来有更加成熟的实验方法及更大规模的临床实验深入研究。
[1]张松涛,郑 勇.同型半胱氨酸在心脑血管疾病中的临床意义[J].检验医学与临床,2013,10(5):582-583.
[2]吕佩源,李春岩.脑血管病的危险因素与预防[J].中国全科医学,2004,7(18):1295-1296.
[3]谭红梅,赵 驰,吴伟康,等.同型半胱氨酸对血管内皮细胞增殖、贴壁和迁移的影响[J].中国病理生理杂志,2008,24(2):390-392.
[4]李丽娟,杨 艳,王树人.同型半胱氨酸对血管平滑肌细胞增殖的影响[J].现代医药卫生,2010,26(24):3687-3688.
[5]李 燕,张春来,卢 峰,等.高同型半胱氨酸血症对平滑肌细胞的氧化损伤[J].首都医科大学学报,2012,33(2):251-254.
[6]Werstuck GH,Lentz SR,Dayal S,et al.Homocysteine-induced endoplasmic reticulum stress causes dysregulation of the cholesterol and triglyceride biosynthetic pathways[J].J Clin Invest,2001,107:1263-1273.
[7]Balligand JL.Vitamin B or L-arginine supplementation in hyperhomocysteinae-mia:think twice![J].Cardiovascular Research Advance Access,2012.
[8]Zeng X,Dai J,Remick DG,et al.Homocysteine mediated expression and secretion of monocyte chemoattractant protein 1 and interleukin-8 in human monocytes[J].Cirs Res,2003,93:311-320.
[9]Liu X,Luo F,Li J,et al.Homocysteine induces connective tissue growth factor expression in vascular smooth muscle cells[J].Thromb.Haemost,2008,6(1):184-192.
[10]朱文丽,宋晓明,李孟忆,等.CBS 基因变异与血清同型半胱氨酸水平及先天性心脏病的关系研究[J].卫生研究,2008,37(4):463-467.
[11]Troen AM,Lutgens E,Smith DE,et al.The atherogenic effect of excess methionine intake[J].PNAS,2003,100(25):15089-15094.
[12]Kerins DM,Koury MJ,Capdevila A,et al.Plasma S-adenosylhomocysteine is a more sensitive indicator of cardiovascular disease than plasm homocysteine[J].Am J Clin Nutr,2001,74:723-729.
[13]Wagner C,Koury MJ.S-Adenosylhomocysteine-a better indicator of vascular disease than homocysteine?[J].Am J nutr,2007,86:1581-1585.
[14]Castro R,Rivera I,Ravasco P,et al.Increased Homocysteine and SAdenosylhomocysteine Concentrations and DNA Hypomethylation in Vascular Disease[J].Clincal Chemistry,2003,49:1292-1296.
[15]Desai A,Lankford HA,Warren JS.Homocysteine augments cytokineinducing chemokine expression in human vascular smooth muscle cells:implications for atherogenesis[J].Inflammation,2001,25:179-186.
[16]Liu XH,Shen J,Zhan R,et al.Proteomic analysis of homocysteine induced proliferation of cultured neonatal rat vascular smooth muscle cells[J].Biochim Biophys Acta,2009,1794(2):177-184.
[17]李丽娟,杨 艳,王树人.同型半胱氨酸对血管平滑肌细胞增殖的影响[J].现代医药卫生,2010,26(24):3687-3688.
[18]陶 冶,王 勇.DNA 甲基化及其新进展[J].国际妇产科学杂志,2010,37(5):340-343.
[19]Hiltunen MO,Ylä-Herttuala S.DNA methylation,smooth muscle cells,and atherogenesis[J].Arterioscler Thromb VascBiol,2003,23(10):1750-1753.
[20]袁 芹,凌文华.蛋氨酸代谢与动脉粥样硬化[J].国际内科学杂志,2008,35(3):170-173.
[21]Cantoni GL.The role of S-adenosylhomocysteine in the biological utilization of S-adenosylmethi-onine[J].Prog Clin Biol Res,1985,198:47-65.
[22]Melnyk S,Pogribna M,Pogribny IP,et al.Measurement of plasma and intracellular S-adenosylmethionine and S-adenosylhomocysteine utilizing coulometric electrochemical detection:alterations with plasma homocysteine and pyridoxal 5’-phosphate concentration[J].Clin Chem,2000,46:265-272.
[23]Caudill MA,Wang JC,Melnyk S,et al.Intracellular S-Adenosylhomocysteine Concentrations Predict Global DNA Hypomethylation in Tissues of Methyl-Deficient Cystathionine β-Synthase Heterozygous Mice[J].American Society for Nutritional Sciences,2001,131:2811-2818.
[24]Liu C,Wang Q,Guo HH,et al.Plasma S-Adenosylhomocysteine Is a Better Biomarker of Atherosclerosis Than Homocysteine in Apoli-poprotein E-Deficient Mice Fed High Dietary Methionine[J].The Journal of Nutrition,2008,138:311-315.
